При идентификации apicoplast генома, стало очевидно, что транскрипция и перевод его генов-резидентов (в том числе многих рибосомных белков), а также любых apicoplast конкретных функций, потребует сотрудничества дополнительных белков. Эти белки закодированы в ядре, и, следовательно, называются ядро-закодированы apicoplast-мишенью (неразбавленный) белки. Поиск баз данных EST Т. гондий для белков homolo-Гусь тем, которые содержатся в хлоропластах привело к иден-tification нескольких кандидатов на apicoplast рибосомных белков, а также некоторых ферментов, участвующих в биосинтезе жирных кислот. Первоначально два таких белок, белок-носитель ацила (АСР) и рибо-сомный белок S9 (S9), были подтверждены как локальными-роскопия к apicoplast с помощью микроскопического анализа с использованием специфической антисыворотки (Waller и др., 1998). Эти гены, в свою очередь,
Анализ последовательности ясно показал, что эти белки, все из которых были предсказаны, чтобы находиться в пределах просвета apicoplast, обладали N-терминальными расширения по сравнению с их bacte-риалом ортологов. В эукариотических организмах, такая EXTEN-сии часто содержат topogenic информации. Так, например, белки, локализованные в первичных хлор-Plasts, как правило, направлены через N-терминальный транзитный пептид непосредственно из цитозола. Локализация в
система обычно включает в себя секреторную последовательность сигнала N-TERMI-Nal. Эти presequences быстро удалены специфические ферменты обработки на импорт (Bruce, 2001).
Интересно, что в этих организмах со вторичными хлоропластами, N-концевыми удлины-видимому, содержат сигнальную последовательность, с последующей транзитной последовательностью (Nassoury и др., 2005). Эта организация является именно то, что наблюдается как для Т. гондий и P. фальципарум NEAT белков предсказанных проживать в apicoplast стромы (Waller и др., 1998). Использование гена слитого, Валлер и соавт. (1998) показали, что N-концевое удлинение Т. гондий ACP был в состоянии целевой зеленый флуоресцентный белок (GFP) в apicoplast. Кроме того, presequences П. малярийного предсказал NEAT белки были в состоянии целевых GFP к apicoplast Т. гондий. Эти данные свидетельствуют о том, что по крайней мере некоторые механизмы таргетинга сохраняются через Apicomplexa (Waller и др., 1998;. ДЖОМАА и др, 1999).
Оба сигнала и транзитные регионы N-терминального расширения аккуратных белков необходимы для целевой репортера к apicoplast (рис 9.6); удаление либо результатов в области неправильной адресности. Без транзитной последовательности, последовательность сигнала S9, предназначается для секреции GFP (DeRocher и др., 2000;. Юнг и др, 2001), что свидетельствует о том, что этот белок репортер вошел в секреторную систему. Аналогичная работа в P. малярийного показали, что N-концевой области ACP может предназначаться для GFP секреции (Валлер и др., 2000). Сигнальные последовательности этих белков не появляются отличаются от белков ориентированы на другие места в системе секреторной. В самом деле, в неопубликованных исследованиях, упомянутых Руса и соавт. (1999), замена эндогенной сигнальной последовательности с одним из гетерологичного секреторного белка не изменяет ориентации на apicoplast. Без сигнальной последовательности, транзитный пептид S9 направляет GFP в митохондрию (рис 9,6), в то время как цитозольная локализация видна с GFP слитых на транзитном пептид ферредоксин-НАДФ+редуктазы (FNR) в Т. гондий (Харб и др., 2004). Аналогичные результаты были замечены для АСР в малярийных паразитов (Waller и др., 2000). Взятые вместе, эти исследования указывают на то, что первый шаг в белке ориентации на apicoplast просвета входа в систему секреторной.

| APICOPLAST |
GFP DIC

S-GFP

Т-GFP,

S + Т-GFP,
Рисунок 9.6 Обе домены N-терминального расширение требуется для ориентации аккуратных белков. GFP-расплавы, содержащие весь расширение N-концевого рибосомального белок S9 (аа 1-159, S+Т-GFP), была выражена его сигнальная последовательность (аа 1-42, S-GFP), или его транзитная последовательность (аа 33-159-159, Т-GFP), у Т. гондий. Левые панели показывают GFP флуоресценции, в то время как правые панели показывают ДИК изображения одних и тех же клеток, которые, проживающих в пределах паразитофорной вакуоли в принимающих фибробластами. Со-локализация apicoplast маркеров (ДНК или ацетил-СоА-карбокси-Lase) показали, что одна точка наблюдается при экспрессии S+Т-GFP, соответствует apicoplast. Со-локализация митохондриальных маркеров HSP-60 и Mitotracker показали, что белок Т-GFP находится в митохондрии. S-GFP, находится в основном в паразитофорной вакуоли, хотя некоторые материалы можно рассматривать в системе эндомембранную паразита. Изображение предоставлено доктором Amy DeRocher.
Транзитные пептиды аккуратных белков различаются по длине, приблизительно от 50 до 200 аминокислот (аа), и весьма разнообразны по последовательности. Как хлоропласт тран-сидят пептиды, эти пептиды имеют несколько кислотных или гидрофобные остатки (Фот и др., 2003). В самом деле, транзитный пептид Т. гондий S9, когда слит
GFP, позволяет GFP быть импортированы в изолированных хлоропластах гороха (DeRocher и др., 2004). Apicoplast транзитных пептиды имеют суммарный положительный заряд. В гондий транзитных последовательностей T. обогащены серин и треонин, аминокислоты, показанных важные в транзитных пептидах растений (Bruce, 2001). P. транзитные пептиды фальципарум обогащены аспарагина и лизина ((Фот и др., 2003), а также мутационный анализ показал, что гидроксилированные остатки не имеет решающего значения для ориентации (Waller и др., 2000). Сайт-направленный мутагенез Р. фальципарум АСР транзитный пептид показал, что в то время как основные остатки в положениях 2 и 6 не были существенными, кислотный остаток в положении 2 предотвращенных apicoplast ориентации (Фот и др., 2003). Прогнозируемое HSP70 сайт связывания в транзитный пептид, было также установлено, иметь важное значение (Фот и др., 2003), предполагая, что содержание разложенной структуры может иметь важное значение в apicoplast адресности. Несколько исследований показали, что Т. гондий транзитные пептиды apicoplast содержат избыточную информацию, так как не перекрывающиеся сегменты все еще может опосредовать ориентации (DeRocher и др., 2000;. Юнг и др, 2001, 2003;. Харб и соавт, 2004). Подробное отображение транзитного пептида функций Т. гондий FNR позволяет предположить, что освобождение от ER, локализаций в apicoplast, связывание с Chaper-оны, и обработка определяется дискретными доменами (Харб и др., 2004).
Идентификация белков и NEAT-terization символа и на направл ющую последовательность двудольного apicoplast позволила развитие bioinfor-Matic моделей, которые предсказывают, какие белки могут быть локализованы в apicoplast паразитов малярии. Геном P. малярийного полностью собран, и существенные признаки транзитного пептида хорошо описаны, что позволяет генерировать нейронной сети (PATS; Zuegge и др., 2001), а также алгоритмы, основанные на правилах (PlasmoAP; Фот и Макфэдден, 2003), чтобы определить кандидата Plasmodium NEAT белки. Обе эти программы доступны через веб-интерфейс на PlasmoDB.org и PATS также можно найти на веб-сайте Modlab в Universität Франкфурте на Майне (https://gecco.org.chemie.uni-frankfurt.de/ Фиктивный / Фиктивный-index.php). Алгоритмы идентификации T. Gondii NEAT белки не были доступны, когда этот обзор был подготовлен; однако, с завершением аннотации для

222 APICOPLAST И митохондрия токсоплазма
Т. гондий геном (ToxoDB 4,0, выпущен в июле 2006 года), разработка таких алгоритмов будет высоким приоритетом.
ER 1
Обработка транзитных пептидов хлоропласта является быстрым, таким образом, что только зрелый белок виден при стационарных условиях (см, например, Шанклин и др., 1995). В противоположность этому, как зрелая форма и белок-предшественник, содержащий транзитный пептид наблюдаются для аккуратного белков, будь нативные белки или искусственные слитых генов (Валлер и др., 1998; DeRocher и др., 2005). Пульс-чейз исследования указывают на то, что мало обработки видно
N
A
г 2
до 45-120 минут после синтеза для Т. гондий и П. трехдневной ACP-GFP (ван Dooren и др., 2002;. DeRocher и др, 2005). Является ли эта задержка (по сравнению с хлоропластов процессинга белков) отражает время, необходимое для полного импорта или относительной неэффективности обработки, пока не ясно. П. фальципарум предполагаемый ортолог хлоропласта обработки стромальных пептидазы был идентифицирован (ван Dooren и др., 2002). Предсказанный белок включает в себя двудольный направл юща последовательность, предполагая, что она лежит в пределах apicoplast. Предполагаемый Т. гондий ортолог может быть обнаружен в моделях генного ToxoDB (значения Х ~ 10-50). Функциональная apicoplast требуется для обработки транзитного пептида в T. гондий (Он и др., 2001b). Однако, анализ S9 транзитного пептида инди-Кейтс, которые могут возникнуть несколько этапов обработки, первый из которых может иметь место до завершения импорта (Юнг и др., 2001) - возможность подтверждается исследованиями транзитного пептида FNR (Харб и др., 2004).
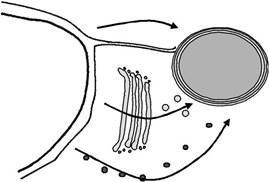
Путь, который NEAT белки следовать, чтобы перейти от ER к apicoplast стромы, пока не ясно, хотя некоторые модели были предложены (Рисунок 9.7). Одна гипотеза состоит в том, что apicoplast лежит буквально в выделительной системы, с ее внешней мембраны граничащей с ER. Все белки бы передать его на пути к другим Desti-нации и аккуратным белки будут захвачены в apicoplast в силу своего транзитного пептида. Затем они будут импортированы в течение следующих трех мембран. Другая возможность состоит в том, что белки двигаться по везикулярной торговле из ЭР к apicoplast, либо непосредственно, либо косвенно. В этом случае,
РИСУНОК 9.7 Три модели белка ориентации на apicoplast. Модель 1 показывает прямой импорт из ER. Модель 2 постулирует везикулярную торговлю через Гольджи. Модель 3 предлагает везикулярного транспорта из ЭР, минуя Гольджи. Органеллы указанные являются: А, apicoplast; ЭР эндо-плазменный ретикулум; G, Гольджи; и N, ядро.
транзитный пептид будет нести ответственность за пакет старения белков в соответствующие везикул, и специфичность торговли везикул, вероятно, будет передана с помощью дополнительного компонента - возможно, белки, такие как SNAREs в везикулы и apicoplast поверхностей, как это имеет место для нацеливания на другие пункты назначения секреторная система (Hong, 2005).
Недавние исследования показали, что маловероятно, что Т. Gondii NEAT белков, которые находятся в apicoplast светового потока трафика через Гольджи. Воздействие T.gondii, чтобы брефелдин А (БФ) или блок низкой температуры (15°С) и ингибирует Гольджи~d-трафик ficking, но без влияния на белка localiza-ции к apicoplast судить по деконволюции микроскопии (DeRocher и др., 2005). Эти исследования осложняется наличием ранее существовавших маркерных белков в apicoplast. Чтобы обойти эту трудность, DeRocher и др. (2005) использовали систему, которая позволяет регулируемый выход белков из ER (рис 9.8). Он основан на тандемных повторов условного домена агрегации (CAD), слитого с репортером, который несет необходимую topogenic инфор-мацию (Роллинс и др., 2000). В отсутствии синтетического лиганда, агрегация CAD домены оборота блоков гибридного белка. Добавление лиганда растворяет агрегированный белок,

APICOPLAST
лиганд BFA
DAPI

GFP

сливаться

фаза
- -
*

+ -
+ +
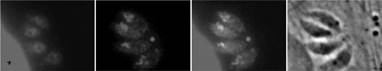
РИСУНОК 9.8 Apicoplast белка таргетирования изучены условной агрегации. GFP, слитый белок, несущий двудольного расширение рибосомного белка S9, плюс тандем массив из четырех доменов САПРА, был выражен в Т. гондиях. Удаление лиганда приводит к агрегации CAD доменов, в то время как добавление выходов лиганда одномеризации. Когда лиганд удаляется из стабильных трансфектантов, то GFP, обнаруживается в ER. Когда лиганд добавляют в течение 4 часов белок trafficks к apicoplast. Такое отслеживание происходит даже в присутствии БФА. GFP, был обнаружен с использованием анти-GFP антител. DAPI окрашивание выявляет ДНК в ядре пара-сайте и apicoplast, а в верхних и нижних изображениях, часть ядра клетки-хозяина видна (звездочка). Изображение предоставлено доктором Amy DeRocher.
Эта цифра воспроизводится в цвете в разделе Цвет пластины.
освобождая его для торговли (Rivera и др., 2000). к
2003; Le Roch и др., 2003). Когда фальципарум П.
исследование белка нацеливание на apicoplast Т. Gondii,
Было выражено NEAT GFP, слитый белок ранее
лиганд был снят в течение 2 дней от паразитов,
чем обычно (при движении транскрипции с использованием
стабильно трансфицировали с apicoplast-мишенью
промотор активен в начале цикла эритроцитарного),
CAD-GFP. Это заблокирован оборот слияния
это переправляют в паразитофорной вакуоли в
белок, разрушающий его из apicoplast во время
БФ-зависимый способ, а также появился в
Паразит деление. Вместо этого, GFP репортер накопле
apicoplast в обычное время в цикле (Череш
рованы в ER (рис 9.8). Последующее добавление
и другие., 2002). Тем не менее, общее значение
лиганда выпустила гибридный белок, который быстро
этот вывод пока не ясно.
локализован в области пластиды (DeRocher и др.,
Мало что известно о импортном аппарате из
2005). Эта локализация не была заблокирована БФА, или
apicoplast. Предположение, основанное на phyloge-
на 15°С блоком ER к Golgi торговли. Тем не менее,
Netic происхождение и сходство последовательностей, направленных на
BFA-чувствительный шаг участвуют в белковом нацеливании
является то, что apicoplast транслокон напоминает
или созревание не, поскольку ни один транзитный пептид расщепление
хлоропласты. Это транслокон состоит из
наблюдается в импульсно-чейз экспериментов в нали-
несколько компонентов во внутренней (крестики) и наружной
ENCE БФА (DeRocher и др., 2005).
(TOC) мембраны (Jarvis и Солл, 2002; Nassoury
В П. малярийного экспрессия мРНК для
и другие., 2005). Среди функций, предусмотренных в
Известные NEAT белки временно регулируется
сложный
являются
конкретный
переплет
в
the
транзит
во время эритроцитарного цикла, достигая пика в конце
Последовательность, формирование канала, выработка энергии,
Этапы трофозоита / раннего шизонт (Bozdech и др.,
и компаньонка деятельность. Тем не менее, другие, чем

224 APICOPLAST И митохондрия токсоплазма
мнимый Tic22 и Toc34 (неопубликованная работа цитируется в Waller и Макфадден, 2005), поиски базы данных не выявили перспективных кандидатов для ортологах хлоропластов Tic и Toc комплексов. Предположительно, ортологичные функции присутствуют, но механизм, по существу, расходились по отношению к последовательности белка. Изолированные вторичные пластиды из криптофитовой водорослей Guillardia теты, описанные авторы как имеющие две мембран, были способны импортировать белки, несущие транзитные пептиды из nucleomorph-кодированных пластиды белков, но не те несущие транзитные пептиды из nuclearly кодируемых белков (Wastl и Майер, 2000). Эти данные указывают на возможность нескольких механизмов импорта белков. Интересно, что криптофитовая водоросли nucleomorph кодирует по меньшей мере, два белка узнаваемы, как функционирует в пути импорта для внутренней мембраны:
Приведенные выше исследования касаются локализации растворимых белков матрикса к apicoplast. На сегодняшний день, белки, находящиеся в apicoplast мембраны не были окончательно определены, гораздо меньше их маршрут к пластидам. Можно предположить, что значительная мембрану протеом требуется для импорта белков и субстратов, а также экспорта продукции. Как было отмечено выше, кандидат Tic22 был идентифицирован, и он несет двудольный последовательность нацеливания. В хлоропластах, Tic22 лежит в межмембранном пространстве (Kouranov и др., 1999). Таким образом, представляется вероятным, что по крайней мере некоторые не LUME-Nal белки достигают apicoplast с помощью белковых последовательностей таргетинга, связанных с уже определенным для растворимых белков. Этот механизм напоминает нацеливание белков внутренней мембраны хлоропласта, который часто Medi-ованный посредством транзитного пептида (Silva-Filho и соавт, 1997;.. Рот и соавт, 2004). Другие белки хлоропласта не имеют распознаваемые последовательности транзитных (Фюнес и др., 2004), как это делают некоторые потенциальные apicoplast мембранных белков, такие как T. гондия сахара фосфатного переносчик (Karnataki, DeRocher, Feagin и Парсонс, неопубликованные результаты). Определенные белки, ориентированные на наружной мембране хлоропласта, такие как Toc75, имеют транзитную последовательность, в то время как другие имеют область N-концевой последовательности, напоминающего сигнала (Hofmann и Theg, 2005). Представляется вероятным, что различные механизмы используются Feagin и Парсонс, неопубликованные результаты). Определенные белки, ориентированные на наружной мембране хлоропласта, такие как Toc75, имеют транзитную последовательность, в то время как другие имеют область N-концевой последовательности, напоминающего сигнала (Hofmann и Theg, 2005). Представляется вероятным, что различные механизмы используются Feagin и Парсонс, неопубликованные результаты). Определенные белки, ориентированные на наружной мембране хлоропласта, такие как Toc75, имеют транзитную последовательность, в то время как другие имеют область N-концевой последовательности, напоминающего сигнала (Hofmann и Theg, 2005). Представляется вероятным, что различные механизмы используются
для нацеливания apicoplast мембран, возможно, связано с конечного пункта назначения.
С четырьмя ограничивающей мембраны, то apicoplast предлагает несколько вариантов локализации. Мембрана композиция может отличаться между ними, и может передать некоторую специфичность нацеливания мембранных белков. Липидный состав мембран хлоропластов очень отличается от других клеточных мембран, с высокими уровнями galactoglyc-erolipids (Блок и др., 1983). Хотя мало известно о apicoplast мембран непосредственно, galac-tolipids были идентифицированы в П. малярийного и Т. гондий (Марешаль и др., 2002;. Bisanz и др, 2006).