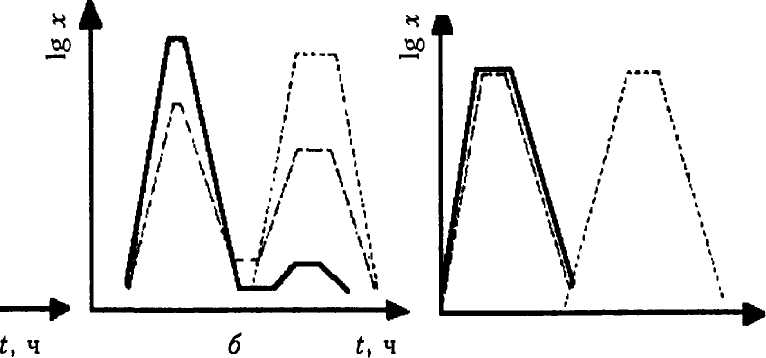
В связи с тем что биосинтез любого продукта зависит от энергетического метаболизма, различают три типа ферментационных процессов (рис. 6) (Воробьева Л. И., 1989).
I тип. В этом варианте продукт возникает в результате первичного метаболизма, направленного на получение энергии. Рост, катаболизм углеводов и образование продукта здесь происходят практически параллельно (рис. 6, а). Трофофаза и идиофаза не отделены друг от друга. Примером ферментации этого типа может служить и производство белка одноклеточных (SCP), этанола, глю-коповой кислоты. Схематично реакция выглядит как S —> продукт или S —> В —> С —> продукт.
| Тип III |
| Тип II |
| Тип I |
| а |
| в |
U ч
—— кривая роста
----------- кривая катаболизма углеводов
.............. образование продукта
Рис. 6. Типы ферментации
II тип. Продукт также образуется из субстрата, используемого в первичном метаболизме, но во 2-й фазе, отделенной от 1-й во време-
ни:
субстрат S —» В —» С — ¥D — первичный метаболит
продукт
В периодической ферментации, характерной для данного типа, наблюдается 2 максимума. Вначале имеется хороший рост, который затем замедляется, и начинается образование продукта, сопровождающееся интенсивным потреблением субстрата. В этом типе трофо-фаза и идиофаза разделены во времени. Таким путем образуются лимонная, итаконовая кислоты, некоторые аминокислоты, а-амилаза у Вас. subtilis.
Ill тип. Первичный метаболизм полностью отделен от образования конечного продукта, которое происходит по амфиболическому принципу. Этот процесс сопровождается потреблением субстрата и ростом, а целевой продукт образуется позднее, в реакциях промежуточного метаболизма. По III типу получают многие антибиотики, витамины, растворители.
На самом деле не всегда удается строго подразделить все ферментации на три типа, возможны промежуточные варианты. В качестве примера можно привести образование молочной кислоты, занимающее пограничное положение между I и IIтипами. В указанные общие типы невозможно вместить производство антибиотиков стреп-томицетами.
КОЛИЧЕСТВЕННЫЕ ПАРАМЕТРЫФЕРМЕНТАЦИОННЫХ
ПРОЦЕССОВ
Образование тепла. Для получения оптимального выхода продукта ферментацию нужно проводить при постоянном температурном режиме, поэтому тепло, которое образуется при перемешивании и метаболической активности микроорганизмов, необходимо удалять с помощью специальных охладительных систем.
Количество тепла, выделяемого микроорганизмами, определяют как
V
ккал"Я5-У5Яс
где Уккал — количество тепла, выражается в г клеток/ккал выделенной энергии; Ys— выход биомассы, г клеток/г потребленного субстрата; Hs и Нс — тепло, выделяемое соответственно при сгорании субстрата и клеток (определяется экспериментально), ккал/г.
Представление о выделении тепла бактериями при росте на разных субстратах отражено в табл. 1 (по Воробьевой Л. И., 1989), из которой следует, что, чем больше окислено вещество (глюкоза или ацетат), тем меньше тепла выделяется на единицу биомассы; чем больше величина \х, тем больше Уккал.
Таблица1
Экономические коэффициенты Уккал с различными субстратами
| Субстрат | Уккал (г клеток/ ккал) |
| Малат | 0,30 |
| Ацетат | 0,21 |
| Глюкоза | 0,42 |
| Метанол | 0,12 |
| Этанол | 0,18 |
| Изопропанол | 0,07 |
| н-Парафин | 0,16 |
| Метан | 0,06 |
Скорость выделения тепла в единицу времени находят, исходя из скорости роста, объема реактора (У) и коэффициента Уккал- Так, скорость роста рассчитывается по формуле
(9)
скорость выделения тепла в единицу времени
—^ — (10)
Содержание О2 в жидкости. Критическим или определяющим фактором ферментации является массоперепос газов: кислорода и углекислоты.
Кислород часто выступает лимитирующим фактором, поскольку плохо растворяется: в 1 л воды при 20 °С в растворенном состоянии находится только 0,3 ммоля О2, а в питательной среде его содержание еще ниже.
По закону Генри растворимость О2 в питательном растворе по отношению к парциальному давлению его в газовой фазе описывается следующим образом:
с*=5-. сю
где С* — концентрация О2, насыщающего питательный раствор; Pq — парциальное давление газа в газовой фазе; Я — константа Генри, специфичная для газа и жидкой фазы. При увеличении концентрации кислорода в газовой фазе (Р = const) его содержание в питательном растворе тоже растет. Если повышается t, растворимость О2 снижается. Парциальное давление газа равно произведению мольной доли газа на общее давление смеси (закон Дальтона):
где у — мольная доля газа; Р — общее давление.
Перенос О2. При культивировании одноклеточных организмов (бактерий, дрожжей) наиболее важный фактор, контролирующий скорость переноса О2, — устойчивость фазовой границы пузырьков газа и жидкости. Клетки, находящиеся рядом с газовыми пузырьками, могут непосредственно поглощать газ через фазовые границы, лучше снабжаются кислородом. Перенос же О2 через агломераты, или комочки клеток, затруднен и становится лимитирующим фактором. Диффузия его в жидкость характеризуется следующим уравнением:
-CL) = OTR, (12)
где NA— массоперенос, зависящий от объема, ммоль О2/(л • ч), и показывающий скорость сорбции растворенного О2, т. е. его количество, которое переходит из газовой фазы в жидкую в единицу объема за единицу времени; KL — коэффициент переноса па границе фаз; а — специфическая поверхность обмена; KLa — объемный коэффициент переноса О2, ч"1; CL — концентрация растворенного газа,
ммоль О2/л (текущая концентрация растворенного О2 в жидкости); Сх — равновесная концентрация растворенного О2 в жидкости (устанавливается при равенстве скоростей процессов абсорбции и десорбции и зависит от природы и физико-химических параметров жидкости и газа); OTR — скорость переноса О2, ммоль О2 (л • ч).
Объемный коэффициент переноса рассматривают как критический параметр для функционирования биореактора. Величина KLa зависит от: 1) диаметра; 2) вместимости; 3) мощности; 4) аэрационной системы; 5) скорости аэрации в биореакторе; 6) плотности, вязкости и состава питательной жидкости; 7) структуры микроорганизмов; 8) применяемого антивспенивателя; 9) температуры.
О2 как субстрат. Рост культуры микроорганизмов с лимитирующим субстратом рассчитывают по уравнению
Если О2 выполняет роль субстрата, то
QO2 = Omax - v xLr' (14)
где Qq — удельная скорость поглощения О2, отнесенная к массе сухих клеток, ммоль О2/(г клеток • ч); Qmax— максимальная скорость поглощения О2; Хо — константа Михаэлиса —Ментеи для О2.
Максимальная скорость поглощения О? разными микроорганизмами значительно различается (см. табл. 2) (по Воробьевой, 1989).
Таблица2 Максимальная скорость поглощения О2(Qmax) У некоторых организмов
| Организм | Qmav» МОЛЬО2/(ГКЛСТОК ' Ч) |
| Aspergillus niger | 3,0 |
| Str. griseus | 3,0 |
| Pen. chrysogenum | 3,9 |
| Klebsiella aerogenes | 4,0 |
| Sacch. cerevisiae | 8,0 |
| E. coli | 10,8 |
Критическая концентрация кислорода показывает величину удельной скорости поглощения О2, которая необходима для дыхания. Есть 4 приемлемых метода определения этой скорости: 1) динамический; 2) сульфитный; 3) прямое измерение скорости переноса О2; 4) теоретический расчет, учитывающий рост биомассы.
Динамический метод. В периодической ферментации истинную
концентрацию О2, т. е. CL, можно определять, измеряя скорость ее уменьшения CL после прекращения аэрации.
Очень часто применяют сульфитный метод. Принцип его заключается в том, что в присутствии 10~3 моль кобальта и меди сульфит натрия окисляет растворенный кислород соответственно уравнению
Na2SO3+ - O2
Си2+ или Со2+
Na2SO
В настоящее время в современных биотехнических производствах регистрируют концентрации кислорода с помощью электрода Кларка. Этот метод позволяет проводить данную процедуру в динамике.
Определение скорости переноса О2 с помощью измерения микробного роста. В аэробных условиях кислородное потребление на 1 г сухой биомассы рассчитывают, пользуясь уравнением
У
(15)
где С — потребление О2 (на сухую биомассу), ммоль О2/г сухих клеток; А — количество кислорода, необходимое клеткам для окисления 1 г субстрата до СО2, Н2О и NHq; В — количество кислорода, необходимое для окисления 1 г сухой биомассы до СО2, Н2О и NH3; Ys — биомасса, г/ г субстрата. Л получают в результате теоретических расчетов окисления субстрата; В требует анализа биомассы (для дрожжей В = 934 мл О2/г сухой биомассы).
В табл. 3 даны общие сведения о потребности в О2 некоторых микроорганизмов (Воробьева Л. И., 1989).
Таблица3