Физическая иммобилизация ферментов. Методы иммобилизации, при которых фермент или клетка связываются с матрицей без образования ковалеитных связей, называют физическими. Их можно разделить на 4 группы: адсорбционная иммобилизация на нерастворимых носителях, иммобилизация путем включения в гели, иммобилизация микрокапсулированием в полупроницаемые оболочки и волокна, включение в двухфазную реакционную среду.
Адсорбционная иммобилизация. В этом случае фермент или клетка удерживается на поверхности носителя с помощью электростатических, гидрофобных и водородных связей. Для этих целей применяют неорганические (оксиды алюминия и титана, керамику, уголь) и органические (полисахариды, ионообменные смолы, белки) нерастворимые носители в виде порошков, шариков, гранул или больших кусков с узкими каналами. Основные характеристики носителей — механическая прочность, химическая инертность, размер пор, удельная поверхность. Из-за простоты, доступности, невысокой стоимости сорбентов и сохранения высокой каталитической активности биокатализаторов адсорбционная иммобилизация — один из наиболее часто применяемых методов. Главный его недостаток — возможность непрочного связывания фермента и носителя.
Существует несколько способов получения биокатализаторов с помощью адсорбции на носителе (рис. 14).
Статический способ. Носитель вносят в водный забуфе-ренный раствор фермента и оставляют на несколько суток без перемешивания. Сорбция достигается за счет самопроизвольной диффузии фермента к поверхности носителя с последующей адсорбцией. Сейчас очень редко применяют из-за длительности.
Способ с перемешиванием. Смешивают (на качалке, мешалкой, покачиванием) фермент или суспензию клеток с носителем, уравновешенным буферным раствором. Затем от последнего центрифугированием или фильтрованием отделяют биокатализатор и снова ресуспендируют. Эту стадию повторяют несколько раз, пока не прекратится активность фермента или клетки в промывных водах, после чего комплексы суспендируют в определенном объеме соответствующих буферов, уравновешивают и хранят в холодильнике. Этот способ эффективнее статического, поскольку обеспечивает более равномерное заполнение поверхности носителя адсорбированным ферментом.
Метод электроосаждения. Основан на том, что ферментные молекулы имеют на поверхности заряженные группы. Если в раствор фермента погрузить два электрода, на поверхности одного из
которых помещен слои носителя, то при включении электрического тока его молекулы начнут перемещаться в растворе в сторону соответствующего электрода и осаждаться на носителе.
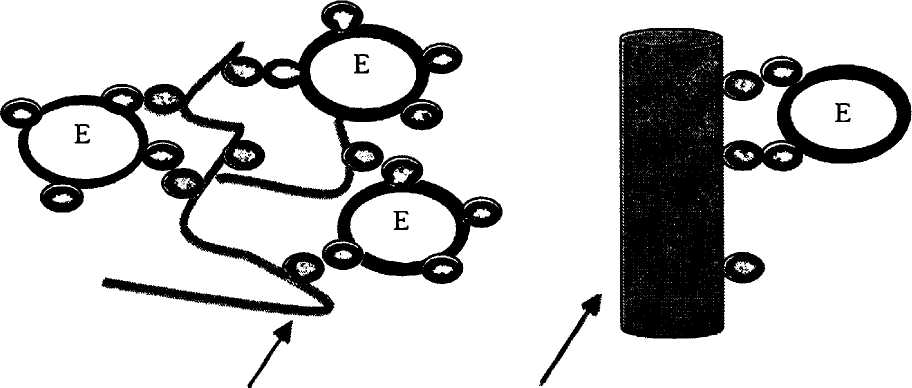
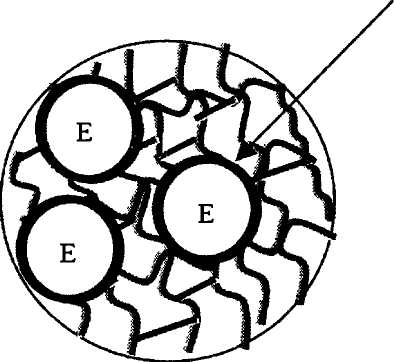
Гидрофобное взаимодействие Электростатическое связывание
|
|
| щ Е j фермент у %l гидрофобные участки |
носители
заряженные участки
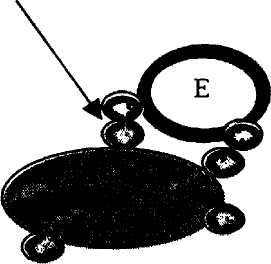
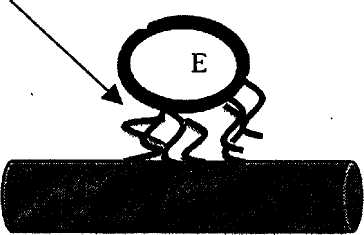
Рис. 14. Адсорбционная иммобилизация ферментов
В промышленных условиях чаще применяют метод нанесения на колонку с носителем (рис. 15). В этом случае через нее насосом прокачивают раствор фермента — или снизу вверх, или сверху вниз. Скорость потока подбирается так, чтобы частицы носителя оставались в взвешенном состоянии, образуя кипящий слой. При использовании этого метода можно в одной и той же колонке проводить иммобилизацию фермента, промывку и ферментацию.
Природа адсорбционных взаимодействий фермента и носителя может быть различной (см. рис. 14). Удержание может обеспечиваться за счет ван-дер-ваальсовых, электростатических и гидрофобных взаимодействий, водородных связей между носителем и поверхностными группами белка, что зависит от химической природы носителя и функциональных групп на молекуле фермента или белка и липидов на поверхности клетки. Стабильность обеспечивается чаще всего при электростатическом взаимодействии и водородных связях.
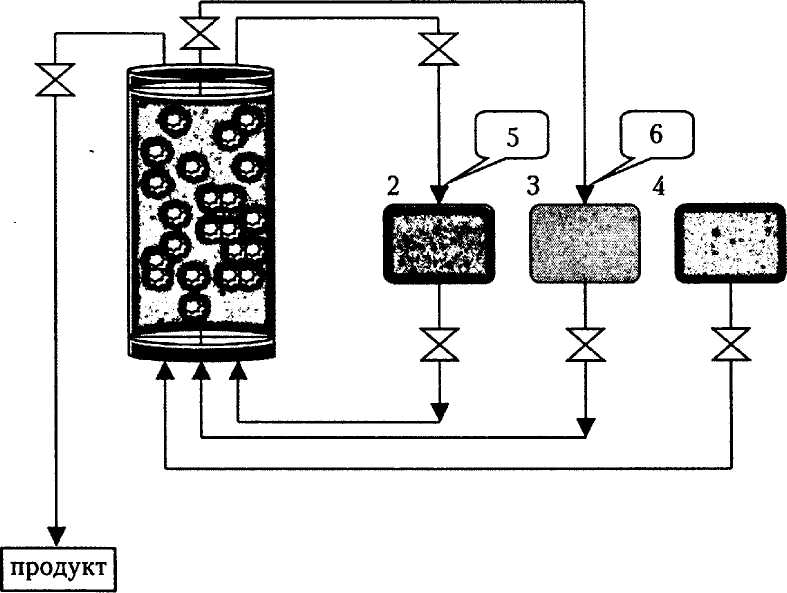
Рис. 15. Иммобилизация нанесением на колонке:
1 — колонка с носителем; 2 — емкость с ферментом; 3 — емкость с растворителем; 4 — емкость с субстратом; 5 — контроль концентрации белка (удельной активности); 6 — контроль концентрации белка в промывных водах
Эффективность адсорбционной иммобилизации зависит от многих факторов. В общем случае сорбционная емкость носителя пропорциональна его удельной поверхности. Для ферментов это справедливо в случае, когда носитель непористый или диаметр пор намного больше размеров белков. Если они маленькие, то удельная поверхность больше, но количество связанного фермента, меньше, так как белки не взаимодействуют с внутренней поверхностью поры.
Экспериментальные данные показали, что диаметр пор должен быть в 2 раза больше размера молекулы фермента в направлении его максимального удлинения. Это случай, когда молекула субстрата меньше молекулы фермента. Если это не так, то носитель нужно подбирать по размеру субстрата. Причем высокомолекулярный субстрат сам может выступать носителем для иммобилизации фермента.
Если сорбция осуществляется за счет электростатических взаимодействий, то естественно этот процесс будет сильно зависеть от рН среды, при изменении которого меняется состояние ионогенных групп носителя и белка. Если носитель не является ионообменником, максимальная сорбция достигается в изоэлектрической точке белка, т. е. рН-зависимость адсорбции должна иметь вид кривой с одним максимумом, соответствующим изоэлектрической точке.
Ионная сила оказывает влияние лишь на прочность связывания фермента с носителем из-за конкуренции последнего с ионами в растворе. В этом случае может наблюдаться десорбция биокатализатора, которая зависит от ионной силы раствора, т. е. концентрации солей.
Степень адсорбции и количество адсорбированного на носитель 210
биокатализатора в значительной степени зависят от концентрации фермента в растворе, из которого происходит адсорбция. Если ее увеличивать до определенного предела, то будет расти и количество адсорбированного биокатализатора и, следовательно, повысится удельная каталитическая активность иммобилизованной системы. Как только предел будет преодолей, последняя перестанет расти, поскольку носитель имеет ограниченное число центрового связывания. Кроме того, ферменты могут наслаиваться друг на друга, что приводит к появлению диффузионного барьера для субстрата.
Для удачного проведения адсорбции нужно подобрать оптимальную температуру. Ее увеличение оказывает двоякое воздействие па процесс адсорбционной иммобилизации: с одной стороны, происходит рост скорости диффузии фермента в порах носителя, с другой стороны, это приводит к денатурации белка.
Таким образом, эффективность адсорбционной иммобилизации биокатализаторов зависит от целого ряда факторов, которые должны быть точно сбалансированы.
Для повышения прочности связывания адсорбционно-иммобили-зоваииых ферментов часто носитель предварительно модифицируют — не только включают в него какие-либо дополнительные функциональные группы, но и изменяют его физико-химические свойства. Например, если фермент нестабилен в кислой среде, а поверхность носителя имеет кислый характер, то необходимо перед иммобилизацией носитель выдерживать в соответствующем буферном растворе.
Особый подход требуется для иммобилизации металлозависимых ферментов. Из-за способности большинства носителей селективно прочно связывать ионы металлов при иммобилизации металлоэнзимы могут терять их из активного центра. Этого можно избежать, если последний будет предварительно заблокирован теми же (или им подобными) ионами.
Доиммобилизационная обработка носителя ионами металлов, которые выступают в роли мостиков, для некоторых ферментов служит фактором, увеличивающим прочность их связывания. Среди способов усиления этой способности следует отметить обработку носителя веществами, молекулы которых содержат много функциональных групп, способных к взаимодействию с группами на поверхности глобулы фермента или клетки за счет электрических и водородных связей. Для этого поверхность носителя полимеризуют, затем проводят химическую модификацию полимера, за счет которой образуется большая концентрация функциональных групп — гидроксидьных, гидрофобных и т. д. Иногда перед иммобилизацией на носитель за счет адсорбции наслаивают сывороточный альбумин, который затем искусственно денатурируют, а функциональные группы остаются.
На поверхности ферментов наряду с полярными участками часто присутствуют гидрофобные зоны, участвующие в связывании с носителем органической природы. При этом способе агарозы ковалентно
модифицируют гидрофобными группами (алкильпыми, фенильными). Связывание увеличивается, если на носителе присутствует еще и заряженная группа. Таким образом, наблюдается двойной эффект: фермент связывается с носителем и за счет гидрофобных, и за счет электростатических взаимодействий.
В этом плане очень удобны для модификации липиды, являющиеся, как известно, амфифилами, т. е. имеют четко выраженные гидрофильные и гидрофобные участки. По желанию моиослой липидов можно так адсорбировать на поверхности носителя, что поверхность будет иметь или гидрофобный характер, или гидрофильный.
В ряде случаев для повышения эффективности иммобилизации необходимо модифицировать не носитель, а фермент. Особенно в случае, когда речь идет о ионообменных смолах, из-за того, что иногда очень близки изоэлектрическая точка и рН-оптимум фермента. Поэтому прочная сорбция наблюдается лишь в областях рН, далеких от точки, где каталитическая активность мала. Для снятия этого препятствия в фермент вводят дополнительные ионогеииые группы (органические кислоты, карбоксиметилцеллюлозу), которые смещают изоэлект-рическую точку катализатора. Чтобы исключить смывание уже иммобилизованного фермента с носителя, адсорбированный фермент обрабатывают бифункциональным сшивающим агентом. Это приводит к тому, что на поверхности носителя образуется сплошная молекулярная пленка. В качестве сшивающего агента чаще всего применяют глутаровый альдегид.
Иммобилизация включением в гели. Для проведения иммобилизации в органические гели готовят реакционную смесь из следующих компонентов: фермент, мономер (и при необходимости сшивающий агент), водный буферный раствор. Часто еще добавляют вещества, предохраняющие фермент от инактивации при гелеобразовании. Готовую смесь подвергают воздействию какого-либо фактора, инициирующего процесс полимеризации мономера (рис. 16, а). При этом в ПААГ используют мономер и сшивки в концентрациях 30 — 60 и 5 % от общей массы реакционной смеси соответственно. Инициаторами полимеризации являются радикалы, которые могут образовываться в результате некоторых окислительно-востановительных и фотохимических реакций. Чаще в первых применяется пара: персульфат калия или тетраметилэтилендиамин аммония. При внесении этих веществ в раствор происходит полимеризация. Для фотохимического инициирования применяют рибофлавин. Иногда полимеризацию можно проводить также при воздействии ионизирующей радиации без инициатора.
Процесс полимеризации ингибируется наличием молекулярного кислорода, в результате выделяется большое количество тепла (нагрев до 70 — 75 °С). Во избежание этого можно насытить рабочий раствор инертным газом и процесс проводить при невысоких температурах. За определенное время (мин, ч) образуется блок полимер-
ных гелей, содержащий иммобилизованный фермент. Его измельчают, продавливая через сито или нарезая. Тщательно промывают буферным раствором до тех пор, пока в промывных водах ферментативная активность не будет минимальной. Если в ПААГ включали клетки, то в водах определяют их наличие. Для длительного хранения измельченный гель с биокатализатором подвергают лиофильной сушке.
|
|
a
|
| ;*> А | ||||||
| E | ||||||
| pi | ||||||
| r'i E | ||||||
| J | ж | |||||
| r | ^\ | |||||
| Щ | E | ] | ||||
| ....... * | t*V it.* | га* | ||||
| *>: | ||||||
| ':•. • ■*** | ||||||
| «У7ЙА | If-5*- ■^ "^» | |||||
| Ш | •»' | |||||
мономер сшивающий агент
фермент или клетка
полимер
Рис. 16. Иммобилизация ферментов и клеток включением в гели:
а — включение в гели, полученные полимеризацией мономеров;
б — включение в готовые природные гели
Некоторые природные полисахариды — крахмал, агар-агар, кар-рагенан, агароза — способны образовывать гели при охлаждении их горячих водных растворов. 2 — 5%-й раствор этих гликанов нагревают при постоянном перемешивании до 80 — 90 °С и затем постепенно охлаждают. Перед началом гелеобразоваиия (30 — 50 °С) в систему добавляют водный раствор биокатализатора (фермента) или суспензию клеток. При дальнейшем остывании образуется гель, содержащий иммобилизованный фермент (рис. 16, б). Для повышения механической прочности этот процесс иногда проводят в порах вспененного полиуретана или выдерживают в холодных растворах хлористого калия или кальция. Чтобы лучше удерживался включенный в гель фермент, в полимер вводят ковалентиые сшивки. Этого можно добиться при его обработке бифункциональными реагентами. Образование прочных связей между полимерными цепями может достигаться и за счет электростатических взаимодействий. Например, в присутствии Са2+ альгинат натрия дает прочный гель. В этом случае в роли мостиков между полимерными цепями выступают ионы Са, формирующие ионные связи с карбоксильными группами альгииата.
Сшитые гели для иммобилизации могут быть получены па основе поливинилового спирта и поливииилпирролидопа. Если на растворы (водные) этих веществ воздействовать излучением или потоком электронов, то в их полимерных цепях возникают свободные радикалы, при взаимодействии которых образуются ковалеитпые сшивки.
Сейчас широко применяют метод иммобилизации биокатализаторов путем включения в полимерную матрицу из фотополимеризую-щихся смол (полимеры-макромопомеры). Во время этого процесса раствор, содержащий смолу, катализатор и инициатор облучают несколько минут УФ-лучами. Фоточувствительные группы образуют между собой ковалеитные связи, и возникает сшитая 3-мериая полимерная сетка с включенными в нее молекулами биокатализатора.
Каталитическая активность иммобилизованного биокатализатора возрастает с увеличением количества включенного фермента. Казалось бы, такого увеличения можно добиться, просто повышая концентрацию фермента в исходной смеси. На самом деле это не так, поскольку растворимость ферментов в гелеобразующих системах ограничена. Кроме того, важно учитывать и прочность удерживания биокатализаторов носителем. А это зависит от размера пор. Чем меньше их диаметр в сравнении с размером биокатализатора, тем меньше вероятность смывания катализатора реакционной средой. Пористость геля можно регулировать изменением состава исходной смеси (например, мономера). Высокая концентрация фермента приводит также к тому, что субстрат не достигает ферментов в глубине матрицы. В этом случае препарат с иммобилизованным биокатализатором измельчают, продавливая через сито или гомогенизируя, чтобы увеличить удельную поверхность. Чаще получаемые частицы не очень прочны, крайне неоднородны, и поверхностные катализаторы легко смывают-
ся. Эти недостатки можно преодолеть, если использовать эмульсионный способ получения гелевых частиц (рис. 17).
Поверхностно-активное вещество (ПАВ)
| Мономеры |
 Полимеризация и удаление ПАВ ^
Полимеризация и удаление ПАВ ^
J Фер
Сшивающий агент I
менты
Рис. 17. Эмульсионный способ получения гелевых частиц
Приготовленный водный раствор с ферментом, мономером и инициатором сразу вводят в неполярный органический растворитель с поверхностно активными веществами (ПАВ) и перемешивают. Образуется эмульсия, состоящая из стабилизированных в органической среде капель водного полимеризующегося раствора. После окончания полимеризации частицы геля в форме шариков промывают в фильтре водой. Они характеризуются высокой механической прочно-
стыо, и исключается опасность инактивации фермента теплом, выделенным в этом процессе (высокий теплообмен).
Для практических целей удобен метод двойной иммобилизации, при котором в гель вносится фермент на твердом носителе, или же получение его осуществляется включением биокатализатора в присутствии такого носителя.
Есть еще один параметр, от которого зависит эффективность иммобилизованного биокатализатора. Для работы фермента нужно какое-то минимальное микроокружение, а его оптимизацию, можно достичь подбором соответствующей гелеобразующей системы, так как эффективность зависит от происхождения геля. Варьируя химическую природу исходного мономера (гелеобразующего материала), можно получать матрицы с подходящими для данпой ферментативной реакции характеристиками — зарядом, гидрофобностыо и т. д.
Несмотря на все преимущества иммобилизации путем включения в гели, есть и недостаток, который заключается в том, что полимерная матрица создает значительные препятствия проникновению субстрата к катализатору — диффузионный барьер. Он увеличивается, если биокатализатором служит не фермент, а клетка. Для его уменьшения применяют различные подходы — используют органические растворители или прошивают отверстия с помощью лазера и т. д.
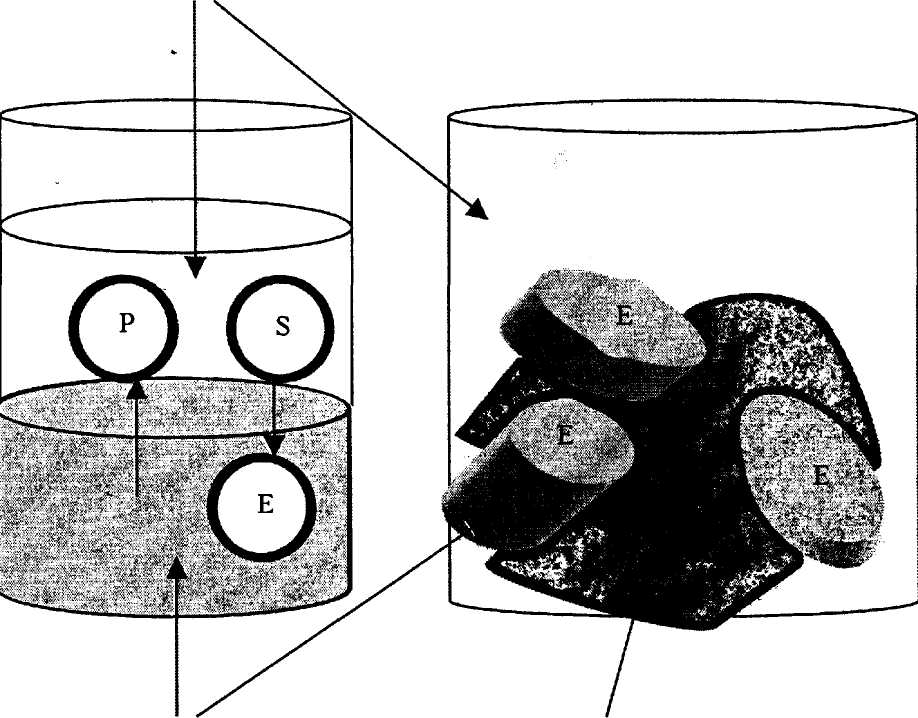
Иммобилизация с использованием мембран и волокон, микро-капе у л ирование. При микрокапсулировании главным является удержание раствора, а не создание физических и химических сил, необходимых для иммобилизации, т. е. этому процессу подвергается целиком исходный раствор, содержащий биокатализатор, а не отделенные молекулы или клетки. Суть метода состоит в том, что водный раствор фермента заключают внутри микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной сеткой. Процесс имеет несколько стадий (рис. 18).
1. Фермент разводят в подходящем буферном растворе, в котором
обычно имеются для его защиты от денатурации и другие белки, на
пример альбумин, в концентрации 10 %.
2. Готовят органическую фазу, содержащую небольшое количе
ство эмульгатора (ПАВ). Она не должна смешиваться водой (эфир,
циклогексан, толуол).
3. Добавляют водный раствор фермента к органической фазе и
перемешивают в течение заданного времени (1 — 2 ч) с определен
ной скоростью вращения. От этого зависит размер микрокапсул.
4. При перемешивании к этой двухфазной смеси добавляют также
органический растворитель, содержащий полимер (нитрат целлюло
зы, бутадиеновый каучук), который, соприкасаясь с поверхностью эмуль
сионных капель, будучи нерастворимым в воде, образует тонкую обо
лочку микрокапсул.
5. При его упаривании из органической фазы из-за увеличения
концентрации полимера происходит дальнейшее осаждение с образо-
ванием более плотной мембраны, толщина которой зависит от исходного количества и от времени преципитации.
б. Микрокапсулы из органической фазы выделяют осаждением, центрифугированием или фильтрацией.

|
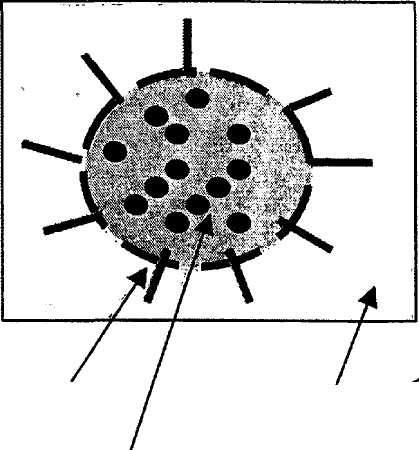
|
| ПАВ |
| Органический растворитель |
| Водный раствор фермента |
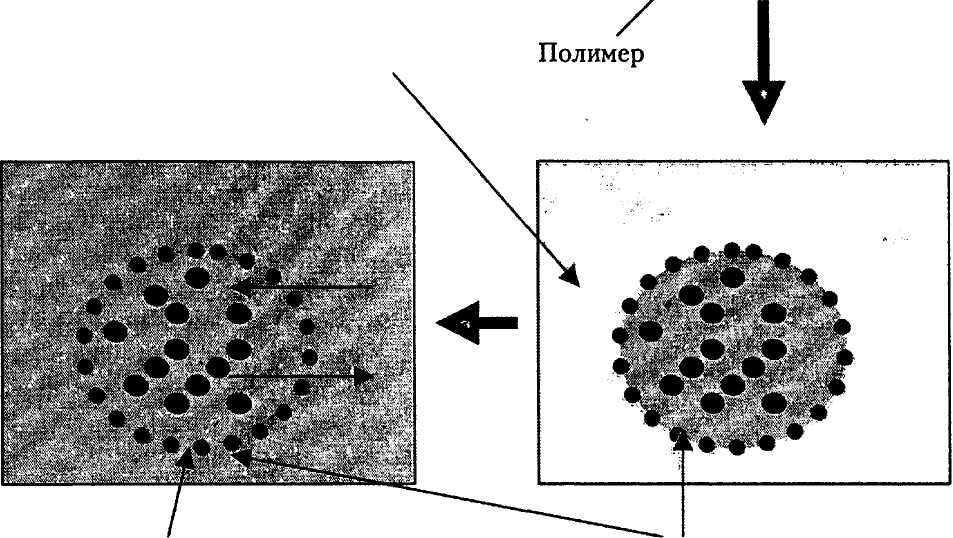 Капсула с ферментом
Капсула с ферментом
Полимерная оболочка
Рис. 18. Иммобилизация биокатализаторов микрокапсулированием: S и Р — субстрат и продукт ферментативной реакции
Включение в мембраны и волокна. Метод включения в волокна от микрокапсулирования отличается в основном формой полученных препаратов — образуются нити. Эмульсию водного раствора фермента в органическом растворе волокнообразующего полимера (производные целлюлозы, поливинилхлорид и т. д.) продавливают через прядильное устройство (фильтр) в коагулирующую жидкость (толуол). Полученные волокна представляют собой пористые полимерные гели, содержащие гомогенную дисперсию небольших капель водного раствора фермента. Они обладают высокой механической прочностью. Из них даже можно изготовить ткань, обладающую ферментативной активностью. Для дополнительного повышения механической прочности волокна иногда заключают в тонкую полиамидную оболочку.
Можно использовать и промышленные готовые полимерные полые волокна, применяемые для диализа белков.
Хорошими носителями ферментов являются липиды. Известно, что они обладают ярко выраженными гидрофобными и гидрофильными свойствами, т. е. могут образовывать моно- и бислой, сферы (липосо-
| Ферменты |
| Бислой фосфолипидов |
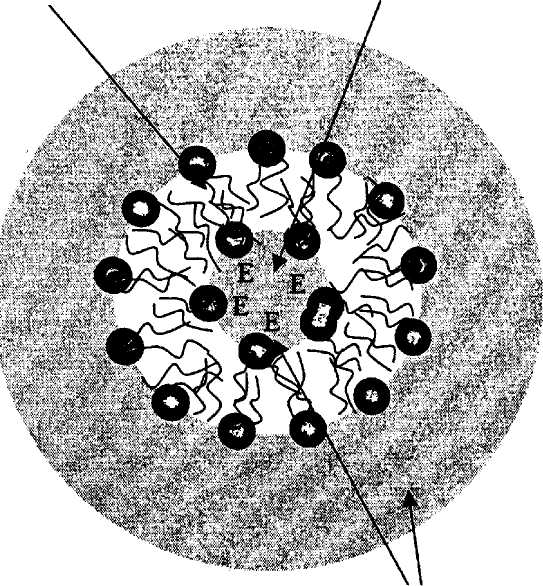 мы). Причем взаимное расположение их молекул в этих образованиях будет зависеть от окружающей среды (рис. 19).
мы). Причем взаимное расположение их молекул в этих образованиях будет зависеть от окружающей среды (рис. 19).
| Полярная (водная) среда Рис. 19. Иммобилизация ферментов включением в липосомы |
Иммобилизация с использованием двухфазных систем. Особенностью этого способа является то, что фермент растворяется только одной из фаз системы. А субстраты и продукты распределены между двумя фазами. Причем система подбирается так, чтобы продукт накапливался там, где отсутствует фермент. После окончания процесса эту фазу отделяют и извлекают из нее продукт, а фазу с ферментом используют вновь. Достоинство этого метода в том, что осуществляются превращения крупных макромолекул.
Например, если взять двухфазную систему, состоящую из 1 — 2 % воды и органического неполярного растворителя, то ферменты (белки) будут в водной фазе, так как в другой они не растворятся. Там же будет перерабатываться и субстрат, а продукт диффундирует (экстрагирует) в неполярную фазу (рис. 20, а). Основной недостаток — инактивация ферментов на границе раздела. Для увеличения эффективности в качестве ферментсодержащей фазы применяют крупнопористое стекло, частицы которого пропитаны водным раствором фермента (рис. 20, б).
В этом случае возрастает поверхность раздела, и раствор можно перемешивать. В этих же целях используют бездетергентные микроэмульсии. При определенных соотношениях в смесях гексан — изо-пропиловый спирт — вода, толуол — изопропиловый спирт — вода молекулы воды существуют в виде сферических капсул, стабилизированных адсорбированными на их поверхности молекулами изопропи-лового спирта. При растворении в них молекулы фермента оказываются включенными в водные микрокапли с сохранением их каталити-
ческой активности. Если изменить состав смеси, происходит расслоение на водную и органическую фазы, содержащие соответственно фермент и продукты реакции.
Органический растворитель
|
| а |
| б |
Водный раствор фермента Крупнопористый неорганический носитель,
пропитанный водным раствором фермента
Рис. 20. Иммобилизация ферментов с использованием двухфазных систем
Таким образом, известно 4 основных вида физических методов иммобилизации: адсорбционная, включение в гели, иммобилизация с использованием мембран и иммобилизация с использованием двухфазных систем. Общим для всех этих способов является то, что биокатализатор не образует ковалентных связей с носителем, а удерживается за счет или слабых взаимодействий, или пространственных ограничений, или различий в растворимости.
Химические методы иммобилизации. Методы иммобилизации ферментов с помощью ковалентного соединения основаны на образовании химической связи между молекулами фермента и носителем. При этом важно, чтобы аминокислоты, необходимые для проявления каталитической активности ферментов, не участвовали в ковалентном связывании с носителем. Избежать этого, как правило, трудно, поэтому этот способ обычно приводит к снижению ферментативной активности. Однако инактивацию фермента можно предотвратить, если проводить иммобилизацию в присутствии субстрата, который защищает активный центр.
Основных принципов конструирования конечного препарата методом химической иммобилизации — три. Это связано с тем, что независимо от характера процесса в него включаются три компонента: собственно молекула биокатализатора (Ф), носитель (Н) и сшивающий реагент (С). Последний имеет и другие названия: «вставка», «ножка», «сшивка» и т. д.
Иными словами, такая иммобилизация подразумевает создание конструкций из химически связанных трех элементов: Н-С-Ф, Н-Ф, С-Ф. Для наглядности обозначим Н-Ф термином «пришивка», Н-С-Ф — «сшивка», а С-Ф — «вшивка».
Теперь рассмотрим подробнее принципы конструирования. Если на поверхности носителя имеются функциональные группы, способные вступить в химические реакции с функциональными группами фермента с образованием ковалентных связей, то процесс иммобилизации сводится к необратимой «пришивке» фермента к носителю за счет простой адсорбции.
Из-за стерических и диффузионных ограничений тесный контакт фермента и носителя может оказаться крайне нежелательным. Тогда применяют специальные сшивающие реагенты различной длины. Это очень удобный метод, поскольку за счет них можно изменить каталитические характеристики биокатализатора, характер связи в агенте направить в нужном русле и т. д.
В ряде случаев для ковалентиой иммобилизации используют системы, изначально не содержащие носитель, а только фермент и сшивающий агент. Он формируется после как твердое тело, или же сам фермент служит одновременно и носителем. Имеется в виду ковалепт-ное вшивание молекулы последнего в различные типы сеток, образование которых (ретикуляция ферментов) обусловлено полифуикцио-пальностыо самого фермента, т. е. наличием помимо активного центра большого количества реакциоиноспособиых групп. За счет этого в его растворе при наличии бифункционального сшивающего агента отдельные молекулы сшиваются друг с другом и образуют агрегаты сетчатой структуры, где узлами служат сами ферменты.
Интересен способ ретикуляции ферментов, предварительно модифицированных ковалентно реагентами, содержащими двойную связь, например, акрилоилхлоридом. При сополимеризации ферментного (белкового) макромономера с низкомолекулярными мономерами (например, с акриламидом) образуются сетчатые полимерные гели, сшитые белком или дополнительным сшивающим мономером (например, ЬГ,М,Ь[-метиленбисакриламидом). Причем исходное состояние системы — жидкость, а конечное (после полимеризации) — гель (твердое тело) в форме сосуда, где идет реакция, который потом можно измельчить.
Часто для увеличения прочности уже иммобилизованные ферменты дополнительно обрабатывают сшивающим агентом, как бы привязывают их друг к другу. В дальнейшем, освободившись от твердого
носителя, можно получить сшитую ферментную пленку. Связывание фермента с носителем может осуществляться с образованием различных химических связей.