| Свойства | Нативная амино-ацилаза | Иммобилизованная аминоацилаза | |||
| Ионное связывание с ДЭАЭ-сефа-дексом | Ковалентное связывание с иодоацетил-целлюлозой | Включение в ПААГ | |||
| Оптимальный рН | 7,5 - 8,0 | 7,0 | 7,5 - 8,5 | 7,0 | |
| Оптимальная температура, °С | |||||
| Энергия реактивации, ккал/моль | 6,9 | 7,0 | 3,9 | 5,3 | |
| Оптимальная концентрация Со2+, моль | 0,5 | 0,5 | 0,5 | 0,5 | |
| Km, ммоль | 5,7 | 8,7 | 6,7 | 5,0 | |
| V, мкмоль/ч max' ' | 1,5 | 3,3 | 4,6 | 2,3 | |
| Методика получения | Простая | Сложная | Сложная | ||
| Связывающие силы | Слабые | Сильные | Сильные | ||
| Возможность регенерации | Возможна | Невозможна | Невозможна |
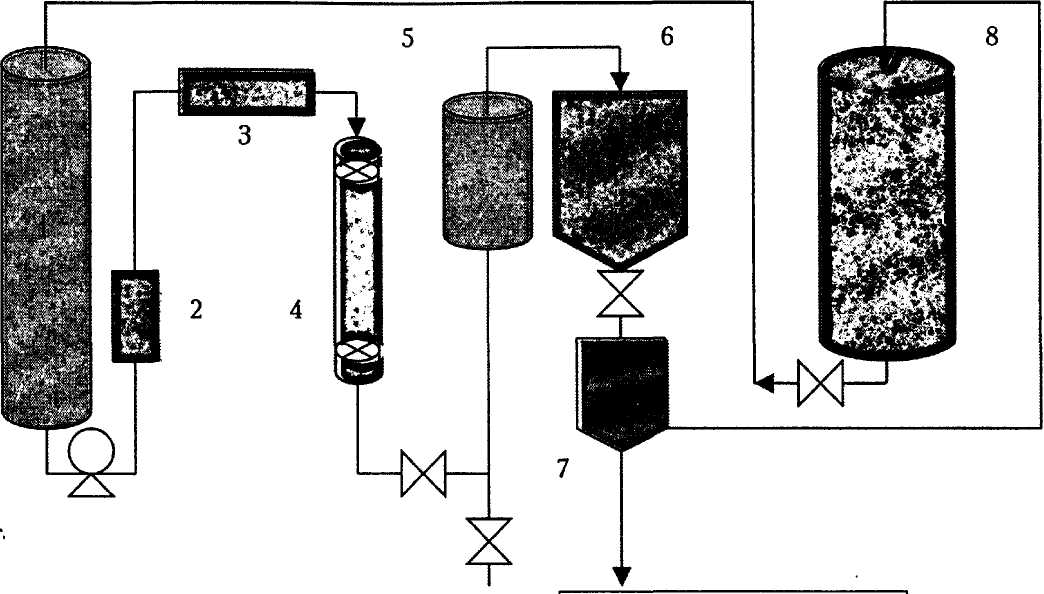
Технологическая схема установки для получения L -аминокислот представлена на рис. 25.
В качестве исходного вещества используют ацилированные D-, L -аминокислоты (ацил-О^-аминокислоты), полученные обычным химическим синтезом. Их подвергают воздействию фермента аминоацила-зы, который гидролизует только один изомер, приводя к образованию незамещенной L -аминокислоты и оставляя нерасщепленной ацил- D -аминокислоту. Отщепление ацильной группы приводит к резкому увеличению растворимости L -аминокислоты, за счет этого аминокислоты легко отделить друг от друга, и выделяется чистая L -форма. Остающаяся ацил-D-аминокислота при нагревании рацемизируется, т. е. опять переходит в смесь ацилированных D,L -аминокислот, и процесс ферментации повторяют сначала. В итоге единственным продуктом является L-аминокислота. Причем для аминоацилазы не имеет значения, какую аминокислоту ей гидролизовать, важно лишь строение ацильной части, к которой фермент имеет строгую специфичность.
Препарат иммобилизованной аминоацилазы готовили следующим
образом. 1 000 л ДЭАЭ-сефадекса перемешивали с 1 100 — 1 700 л водного раствора аминоацилазы при 35 °С и рН 7,0 в течение 10 ч. После фильтрации препарат промывали водой. Выход активности по отношению к первоначально растворенному ферменту составлял 55 — 60 %. Колонна с иммобилизованной аминоацилазой сохраняла более 60 % исходной активности после месяца работы. Регенерация катализатора в колонне производится путем простого добавления свежего раствора фермента, который опять адсорбируется на носителе. Устойчивость последнего составляет 5 — 8 лет.
кристаллы L-аминокислот
1 —
Рис. 25. Технологическая схема производства L-аминокислот
из рацемической смеси с применением иммобилизованной аминоацилазы:
резервуар с исходной рацемической смесью; 2 — фильтр; 3 — теплообменник;
4 — биореактор с иммобилизованным ферментом; 5 — испаритель;
6 — кристаллизатор; 7 — сепаратор; 8 — рацемизатор
Пенициллинацидаза (пенициллинамидаза, ацилтрансфераза) относится к третьему классу, катализирует гидролиз боковых цепей пенициллинов и их производных, воздействуя на C-N-связь. Ферменты, выделенные из разных источников, имеют различные характеристики субстратов, и это используется для классификации различных типов пенициллинамидаз. Имеются три их типа. Если фермент гид-ролизует специфический пенициллин V, то он обозначается типом I. Его можно встретить в грибах и бактериях. Ферменты типа II специфичны к пенициллину G и содержатся только в бактериях. К III типу относят все пенициллинамидазы, катализирующие гидролиз амино-ациллинов и цефалоспоринов.
При ферментативном гидролизе пенициллинов и цефалоспоринов
образуются соответственно б-аминопенициллаповая (6-АПК) и 7-ами-иоцефалоспориновая кислоты, которые затем используют для получения полусинтетических антибиотиков. Различными компаниями производятся разные препараты иммобилизованной пенициллинами-дазы. По итальянской технологии их готовят смешиванием раствора фермента с триацетатом целлюлозы в хлористом метилене. Образующуюся эмульсию с ферментом далее подвергают экструзии в нити. Волокна триацетата целлюлозы, содержащие иммобилизованный фермент, размещают вдоль термостатируемой колонны. Общий выход составляет 85 %.
В России на ОАО «Биохимик» для производства 6-АПК используют пенициллинамидазу, включенную в полиакриламидный гель, модифицированный глутаровым диальдегидом.
Лиазы. Лиазы относятся к четвертому классу, катализируют отщепление от субстратов той или иной группы (не путем гидролиза) с образованием двойной связи или, наоборот, присоединение групп к двойным связям. Среди них наибольшее промышленное значение имеют ферменты, участвующие в реакциях синтеза аминокислот и других органических кислот.
Аспартаза (аспартатаммиаклиаза) катализирует реакцию синтеза L-аспарагииовой кислоты из фумаровой кислоты и аммиака. Этот фермент особенно активен у факультативных анаэробных бактерий. Содержится также в бактероидах, находящихся в клубеньках бобовых растений.
Аспартаза катализирует реакцию присоединения аммиака по двойной связи фумаровой кислоты. Этот процесс не требует присутствия других кофакторов, кроме ионов двухвалентного магния. Фермент накапливается в клетках бактерий при росте культур на богатых средах, содержащих мясной бульон, пептон, дрожжевой экстракт или набор большого числа аминокислот.
Получение L-аспарагиновой кислоты, растворимой и иммобилизованной внутриклеточной аспартазой, оказалось неэкономичным в связи с низкой стабильностью. Поэтому для этих целей используют целые клетки, включенные в полимерные гели, в частности, в Японии их включают в полиакриламидный гель (ПААГ). Время полуинактивации препарата при 37 °С составляет 120 дней (для сравнения: для иммобилизованной аспартазы — 30 дней). Для иммобилизации 10 кг влажных клеток суспендируют в 40 л физиологического раствора, добавляют 7,5 кг акриламида, 0,4 кг метиленбисакриламида, 5 л 5%-го диметиламинопропиоиитрила и 5 л 2,5%-го персульфата калия. Смесь оставляют на 10 — 15 мин и образующийся гель формируют в кубики размером 2 — 3 мм.
Исходным сырьем для синтеза L-аспарагиновой кислоты служит фумарат аммония. Его раствор в концентрации 1 моль/л, содержащий 0,001 моль/л хлористого аммония, пропускают при рН 8,5 и 37 °С через колонку с иммобилизованными клетками со скоростью
потока 0,6 об/ч. Значение рН, полученного на выходе 2 400 л раствора, доводят до 2,8 добавлением 60%-го раствора серной кислоты при температуре 90 °С, затем охлаждают до 15 °С и выдерживают 2 ч. Кристаллизирующуюся аспарагиновую кислоту собирают центрифугированием и промывают водой.
В России разработаны и испытаны на пилотной установке биокатализаторы, полученные иммобилизацией клеток Е. coli-85 с аспар-тазной активностью в гель каррагенана и альгината кальция.
Фумараза (фумаратгидратаза) катализирует реакции синтеза из фумаровой кислоты и воды L -яблочной кислоты, которая находит применение в качестве заменителя лимонной кислоты в продуктах питания и фармацевтических препаратах.
И в этой технологии используют клетки, только с фумаразной активностью, иммобилизованные в ПААГ. Для подавления побочной реакции образования янтарной кислоты, которая с трудом отделяется от непрореагировавшей фумаровой кислоты, эти клетки обрабатывают детергантами, например экстрактом желчных кислот, в концентрации 0,2 % при 37 °С, рН 7,5 в течение 20 ч. По сравнению с интактны-ми иммобилизованные клетки существенно стабильнее, и время их полуинактивации составляет около двух месяцев.
В Италии производят иммобилизованную фумаразу, где фермент включен в полые волокна триацетата целлюлозы с сохранением 40%-й активности.
Изомеразы. Изомеразы относятся к пятому классу ферментов, катализируют реакции изомеризации. Из них в промышленности <:широкое применение нашла глюкозоизомераза. Существует несколько типов изомераз, но не все они обладают подлинной глюкозоизоме-ризующей активностью. Практическое применение нашел только фермент D-ксилозокетоизомераза, КФ 5.3.1.5, применяющийся для производства глюкозофруктозного сиропа (ГФС) и фруктозы. Это связано с тем, что он не требует присутствия NAD+в реакционной среде и обладает высокой термостабильностыо. В связи с практическим па-значением его называют глюкозоизомеразой (ГЛИ).
Фруктоза, или фруктовый (плодовый, медовый) сахар, по сравнению с обычным пищевым сахаром, в состав которого она также входит, но в виде химического соединения с менее сладкой глюкозой, обладает более приятным вкусом. Она на 70 % слаще сахара, и потреблять ее можно в меньших количествах. Это очень важно для больных сахарным диабетом, так как усвоение фруктозы не связано с инсулином. Сахар (сахарозу) нельзя заменить Ь-глюкозой, поскольку глюкоза менее сладкая. Этот недостаток можно устранить, если последнюю частично изомеризовать во фруктозу ГЛИ.
Во многих странах освоена технология получения эффективных иммобилизованных биокатализаторов с глюкозоизомеразной активностью, многие из которых уже внедрены в производство. Наиболее известные препараты получены следующим образом: адсорбцией фер-
ментного экстракта иа ДЕАЕ-целлюлозе или на пористом алюминии, или на ионообменных смолах; включением ферментного препарата в желатиновый гель с последующей сшивкой глутаровым диальдеги-дом или в полые волокна триацетата целлюлозы.
Для выбора типа иммобилизованного биокатализатора, конструкции реактора, условий каталитического процесса в реакторе необходимо проведение большой предварительной работы. Это хорошо видно на примере того, какие параметры исследовали американские ученые при внедрении в производство технологии получения кукурузного сиропа с высоким содержанием фруктозы с использованием иммобилизованной ГЛИ.
Биохимические параметры включают: активность препарата; стабильность фермента (время жизни и полуинактивации); производительность в используемом диапазоне времени жизни; оптимальную концентрацию субстрата; влияние концентрации субстрата; воздействие концентрации олигосахаридов; влияние растворенного кислорода; минимальное и максимальное время контакта с субстратом; образование побочных продуктов реакции; чувствительность к изменению рН и температуры; устойчивость при хранении; вымываемость фермента; рост микроорганизмов; характеристики потока на выходе (состав, цвет, запах, рН, содержание белков и т. д.).
К механическим параметрам относятся: размер, форма частиц и распределение по размерам; насыпная масса в сухом и влажном виде; набухание; сжимаемость; когезия; истирание частиц.
Гидромеханические параметры: перепад давления; тип потока (восходящий или нисходящий); уплотнение слоя; осевая дисперсия и ка-налообразование; распределение времени пребывания; расслаивание; отношение длины к диаметру; минимальная скорость начала псевдоожижения.
В ходе анализа вышеприведенных параметров был выбран биокатализатор со следующими свойствами: форма катализатора — сухие гранулы; внешний вид — окрашен в желто-коричневый цвет; объемная плотность в сухом состоянии — 0,64 — 0,72 г/см3; объемная плотность во влажном состоянии — 0,2 г/см3; характерный размер пор — 0,2 мкмоль; активность — не менее 0,04 ед./г; производительность — до 907 кг 42%-го обогащенного фруктозой сиропа на 0,45 кг фермента в течение 1 000 ч; объем пустот в слое — 45 %.
Выбранный размер частиц биокатализатора удовлетворял двум взаимоисключающим требованиям: с одной стороны, эти частицы достаточно малы, чтобы скорость диффузии не лимитировала скорость всего процесса, а с другой стороны, они велики, чтобы свести к минимуму перепад давления на реакторе колонного типа со слоем иммобилизованного фермента. Ниже приводятся оптимальные условия, выбранные экспериментальным путем: содержание сухого вещества — 40 — 45 %; глюкозы в исходной смеси — 93 — 96 %; требования к исходной смеси — ее необходимая очистка фильтрованием, обработ-
кой активированным углем и ионообменными смолами; рН — 8,2 — 8,5; допустимое падение рН — на 0,2 — 0,4; температура — 60 °С; активатор — 4 • 10~4 моль Mg2+; время контакта фермента с субстратом — 0,5 — 4 ч.
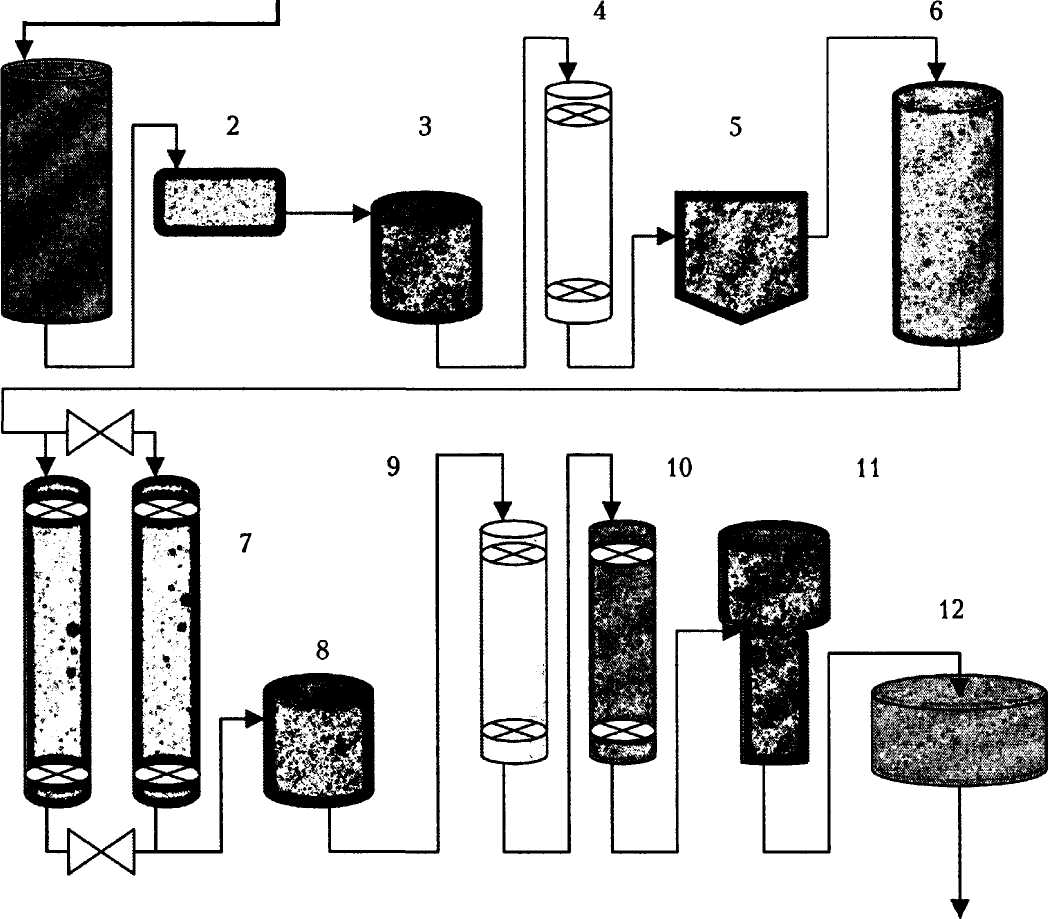
Как следует из условий, для того чтобы процесс шел нормально, необходимо высокое содержание глюкозы в поступающей в реактор смеси. Если в ней доля олигосахаридов превышает 10 %, наблюдается снижение активности биокатализатора. Большой диапазон времени (0,5 — 4 ч) контакта последнего с субстратом объясняется постепенной его инактивацией. Активность фермента падает, и при постоянной скорости потока реагентов степень превращения субстрата постоянно снижается. Поэтому для обеспечения необходимого качества продукции по мере инактивации фермента время его контакта с субстратом увеличивают путем снижения скорости потока. Необходимо иметь в виду, что размеры реакторов колонного типа определяются гидромеханическими свойствами биокатализатора. При нисходящем движении реакционной смеси слой иммобилизованного фермента может сжиматься под давлением, в результате этого сопротивление потоку падает. Учитывая известное время контакта биокатализатора с субстратом и заданную производительность всей установки, можно определить размеры и количество колонных реакторов. В данном случае целесообразно установить несколько колонн, так чтобы они инактиви-ровались и заменялись последовательно, Это позволит максимальным образом использовать биокатализатор ив то же время обеспечить постоянно высокую производительность установки в целом. Технологическая схема процесса производства кукурузного сиропа с высоким содержанием фруктозы, основанного на использовании иммобилизованной ГЛИ, представлена на рис. 26. В данном случае для эффективной работы фермента необходимо множество операций предварительного разделения и обработки промежуточных продуктов между стадиями получения глюкозы из крахмала (осахаривания) и изомеризацией. Для повышения термической устойчивости а-амила-зы, применяемой для гидролиза крахмала при температуре 105 °С, добавляют ионы кальция, которые в свою очередь ингибируют ГЛИ, поэтому перед поступлением глюкозы в реактор изомеризации их удаляют из среды связыванием ионообменными смолами.
В России получен оригинальный иммобилизованный препарат клеток Streptomyces albogrisedus с глюкозоизомеразной активностью. Их иммобилизацию проводили путем включения в матрицу, состоящую из двух гелей — гидроокси Со2+ и хитозана. Термообработан-ные клетки влажностью 90 % суспендировали в 6 мл 3%-го раствора, приготовленного на основе 18%-го ацетата кобальта.
Смесь гомогенизировали и по каплям добавляли к 5%-му водному раствору аммиака. В качестве субстрата использовали 2 моля раствора глюкозы, содержащей 5 • 10~3моль MgSO4• 7Н2О. Ионы кобальта выполняли роль стабилизатора. Испытания на пилотной установке в лабораторных условиях дали неплохие результаты.
крахмал, а-амилаза
глюкозофруктозный сироп
Рис. 26. Технологическая схема производства кукурузного сиропа
с высоким содержанием фруктозы:
1 — резервуар для ожижения и осахаривания крахмала; 2 — фильтр; 3 — резервуар для очистки активированным углем; 4 — ионообменник (связывание кальция); 5 — концентратор; 6 — резервуар для подготовки смеси; 7 — колонны с иммобилизованными ферментами; 8 — резервуар для очистки активированным углем; 9 — катионообменник; 10 — анионообменник; 11 — резервуар для упаривания;
12 — резервуар для охлаждения
Оксидоредуктазы. Иммобилизованные ферменты этого класса по отдельности или в комплексе с другими ферментами используют для холодной стерилизации молока. Тепловая обработка оказывает отрицательное воздействие на его органолептические свойства, особенно при хранении. Так, в молоке, предназначенном для сыроделия, после этого снижается способность казеина к свертыванию под действием сычужного фермента. Поэтому тепловая обработка в некоторых случаях нежелательна и ее лучше заменить холодной стерилизацией. Существует два ее способа.
Первый способ заключается в воздействии на молоко каталазы с введением перекиси водорода. Так, эффект пастеризации продукта, предназначенного для производства сыра, может быть достигнут без нагревания обработкой 0,05%-м раствором перекиси водорода за счет разрушения последней каталазой и выделения атомарного кислорода. Применение иммобилизованной каталазы делает этот способ экономически выгодным. Однако основным препятствием при ее использовании для холодной стерилизации является инактивация фермента перекисью водорода. Проблему можно решить заменой ферментов животного происхождения грибными, которые менее чувствительны к перекиси, либо созданием реакторов, оптимальных для данного процесса. Уже получены препараты иммобилизованной на аминокремие-земах каталазы гриба Penicillium vitale, которые характеризуются высокими каталитической активностью, рН и термостабилыюстыо при хранении. Период сохранения половины начальной активности каталазы, иммобилизованной на силохроме через углеводный компонент фермента, составляет 45 мес.
Второй способ холодной стерилизации заключается в использовании лактопероксидазной системы — лактопероксидазы-тиоцигит- та — и непрерывно выделяющейся перекиси водорода. Промежуточный продукт каталитического окисления тиоцианата под действием лактопероксидазы обладает антибактериальными свойствами. Молоко содержит все компоненты этой системы, кроме перекиси водорода. Введение последней можно обеспечить проведением соответствующих ферментативных реакций. Перекись водорода получают путем пропускания сыворотки через колонну с иммобилизованными на пористом стекле ферментами Р-галактозидазой и глюкозооксидазой. Этот способ позволяет обеспечить действие бактерицидной фазы в молоке при нейтральных значениях рН, что используется известной шведской фирмой «Альфа-Л аваль».