На практике широко применяемым методом специфической модификации аминогрупп белков является образование азометиновых связей в реакциях белков с альдегидами:
н
ОНС----- (СН2)3—-СНО + H2N
Ф
НС---- N=CH
CH=N
Ф
При использовании глутарового альдегида необходимо учитывать возможность образования побочных продуктов поликонденсации и полимеризации. Азометиновые связи легко разрушаются в кислых средах с регенерацией исходных веществ. Это свойство применяют для удаления с носителя ковалентно иммобилизованного фермента путем простого изменения рН среды. Для устойчивости к кислым средам проводят реакции восстановления азометииовой группировки. За последние годы глутаровый альдегид был использован для иммобилизации пенициллииамидазы, пепсина и др. Носителями служили целлюлозы и ее производные, кремнеземы и т. д.
Г. Реакции азосочетания
Соли диазолина могут вступать в различные реакции сочетания. В азосочетании могут участвовать различные группы, но чаще NH2.
В слабощелочной среде основной мишенью в белке является фе-нольный радикал тирозина.
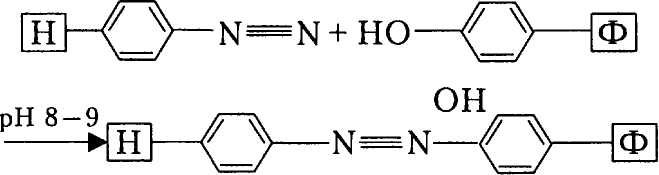
|
Носитель со связью -NsN с белком связывается очень прочно. Его получают обработкой полимера 2-(амилофенил)-диоксиланом и диазотированием полученной аминогруппы.
Д. Реакции связывания
По сульфгидрильным группам (-S-S-)
Сульфгидрильные группы в белках встречаются довольно редко, так как они быстро окисляются с образованием тиоловых дисульфид-ных мостиков. Вот это свойство и используется для ковалентной иммобилизации. Если имеется фермент с SH-группой и носитель с ней же, то в присутствии кислорода они образуют прочную дисульфид-ную связь.
СН
-SH + HS
| о | |||
| ф | и | ||
■S-S
ф
Для увеличения возможности протекания такой иммобилизации существует два пути:
1) повышение числа сульфгидрильных групп в белке; это можно
сделать посредством обработки белка некоторыми восстановителями — меркаптоэтаиолом, цистеином, боргидратом натрия;
2) использование носителей с большим количеством тиолов. Для этого применяют амипопроизводные сефарозы и сефадекса, модифицированные гомоцистеинтиолактоиом, сополимеры акриламида с тио-лосодержащими мономерами и т. д.
£. Радикальные реакции
При фотохимическом распаде алкил- и арилазидов образуются очень реакционноспособные короткоживущие радикалы — иитрены:
R N ►R—N + N2
Часто эти алкил- и арилазиды входят в состав носителей и сшивающих агентов (например, аминоэтилсульфаната). А иитрены реагируют с очень многими группами белка. Если смесь носителя или сшивающего агента с алкил- и арилазидом и белок облучают УФ-лучами, то образуется очень прочная связь между иитренами и ферментом.
О
R—N3+H2—С—О
О О
Ф
R—N+H
О—Ф
О О
R—NH — С—О— Ф
О
Однако здесь нужна осторожность, поскольку часто длина волны максимума поглощения в области УФ алкил- и арилазидов может совпадать с длиной волны (250 — 300 нм), при которой разрушаются белки.
Применение иммобилизованных ферментов
В промышленности
Гидролитические ферменты. Гидролазы относятся к третьему классу ферментов, общим их свойством является то, что они катализируют реакции гидролиза, т. е. расщепления более сложных соединений на
более простые с присоединением воды. Этот класс подразделяется на 11 подклассов. Многие гидролазы компартментализированы в тех или иных структурных элементах клетки, отделенных от цитоплазмы мембранами. Видимо, такая их локализация защищает важные биополимеры клетки от деструкции. Грамположительные бактерии выделяют в среду много гидролаз. У грамотрицательных хранилищем последних служит периплазматическое пространство наружной оболочки, ограниченное двумя мембранами. В клетках эуокариот гидролазы могут локализоваться в особых органоидах — лизосомах, периплазме или выделяться в среду. Большинство используемых в промышленности гидролитических ферментов представляют собой внеклеточные продукты жизнедеятельности микроорганизмов. В то же время некоторые из них обнаружены в цитоплазме, где они участвуют в метаболических циклах.
Амилазы — ферменты, катализирующие гидролиз крахмала, относятся ко второму подклассу гидролаз, имеют шифр 3.2.1. Они широко распространены в природе, синтезируются многими микроорганизмами, животными и растениями. К ним относятся а- и р-амилазы, глюкоамилаза и др. За последние 20 лет гидролиз крахмала для получения сиропов различного состава приобрел наибольшее значение из всех промышленных процессов, использующих ферменты. Гидро-лизаты классифицируют согласно содержанию в них редуцирующих Сахаров в пересчете на глюкозу и характеризуют декстрозным эквивалентом (ДЭ), причем чистая глюкоза составляет 100 ДЭ. Подобрав комбинацию ферментов и условий, можно получить продукты с точно определенными физическими и химическими свойствами. Ниже приведена общая схема процесса (рис. 21).
После измельчения исходного материала крахмал диспергируют или желатинизируют в водном растворе и ожижают с помощью термостабильной бактериальной а-амилазы при температуре от 80 до 110°С. Этот этап может быть заменен кислотным гидролизом, но, как правило, последний менее эффективен. Ожижение занимает от 2 до 4 ч и обычно завершается, когда величина ДЭ составляет 10 — 20. Оно сопровождается осахариванием, процедуру которого можно варьировать в зависимости от желаемого продукта. Добавление пуллу-ланазы, фермента устраняющего ветвление, и р-амилазы к декстринам приводит к получению сиропа с высоким содержанием мальтозы. Поскольку пригодные для этого микробные Р-амилазы остаются дефицитными, жидкость обычно готовят с помощью смеси грибной а-ами-лазы и глюкоамилазы. Такой продукт содержит больше глюкозы, но ее соотношение с мальтозой можно контролировать тщательным подбором пропорций этих двух ферментов и условий реакции.
Важный промышленный процесс — производство глюкозы для изомеризации ее во фруктозу. После ожижения декстрины быстро охлаждают примерно до 60 °С и обрабатывают глюкоамилазой в течение 24 — 90 ч в зависимости от использованного количества
фермента. Осахаренный крахмал должен содержать не менее 94 — 96 % глюкозы, так как остаточные ди- и олигосахариды часто обладают неприятным вкусом, а изомераза не действует ни на один из них. После коррекции рН и ионной силы продукт обрабатывают изомера-
зои.
Крахмал
Бактериальная а-амилаза Пуллуланаза
разветвленные и линейные олигосахариды
линейные олигосахариды
E 0WtI1umWrSwk3IkNv4tKQ7pRIItc/m9QfAMAAP//AwBQSwECLQAUAAYACAAAACEAtoM4kv4AAADh AQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQABgAIAAAAIQA4 /SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQABgAIAAAAIQAb F1rkFQIAACwEAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQItABQABgAIAAAA IQCtSfkH3AAAAAkBAAAPAAAAAAAAAAAAAAAAAG8EAABkcnMvZG93bnJldi54bWxQSwUGAAAAAAQA BADzAAAAeAUAAAAA " o:allowincell="f" strokeweight="1.2pt">
| I |
Глюкоамилаза
-Амилаза
мальтоза
глюкоза
Грибная а-амилаза
Глюкозоизомераза
мальтоза и мальтотриоза
сироп с высоким содержанием фруктозы
Рис. 21. Схема гидролиза крахмала
Проблема реализации непрерывной технологии стоит в эффективной иммобилизации второго фермента — глюкоамилазы. Во-первых, потому что а-амилаза считается более доступной и дешевой, и в принципе нет необходимости в ее регенерации. Ею обрабатывают крахмал при кипячении в течение нескольких минут. Во-вторых, реакция иммобилизованной а-амилазы с малорастворимым, вязким крахмалом проходит с трудом. Кроме того, глюкоамилаза реагирует с растворимыми олигосахаридами, что сравнительно легко осуществить и для иммобилизованного фермента.
Сконструированы типы препаратов иммобилизованного фермента, обладающие хорошими свойствами, полученные ковалентным связыванием с пористым силикагелем через глутаровый диальдегид, включением в полые волокна триацетата целлюлозы, адсорбцией на ДЭАЭ-целлюлозе и т. д. Все эти препараты характеризуются высокой стабильностью при умеренных температурах (< 50 °С), время полуинак-
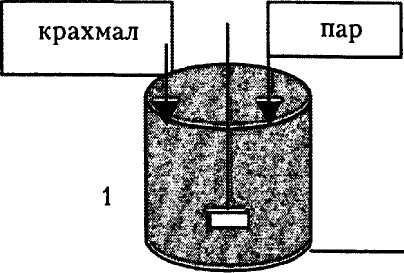
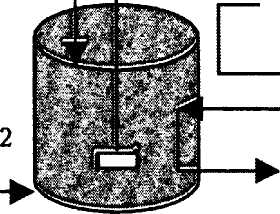
тивации составляет многие месяцы. Однако оно сокращается до 5 — б дней, если температура повышается, стабильность препаратов в этом случае резко падает. Схема пилотной установки для получения глю-козного сиропа с применением иммобилизованной глюкоамилазы приведена на рис. 22.
|
| горячая вода |
|
а-амилаза
I
фильтр
сигнальное устройство
I- У
глюкозный сироп
Рис. 22. Технологическая схема производства глюкозного сиропа
с применением иммобилизованной глюкоамилазы:
1 — резервуар для обработки крахмала паром; 2 — резервуар для обработки а-амилазой; 3 — биореактор с иммобилизованной глюкоамилазои
Исходный крахмал помещается в резервуар объемом 1 м3 (1), где обрабатывается паром в течение 3 — 4 мин под давлением и далее перекачивается в следующий резервуар такой же вместимости (2). Там он подвергается обработке а-амилазой.
После фильтрования разжиженный крахмал подается в реакционную колонну — биоректор (3), загруженный 16 кг иммобилизованного на микропористом кремнеземе фермента. Гидролиз декстринов проводится при температуре 40 °С. Время контакта 30%-го раствора декстринов с иммобилизованным ферментом составляет 9 мин, в то время как при гидролизе растворимой глюкоамилазои оно составляет при тех же условиях 72 ч.
fi-Галактозидаза (p-D-галактозидгалактогидролаза, лактаза, КФ 3.2.1.23) относится к глюкозидазам. Ферменты из разных источников по своей структуре, размеру молекулы, молекулярной массе и активности различаются, что позволяет получать их виды с широким диапазоном действия. В результате гидролиза ферментом молочный сахар (лактоза) превращается в более сладкую и хорошо растворимую смесь моносахаров — глюкозы и галактозы, и поэтому препараты |3-галакто-зидазы широко применяют в молочной промышленности и в тех отраслях, где можно использовать отходы молокоперерабатывающеи промышленности, содержащие лактозу.
^12^22^11 +Н2О -> С6Н12О6+ С6Н12О6
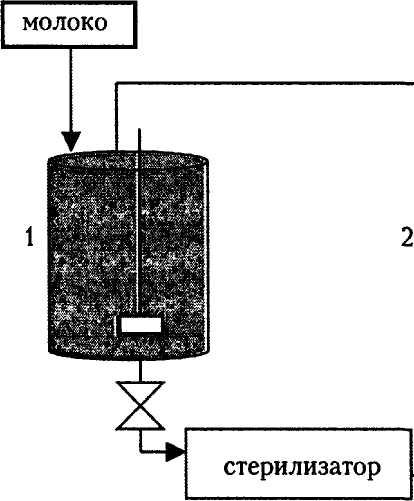
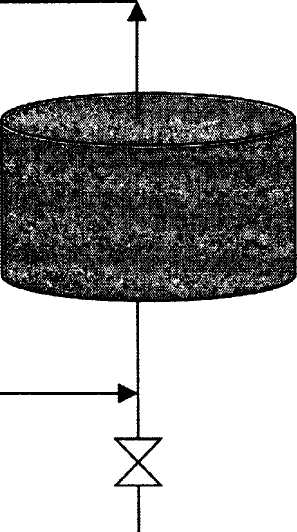
В Италии освоено промышленное производство безлактозного молока с применением иммобилизованной лактазы (рис. 23).
|
|
;
Рис. 23. Технологическая схема получения безлактозного молока
с использованием иммобилизованной лактазы:
1 — резервуар с молоком; 2 — биореактор с иммобилизованным ферментом;
3 — асептический резервуар
Снятое молоко из резервуара (1) пропускают через стерилизатор (температура — 142 °С, время — 3 сек), быстро охлаждают до 4 — 7 °С и прокачивают через реакционную колонну (2) в асептический резервуар емкостью 500 л (3). Биореактор емкостью 20 л содержал 4 кг иммобилизованного фермента, включенного в волокна триацетата целлюлозы. Волокна закрепляли вертикально в нижней и верхней точках реактора. Молоко через него можно пропускать многократно со скоростью 7 л/мин до достижения заданной степени конверсии. Производительность установки —Ют безлактозного молока в день.
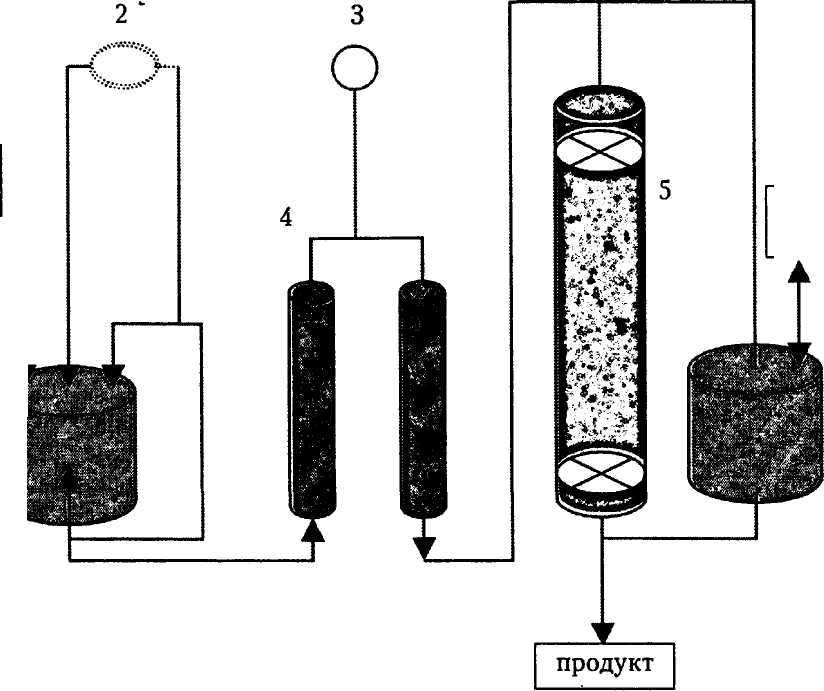
В Англии запущен полупромышленный процесс гидролиза лактозы в молочной сыворотке с помощью иммобилизованной р-галактози-дазы. Установка находится в действии 5 дней в неделю непрерывно и обрабатывает 30 т сыворотки, производя 1,7 т сахарного сиропа (рис. 24).
| уксусная кислота |
 соляная кислота
соляная кислота
| i | |
| i Ш | |
| щ | |
| сыворотка |
Рис. 24. Технологическая схема установки для гидролиза лактозы
в молочной сыворотке (компания «Милк Маркетинг», Англия):
1 — резервуар для подготовки сыворотки; 2 — контроль рН; 3 — контроль
температуры; 4 — ионообменники; 5 — реакционная колонка с иммобилизованным
ферментом; 6 — резервуар с разбавленной уксусной кислотой
Сыворотку перед введением в биореактор подкисляют в резервуаре (1), пастеризуют, производят ультрафильтрацию и пропускают через ионообменники (4) для деминерализации. После этого ее проводятчерез реактор (5) с иммобилизованной лактазой нисходящим потоком. Используемый здесь фермент ковалентно связан с пористым си-ликагелем с помощью глутарового диальдегида. Биореактор периодически очищают разбавленной уксусной кислотой из резервуара (6).
Мощность установки составляет 360 л/ч, а степень гидролиза — 80 %.
Протеолитические ферменты — пептидгидролазы (шифр КФ 3.4), катализирующие гидролиз пептидов и белков. Основной реакцией, осуществляющейся при участии ферментов, является гидролиз пептидной связи. Биокатализаторы часто синтезируются в неактивной форме, т. е. в зимогенах, которые или хранятся в клетке, или
проходят от места их синтеза к тому центру, где они необходимы в активной форме. В частности, в клетке в неактивной форме транспортируются трипсин, пепсин, химотрипсин, карбоксидазы. Их активация осуществляется по одному из двух путей: а) образование активных ферментов из предшественников автокаталитически; б) образование активных форм в присутствии ионов металлов. Протеазы нашли широкое применение в промышленности и в медицине (табл. 4).
Таблица 4
Применение протеаз
| № | Фермент | Источник | Область применения |
| Трипсин | Поджелудочная железа животных | Медицина, мягчение мяса, осветление пива | |
| Пепсин | Желудок животных | Медицина, мягчение мяса, свертывание молока | |
| а-Химотрипсин | Желудок животных | Медицина | |
| Ренин (химозин) | Желудок теленка | Производство сыра, свертывание молока | |
| Панкреатическая протеаза | Поджелудочная железа животных | Медицина, производство моющих средств, мягчение и обезволашивание кожи | |
| Папаин | Папайя | Медицина, осветление пива, мягчение мяса | |
| Бромелаин | Ананас | Медицина, мягчение мяса, осветление пива | |
| Фицин | Инжир | Медицина, мягчение мяса, осветление пива | |
| Протеаза | Aspergillus oryzae | Осветление и вкусовая обработка сакэ | |
| Протеаза | Aspergillus niger | Производство кормов, медицина | |
| Протеаза «Субтилизин» | Bacillus subtilis | Производство детергентов, мягчение мяса, производство рыбных гидролизатов | |
| Протеаза | Streptomyces griseus | Производство детергентов, рыбных гидролизатов и мягчение мяса |
Иммобилизованные протеазы можно использовать для свертывания молока. Такой процесс необходимо проводить в два этапа — выдержки продукта с ферментом и каогуляции. Только в этом случае достигается непрерывность процесса, так как при его одностадийно-сти образуются творожные сгустки вокруг частиц нерастворимого фермента, что затрудняет доступ к нему порции молока. На стадии вы-
держки предусматривается обработка последнего иммобилизованным ферментом при температуре ниже 15 °С. При таком режиме происходит гидролиз к-казеина, но молоко не каогулирует. Это осуществляется после обработки ферментом в холоде нагреванием и термостати-рованием при температуре 37 °С. Процесс агрегации белков молока происходит после гидролиза 80%-го к-казеина. В России получены препараты химотрипсина, ковалентно связанного с КМ-целлюлозой, и модифицированного, сорбированного на анионитах. Они обладают достаточно высокой активностью и испытаны на молокосвертывающую способность.
Положительные результаты дали также испытания сычужного фермента, иммобилизованного на поливинилспиртовых волокнах и включенного в гель альгината кальция при производстве сыра. Реологические показатели и характер пространственной структуры сгустка были аналогичны при использовании иммобилизованного и свободного сычужного ферментов. Однако для внедрения их в производство необходимо решить проблему стерилизации стабилизированных ферментных препаратов после нескольких циклов работы.
Аминоацилазы относятся к подклассу 3.5 и объединяют ферменты, действующие на C-N-связи, отличающиеся от пептидных. Способность аминоацилаз различать L- и D -аминокислоты используют в промышленности для производства последних и других, в том числе незаменимых. Получение оптически активных аминокислот разделением их рацемических (оптически неактивных) смесей было одним из первых процессов, осуществленных с помощью иммобилизованных ферментов на промышленном уровне. Раньше он проводился с применением растворимого фермента — аминоацилазы, но был недостаточно эффективным. После перехода на иммобилизованную амино-ацилазу его продуктивность возросла в 1,5 раза, и в настоящее время в Японии осуществляют на промышленном уровне производство большинства незаменимых аминокислот.
Чтобы найти оптимальную форму иммобилизованного фермента для этого процесса, японские ученые провели обширные исследования, результаты которых изложены' в табл. 5.
Эти данные говорят о том, что для промышленного использования помимо начальной активности необходимо учитывать и многие другие факторы. В данном случае исследователи остановились на ами-ноацилазе, иммобилизованной ионными связями на ДЭАЭ-сефадексе, в силу высокой активности, простоты получения, возможности регенерации и устойчивости такого катализатора, который к тому же без какого-либо механического разрушения и снижения связывающей активности функционирует 5 лет.
Таблица 5