Введение
Впервые шикимовая кислота (3,4,5-тригидрокси-1-циклогексен-1-карбоновая кислота) была выделена в 1885 году из плодов аниса - растения, произрастающее в Японии - Illicium anisatum. Японское название данного растения «Шикимино - ки», что и послужило основой для названия данной кислоты. Дальнейшие исследования данного соединения показали, что оно является промежуточным продуктом щикиматного пути у микроорганизмов и растений. Данный метаболитический путь отсутствует у животных.
Шикимовая кислота является промежуточным звеном в синтезе лигнина, ароматических аминокислот (фенилаланина, тирозина и триптофана), убихинов, фолиевой кислоты, тетрациклина, фенольных и карболовых соединений и большинства алкалоидов растений и микроорганизмов. Используется в качестве реагента в органическом синтезе.
Также используется в качестве исходного вещества в синтезе осельтамивира (тамифлю) - противовирусного препарата, используемого в лечении гриппа; зейленона для лечения раковых заболеваний; монопальмитилоксишикимовой кислоты, обладающей анетикоагуляционной активностью при внутримышечном введении.
Производные шикимовой кислоты могут использоваться в качестве гербицидов и антибактериальных средств, так как они могут блокировать шикиматный путь у растений и бактерий не нанося вреда для животных и человека, так как у них отсутствует данный метаболитический путь.
Данная кислота может быть использована в качестве исходного соединения для синтеза ряда ароматических и хиральных соединений.
Как видно из сказанного шикимовая кислота является важным продуктом для химической промышленности, медицины, фармакологии и сельского хозяйства. Поэтому встаёт вопрос о получении большого количества данного соединения. В мировой фармацевтической промышленности существует три подхода к получению шикимовой кислоты: выделение из растительного сырья, микробиологический и химический синтез. Химический синтез является дорогостоящим методом. Синтез из растительного сырья является трудоёмким методом и не обеспечивает высокого выхода продукта. Поэтому наиболее перспективным методом является микробиологический синтез.
Цель: изучить литературу по данной проблематике и получение промежуточной конструкции, содержащей вставку, ограниченную генами tmrB и aroK, на основе плазмиды pMTL21C.
Задачи:
1) Амплифицировать фрагмент ДНК, ограниченный генами tmrB и aroK, с матриц В. Subtilis ВНИИгенетика-15 С10 и В. Subtilis ВНИИгенетика-15 D4.
2) Продукт амплификации лигировать с плазмидой pMTL21C, для получения промежуточной конструкции. Плазмиду pMTL21C предварительно подвергают рестрикционному анализу по сайту рестрикции SmaI.
) Трансформировать полученной лигированной смесью клетки E.coli DH5б.
Обзор литературы
Общая характеристик шикимовой кислоты
Шикимовая кислота представляет собой бесцветные игольчатые кристаллы с температурой плавления 184°С. Это соединение левовращающее и имеет удельное вращение -157°С. Для данного вещества характерен единственный максимум в ультрафиолетовом диапазоне, наблюдаемый при л = 235 нм. Для шикимовой кислоты описано несколько стериоизомеров, но биологической активностью обладает б-изомер, структура которого изображена на рис. 1.1.
шикимовый плазмида реактив бактериальный

Рисунок 1.1 - Общая структура б-изомера 3,4,5-тригидрокси-1-циклогексен-1-карбоновой кислоты
Молекула шикимовой кислоты в целом не симметрична и имеет 3 стереогенных центра, что обеспечивает возможность существования 23=8 стереоизомеров (4 пары энантиомеров). Природная (−) - шикимовая кислота имеет (3R, 4S, 5R) - конфигурацию, семь других стереоизомеров ((3S, 4R, 5S)-, (3R, 4R, 5S)-, (3S, 4S, 5R)-, (3R, 4S, 5S)-, (3S, 4R, 5R)-, (3S, 4S, 5S) - и (3R, 4R, 5R) - шикимовые кислоты) не имеют биологического и практического значения. Рацемат из (3R, 4S, 5R) - и (3S, 4R, 5S) - шикимовых кислот имеет температуру плавления 191-192°C.
Для шикимовой кислоты характерны реакции являющиеся типовыми для соединений, содержащих карбоксильную группу, три гидроксильные группы и двойную связь. Стереохимия молекулы позволяет при соответствующих условиях протекать внутримолекулярным реакциям между карбоксильной группой и одной гидроксильной группы. Для молекулы также характерны реакции цис-транс переходов для гидроксильных групп [7].
Шикиматный путь
Шикиматный путь является общим метаболитическим путём для целого ряда организмов, приводит к образованию разнообразных ароматических соединений. Ключевым метаболитом этого пути является шикимовая кислота, которую можно использовать в качестве материала для синтеза ингибиторов нейраминидазы и препаратов, используемых в противоопухолевой терапии.
Шикиматный путь был обнаружен Бернхардом Дэвисом и Дэвидом Спринсоном как биосинтетический путь образования ароматических аминокислот фенилаланина, тирозина и триптофана. Этот путь присутствует у разных групп микроорганизмов, у растений и паразитов, но отсутствует у животных. Фенилаланин и триптофан являются важными компонентами рациона питания животных, и животные синтезируют тирозин из фенилаланина в одну стадию.
Значение шикиматного пути велико, так как этот путь является единственным установленным путём биосинтеза ряда важнейших природных соединений, в том числе значимых в плане их практического использования.
Схема шикиматного пути представлена на рисунке 2.1.
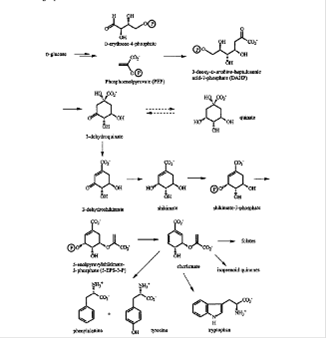
Рисунок 2.1 - Шикиматный путь
В 1935 году немецкий химик-органик Германн Отто Лауренц Фишер (1888-1960) отметил, что кислоты хинная и шикимовая могут быть метаболитически тесно связанными с бензоидными ароматическими соединениями. Подтверждения этого предположения не существовало до 1950-ых годов.
В 1950 г. американский микробиолог Бернард Дэвис (1916-1994), используя метод отбора с применением пенициллина, получил серию мутантов Escherichia coli, способных расти лишь в такой питательной среде, в которую добавлялись ароматические соединения. Многие мутанты нуждались в фенилаланине, тирозине, триптофане, парааминобензоате и парагидроксибензоате (в следовых количествах). Неожиданно оказалось, что потребность во всех пяти соединениях можно удовлетворить путем добавления шикимовой кислоты (шикимата), в то время считавшимся редким соединением, встречающимся лишь у некоторых растений.
Таким образом, шикимат оказался промежуточным продуктом в процессах биосинтеза трёх ароматических протеиногенных аминокислот, парааминобензоата и других существенных ароматических соединений.
При помощи ауксотрофных мутантов Escherichia coli, Aerobacter aerogenes и Neurospora и с применением изотопно-меченых соединений был прослежен весь путь от углеводных предшественников до первичных и вторичных метаболитов ароматической природы. Важнейшая часть работы была проделана Бернардом Дэвисом в сотрудничестве с Дэвидом Спринсоном (1910-2007) из Колумбийского университета. Значительный вклад в изучение отдельных стадий процесса внесли также австралийцы Франк Гибсон (1923-2008), Джеймс Питтард и многие другие исследователи.
Дэвис и Спринсон установили путь через ДАГФ, долго считавшийся единственным. В 2004 году американский биохимик Роберт Вайт опубликовал результаты своих исследований по рассшифровке пути через ДКФФ. Однако предложенная Вайтом гипотетическая схема биосинтеза ДКФФ в последствии не подтвердилась. В 2006 году Роберт Вайт и Хуимин Ксу сообщили, что им удалось выяснить истинный путь биосинтеза ДКФФ у Methanocaldococcus jannaschii.
Шикиматный путь у бактерий используется исключительно для синтеза ароматических аминокислот. Высшие растения используют эти аминокислоты не только в качестве строительных элементов белка, но и как предшественников вторичных метаболитов [9].
Ферменты шикиматного пути у микроорганизмов находятся в цитоплазме, у растений в пластидах [3].
Шикиматный путь включает в себя 7 каталитических реакций и сочетает обмен углеводов с синтезом ароматических аминокислот. В результате первых четырёх реакций происходит образование шикимовой кислоты, а следующие три реакции обеспечивают ее дальнейшее преобразование в хоризмовую кислоту. Хоризмовая кислота является предшественником многих ароматических соединений, фолиевой кислоты, убихинона [3].
Путь биосинтеза ароматических соединений схож в клетках бактерий, паразитов и растений. Наблюдаемые различия относятся к структуре ферментов и способа их регулирования.
Первым идентифицированным метаболитом данного пути была шикимовая кислота, которая и дала ему данное название. Так как шикиматный путь в дальнейшем приводит к образованию различных ароматических соединений, его часто называют общим путём биосинтеза ароматических соединений. Однако Бентли считает такое название не очень корректным, так как не все ароматические соединения образуются по данному пути [12], [13].
Протекание всех реакций катализируется определёнными ферментами, ферменты являются продуктами соответствующих генов. Гены шикиматного пути у бактерий обозначаются aro (от англ. Aromatic - ароматический), так как ферменты, кодируемые данными генами участвуют в образовании ароматических соединений [12].
Исходными компонентами шикиматного пути являются фосфоенолпируват образующийся при гликолитическом окислении глюкозы, и эритроза-4 - фосфат - промежуточный продукт окисления глюкозы в пентозофосфатном пути. Шикиматный путь начинается с конденсации фосфоенолпирувата и эритроза -4 - фосфата с образованием 3-дезокси-D-арабиногептулозонат-7-фосфата или ДАГФ и заканчивается синтезом хоризмата. Промежуточный продуктом является шикимат. Хоризмат служит общим предшесивенником L - триптофана, L - тирозина, L - фенилаланина и п-аминобензойной кислоты.
1) фосфоенолпируват + эритроза-4 - фосфат ДАГФ + Фн
Данная реакция регулируется 3-дезокси-D-арабиногептулозонат-7-фосфат-синтазой. Этот фермент у E. coli представлен тремя изоферментами: ДAГФС - [Phe], ДAГФС - [Tyr] и ДAГФС - [Trp], которые контролируются соответствующими конечными продуктами. Данные изоферменты кодируются соответственно генами aroG, aroF, aroH [14].
На второй стадии происходит циклизация ДАГФ, что приводит к образованию 3-дегидрохинной кислоты или 3-дегидрохината.
2) ДАГФ 3-дегидрохинат + Фн
Данная реакция регулируется 3-дегидрохинат-синтазой. Для проявления активности данного фермента необходимо присутствие НАД+ и ионов цинка и кобальта. Синтез фермента у E. coli регулирует ген aroB [12].
На следующей стадии происходит дегидратация 3-дегидрохината с образованием 3-дегидрошикимата.
3) 3-дегидрохинат 3-дегидрошикимат + H2O
Данную реакцию катализирует 3-дегидрохинат-дегидротаза или 3-дегидрохинат-дегидрогеназа. У E.coli данный фермент представляет собой димерный белок, кодируемый геном aroD [6].
На четвёртой стадии происходит превращение 3-дегидрошикимата в результате НАДФН+ зависимой реакции в одно из вжнейших промежуточных соединений - шикимовая кислота.
4) 3-дегидрошикимат + НАДФ шикимат
Данная реакция осуществляется шикимат-дегидрогеназой, синтез которой осуществляется у E. coli геном aroE. Концентрация данного фермента в бактериальной клетке очень мала.
На пятой стадии осуществляется фосфолирование шикимовой кислоты по третьему атому углерода и образование шикимат-3-фосфата.
5) шикимат + АТФ шикимат-3-фосфат + АДФ
Данная реакция катализируется шикиматкиназой, кодируемой геном aroL.
На шестой стадии происходит присоединение к фосфолированной шикимовой кислоте молекулы фосфоенолпирувата с образованием 5-енолпирувилшикимат-3-фосфата.
6) шикимат-3-фосфат + ФЕП 5-енолпирувилшикимат-3-фосфат + Фн
Эта реакция катализируется ферментом 5-енолпирувилшикимат-3-фосфат-синтазой, синтез которого контролируется геном aroA. Активность данного фермента ингибируется глифосатом, в результате чего происходит накопление больших количеств шикимата и шикимат-3-фосфата в среде для культивирования. Этот факт был положен в основу методов получения шикимовой кислоты путём экстракции из растительного материала контактирующего с глифосатом, а также при обработке этим реагентом микроорганизмов способных продуцировать шикимовую кслоту, например E. Coli [13].
На последней стадии происходит дефосфолирование и дегитратация 5-енолпирувилшикимат-3-фосфата и образование конечного продукта хоризмата.
7) 5 - енолпирувилшикимат-3-фосфат хоризмат +Фн
Данная реакция осуществляется хоризмат-синтазой, синтез которой детерминируется геном aroC. У растений и E.coli даннай фермент активен при наличии ФМНН2 и в анаэробных условиях [12].
На этой стадии происходит разветвление шикиматного пути. По одному направлению из хоризмовой кислоты образуется антранилат, который является предшественником триптофана и алкалоидов, по другому - префенат - предшественник фенилаланина и тирозина. Также существуют другие пути, которые приводят к образованию антибиотиков, убихинина, салицилата и других соединений в зависимости от вида организма [14].