| Рестриктаза | Последовательность олигонуклеотидов в окрестностях сайта рестрикции | Длина цепи, нт | Процент расщепления олигонуклеотида после инкубации в течение | |
| 2 ч | 20 ч | |||
| BamH I | C GGATCC G CG GGATCC CG CGC GGATCC CGC | >90 >90 | >90 >90 | |
| Bgl II | C AGATCT G GA AGATCT TC GGA AGATCT TCC | >90 >90 | ||
| Cla I | C ATCGAT T G ATCGAT C CC ATCGAT GG CCC ATCGAT GGG | >90 | >90 | |
| EcoR I | G GAATTC C CG GAATTC CG CCG GAATTC CGG | >90 >90 >90 | >90 >90 >90 | |
| Hind III | C AAGCTT G CC AAGCTT GG CCC AAGCTT GGG | |||
| Nhe I | G GCTAGC C CG GCTAGC CG CTA GCTAGC TAG | |||
| Pst I | G CTGCAG C TGCA CTGCAG TGCA |
Таблица II.1 (окончание)
| Рестриктаза | Последовательность олигонуклеотидов в окрестностях сайта рестрикции | Длина цепи, нт | Процент расщепления олигонуклеотида после инкубации в течение | |
| 2 ч | 20 ч | |||
| Pvu I | C CGATCG G AT CGATCG AT TCG CGATCG CGA | |||
| Sac I | C GAGCTC G | |||
| Sac II | G CCGCGG C TCC CCGCGG GGA | >90 | ||
| Sma I | CCCGGG C CCCGGG G CC CCCGGG GG TCC CCCGGG GGA | >90 | ||
| Spe I | G ACTAGT C GG ACTAGT CC CGG ACTAGT CCG CTAG ACTAGT CTAG | >90 >90 | ||
| Sph I | G GCATGC C CAT GCATGC ATG ACAT GCATGC ATGT | |||
| Xba I | C TCTAGA G GC TCTAGA GC TGC TCTAGA GCA CTAG TCTAGA CTAG | >90 | >90 >90 >90 | |
| Xho I | C CTCGAG G CC CTCGAG GG CCG CTCGAG CGG | |||
| Примечание. Курсивом выделены последовательности сайтов рестрикции. |
ДНК-метилазы. Большинство штаммов E. coli содержит два типа ферментов, метилирующих ДНК: dam- и dcm-метилазы. Первая осуществляет перенос метильных групп в N-положение аденина в последовательности GATC. В таком случае многие рестриктазы (например Bcl I, Mbo I или Cla I), в состав сайтов рестрикции которых входит данная метилированная последовательность, перестают расщеплять ДНК по этим сайтам. Аналогичное действие на некоторые рестриктазы, например EcoR II, оказывает и dcm-метилаза, осуществляющая метилирование остатков цитозина по положению С5 в последовательностях CMeCAGG и CMeCTGG. Для того чтобы избежать нежелательного влияния этих метилаз на клонируемые ДНК, в качестве хозяев используют мутантные штаммы E. coli: dam- и dcm-. ДНК-метилазы бактериальных систем рестрикции и модификации применяют для блокирования in vitro соответствующих сайтов рестрикции на исследуемых фрагментах ДНК с целью получения под действием гомологичных рестриктаз фрагментов больших размеров.
ДНК- и РНК-лигазы
Создание фосфодиэфирных связей в одноцепочечных разрывах двухцепочечной ДНК с помощью ДНК-лигаз является наряду с рестрикцией одним из важнейших этапов получения рекомбинантных ДНК in vitro. Наибольшее применение в генно-инженерных исследованиях находит ДНК-лигаза бактериофага Т4. Реакция лигирования протекает в два этапа (рис. II.3). Вначале образуется промежуточный комплекс фермент–АМР (этап 1), после чего остаток АМР переносится на 5’-фосфатную группу концевого нуклеотида в точке разрыва ДНК (этап 2). Образовавшаяся фосфодиэфирная связь гидролизуется во время нуклеофильной атаки 3’-ОН группы соседнего нуклеотида, что приводит к образованию новой фосфодиэфирной связи, восстанавливающей целостность сахаро-фосфатного остова ДНК. Т4-ДНК-лигаза осуществляет соединение фрагментов двухцепочечной ДНК, обладающих комплементарными "липкими" или "тупыми" концами. Как следует из механизма реакции, необходимым условием протекания лигирования является наличие 5’-концевого фосфата и 3'-концевого гидроксила в точках разрыва цепей ДНК. При этом эффективность соединения фрагментов ДНК по "тупым" концам Т4-ДНК-лигазой возрастает в присутствии Т4-РНК-лигазы, которая осуществляет ковалентное соединение 5’-фосфорилированных концов одноцепочечных ДНК или РНК с 3’-ОН группами одноцепочечных нуклеиновых кислот.
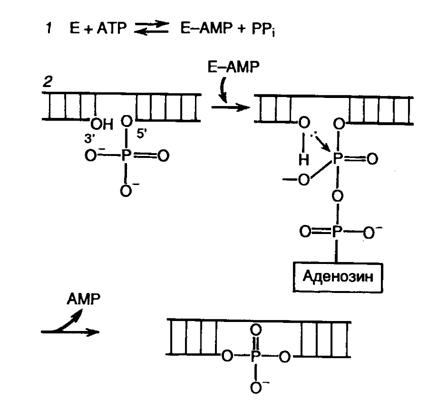
Рис. II.3. Механизм лигирования ДНК Т4-ДНК-лигазой
1 – образование промежуточного комплекса фермент Е–AMP; 2 – образование фосфодиэфирной связи