| ДНК-полимераза | Частота мутаций (на 1 нуклеотид/1 раунд репликации) |
| Pfu | 1,3 10-6 |
| Deep Vent | 2,7 10-6 |
| Vent | 2,8 10-6 |
| Taq | 8,0 10-6 |
| exo(-)Pfu и UITma | 5,0 10-5 |
| Смесь Taq/Pfu или Klentaq/Pfu | ~5 10-6 |
ошибочно спаренных нуклеотидов праймера и ДНК-матрицы одинаково эффективно предотвращают синтез ДНК Taq -полимеразой. По способности направлять синтез ДНК все такие пары 3’-концевого нуклеотида праймера и соответствующего нуклеотида матричной ДНК располагаются в следующий ряд: C–C, A–G, G–A, G–G < A–A < T–C, C–T, T–T << A–C, C–A << G–T, T–G (данные фирмы "Cetus"). При этом наименее благоприятными для продолжения синтеза ДНК являются пары нуклеотидов пурин–пурин и пиримидин–пиримидин.
РНК-зависимые ДНК-полимеразы (обратные транскриптазы, ревертазы). Обратные транскриптазы способны осуществлять синтез ДНК на матрице РНК, полимеризуя четыре дезоксирибонуклеозидтрифосфата, как это имеет место в случае ДНК-зависимых ДНК-полимераз. Обратные транскриптазы, так же как и ДНК-полимеразы функционируют только при наличии затравки. Широко используемая в генной инженерии обратная транскриптаза вируса миелобластоза птиц помимо полимеризующей активности обладает 5’®3’- и 3’®5’-экзорибонуклеазными активностями и расщепляет РНК в ДНК-РНК-гибридах по процессивному механизму. Обратные транскриптазы находят применение в синтезе двухцепочечных ДНК, комплементарных РНК (особенно мРНК), для последующего ее клонирования в плазмидных векторах при получении библиотек (клонотек) кДНК (см. раздел 7.3). Обратные транскриптазы, подобно ДНК-полимеразам, могут быть использованы для введения радиоактивной или флуоресцентной метки в ДНК-зонды в составе соответствующим образом меченных дезоксирибонуклеозидтрифосфатов.
Недавно способность синтезировать ДНК на матрице РНК в определенных условиях была продемонстрирована для термостабильной ДНК-полимеразы Thermus thermophilus. Это позволяет использовать ее для прямого обнаружения специфических РНК в биологических образцах методом ПЦР. Современные модификации такого подхода дают возможность в одной реакционной смеси (и пробирке) синтезировать в реакции обратной транскрипции небольшое число копий амплифицируемого фрагмента ДНК на матрице РНК, которые сразу же используются тем же ферментом в качестве матрицы в обычной ПЦР (one tube PCR).
Другие ферменты
Среди других многочисленных ферментов, используемых в генной инженерии, прежде всего следует упомянуть полинуклеотидкиназы, которые осуществляют перенос g-фосфатных групп ATP на 5’-OH группы ДНК или РНК. Полинуклеотидкиназа бактериофага Т4 широко используется для введения радиоактивной метки в ДНК или РНК с целью получения радиоактивно меченных зондов или секвенирования нуклеиновых кислот.
Терминальная трансфераза из тимуса теленка (терминальная дезоксирибонуклеотидилтрансфераза), осуществляющая последовательное присоединение дезоксирибонуклеозидмонофосфатов из пула дезоксирибонуклеозидтрифосфатов к 3’-OH-группам молекул ДНК, используется для введения радиоактивной метки в составе меченых нуклеотидов в 3’-концы ДНК, а также присоединения к 3’-концам фрагментов ДНК (особенно кДНК) протяженных гомополимерных последовательностей нуклеотидов (коннекторов) для последующего их клонирования.
Щелочные фосфатазы бактерий (BAP) и кишечника теленка (CIAP) катализируют удаление 5’-фосфатных групп ДНК или РНК, а также расщепление макроэргических связей рибо- и дезоксирибонуклеозидтрифосфатов. Их используют при подготовке фрагментов нуклеиновых кислот к введению 5’-концевой радиоактивной метки 32Р, а также для предотвращения лигирования векторных молекул ДНК самих на себя. Как уже упоминалось выше, ДНК-лигаза способна образовывать фосфодиэфирные связи в одноцепочечных разрывах лишь при наличии в них 5'-концевого фосфата. Удаление 5'-концевых фосфатных групп молекул вектора, лианеризованных с помощью одной рестриктазы во время его подготовки для клонирования соответствующего фрагмента ДНК, предотвращает образование кольцевых молекул вектора (без вставки), а также его олигомеров во время лигирования с клонируемой последовательностью. Необходимые для лигирования со вставкой фосфатные группы содержатся в самих клонируемых фрагментах ДНК, а остающиеся в результате неполного лигирования два одноцепочечных разрыва репарируются in vivo после введения вектора со вставкой в бактериальные клетки.
В заключение следует рассмотреть некоторые нуклеазы, часто используемые в генной инженерии. Нуклеазы – это гидролитические ферменты, расщепляющие нуклеиновые кислоты. По механизму расщепления субстратов нуклеазы разделяют на экзо- и эндонуклеазы. Экзонуклеазы осуществляют последовательное отщепление моно- или небольших олигонуклеотидов с концов молекул ДНК или РНК, тогда как эндонуклеазы вносят в молекулы нуклеиновых кислот внутренние разрывы. В частности, к эндонуклеазам относятся многочисленные рестриктазы, рассмотренные выше. Некоторые нуклеазы обладают более широкой специфичностью и могут гидролизовать как РНК, так и ДНК, а также одновременно проявлять эндо- и экзонуклеазную активности. Нуклеаза Bal31 из Alteramonias aspejiana последовательно отщепляет отдельные моно- и олигонуклеотиды с 5’- и 3’-концов двухцепочечных ДНК, укорачивая обе цепи ДНК приблизительно с равной скоростью. При этом нуклеаза Bal31 гидролизует и одноцепочечные ДНК.
Экзонуклеаза III E. coli катализирует последовательное отщепление 5’-нуклеотидов из двухцепочечных ДНК в направлении 3’®5’. Фермент обладает эндонуклеазной активностью по отношению к апуринизированной ДНК, активностью РНКазы H (гидролиз РНК в РНК-ДНК-гибридах) и 3’-фосфатазной активностью.
Экзонуклеаза фага l катализирует последовательное отщепление 5’-мононуклеотидов в двухцепочечных ДНК при наличии в них 5’-концевых фосфатных групп. Ее используют для получения одноцепочечных молекул ДНК с целью их последующего секвенирования.
Нуклеаза S1 из Aspergillus orizae специфически расщепляет одноцепочечные молекулы ДНК с образованием 5’-фосфорилированных моно- и олигонуклеотидов. Те же свойства присущи и нуклеазе золотистой фасоли (mung bean).
Панкреатическая рибонуклеаза A (РНКаза A) обладает активностью эндорибонуклеазы, специфически расщепляющей фосфодиэфирные связи, образованные пиримидиновыми нуклеотидами. Продуктами гидролиза являются 3’-фосфорилированные пиримидиновые мононуклеотиды и олигонуклеотиды, содержащие концевые пиримидин-3’-монофосфаты.
ПанкреатическаядезоксирибонуклеазаI (ДНКаза I) представляет собой эндонуклеазу, гидролизующую как одно-, так и двухцепочечную ДНК с образованием сложной смеси моно- и олигонуклеотидов, содержащих 5’-фосфатные группы. В присутствии ионов Mg2+ ДНКаза I независимо атакует каждую цепь ДНК, при этом места разрывов располагаются статистически вдоль молекулы, а в присутствии ионов Mn2+ расщепляет обе цепи ДНК приблизительно напротив друг друга.
Рассмотренные ферменты не исчерпывают всего списка белков, используемых в генной инженерии. Особенности применения многих из этих ферментов для решения конкретных генно-инженерных задач будут не раз обсуждаться при дальнейшем изложении принципов генной инженерии.
Векторы
Ферменты, описанные в предыдущем разделе, позволяют производить тонкие манипуляции как с протяженными молекулами ДНК, так и с их фрагментами. В частности, с помощью рестриктаз можно с большой точностью разрезать молекулы ДНК, а образовавшиеся в результате фрагменты соединять в любой желаемой последовательности друг с другом, восстанавливая сахаро-фосфатный остов молекулы ДНК с помощью ДНК-лигазы. Однако с использованием только этих ферментов еще нельзя решить одну из основных методических задач молекулярной генетики – выделение любой требуемой нуклеотидной последовательности в чистом виде и в количестве, достаточном для исследования этих последовательностей биохимическими методами. Исключение составляет метод ПЦР, однако его применение ограничивается короткими последовательностями нуклеотидов.
Основная идея, позволяющая решать эту задачу, заключается в том, чтобы присоединить исследуемые фрагменты ДНК к молекуле-переносчику, которая могла бы автономно существовать внутри бактериальных или эукариотических клеток в виде одной или нескольких копий и передаваться вместе со встроенным в нее фрагментом ДНК от одной клетки к другой. Такие молекулы-переносчики фрагментов нуклеиновых кислот были созданы, их называют векторами, и они являются одним из важнейших инструментов генной инженерии.
Идеальная векторная молекула должна обладать несколькими обязательными свойствами. Во-первых, любой вектор должен длительное время существовать в популяции клеток-хозяев, т.е. реплицироваться автономно или вместе с хромосомами клеток. Во-вторых, в любом векторе должны быть биохимические или генетические маркеры, которые позволяли бы обнаруживать его присутствие в клетках. В-третьих, структура векторной молекулы должна допускать встраивание в нее чужеродной последовательности нуклеотидов без нарушения ее функциональной целостности. Для конструирования векторов в генной инженерии используют небольшие молекулы нуклеиновых кислот, способные к автономной репликации в бактериальных и эукариотических клетках – плазмиды, хромосомы вирусов, а также фрагменты хромосом эукариотических клеток.
Плазмидные векторы
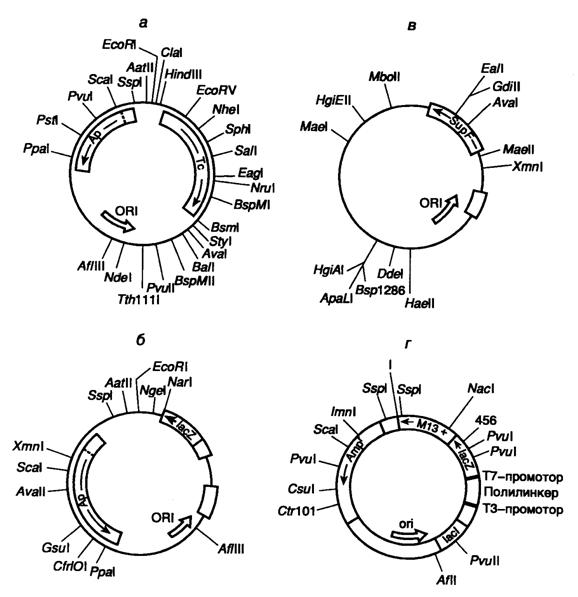
Рис. II.5. Различные векторы для клонирования ДНК и их рестрикционные карты
Обозначены положения уникальных сайтов рестрикции, а также функционально значимых генов
а – векторная плазмида pBR322; б – экспрессирующая векторная плазмида pUC18; в – векторная плазмида pAN7, предназначенная для отбора рекомбинантных клонов с использованием гомологичной рекомбинации; г – многофункциональная векторная плазмида Bluescript
Первые эффективные векторы для клонирования фрагментов чужеродной ДНК, не утратившие своего значения и поныне, были получены с использованием бактериальных плазмид. Большая серия векторных плазмид, обозначенных символом pBR, создана на основе репликона природной плазмиды ColEI, придающей клеткам E. coli устойчивость к колицину путем его объединения с генами устойчивости к антибиотикам. Таким образом, бактериальные клетки, несущие подобные комбинированные плазмиды, приобретали устойчивость к соответствующим антибиотикам, и их было легко отличить от бесплазмидных клеток путем простого посева на питательную среду с антибиотиками. Генетическая карта одного широко распространенного вектора этой серии – pBR322 изображена на рис. II.5, а. Такая плазмида представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной 4363 п.о. Последовательность нуклеотидов pBR322 полностью известна. Плазмида содержит гены устойчивости к тетрациклину (Tc) и ампициллину (Ap), которые были перенесены в плазмиду pBR322 из плазмиды pSC101 и транспозона Tn3 соответственно. Оба этих гена являются селектируемыми генетическими маркерами плазмиды, т.е. позволяют проводить отбор бактериальных клеток с плазмидой pBR322 по их способности к росту на питательных средах в присутствии тетрациклина и(или) ампициллина. Плазмида pBR322 содержит также обеспечивающий ее стабильную репликацию в клетках E. coli участок ДНК, который включает область начала репликации (ori). Характерной чертой плазмиды pBR322, как и любого современного вектора, является наличие в ней нескольких уникальных сайтов рестрикции, обозначенных на генетической карте. Следует иметь в виду, что встраивание в плазмиду клонируемых чужеродных фрагментов ДНК по сайтам рестрикции, расположенным в генах Ар или Tc (например Pst I или BamH I), будет нарушать целостность этих генов и их функциональную активность. В результате происходит утрата бактериальными клетками, содержащими рекомбинантные плазмиды, устойчивости к соответствующим антибиотикам. По такому признаку легко различить бактериальные клетки, не содержащие плазмиды (не растут в присутствии ампициллина и тетрациклина), клетки с плазмидой, не содержащей вставки клонируемой ДНК (растут в присутствии обоих антибиотиков), и клетки с рекомбинантными плазмидами (в зависимости от локализации вставки могут расти на среде только с одним из двух вышеупомянутых антибиотиков). Следовательно, наличие в векторных молекулах селектируемых маркеров резко повышает эффективность клонирования из-за возможности проведения быстрого отбора рекомбинантных плазмид на селективных питательных средах.
Помимо генов устойчивости к антибиотикам в качестве селектируемых маркеров используют и другие гены или их фрагменты. В частности, для этих целей часто применяются гены различных ферментов, присутствие которых в клетках в составе плазмиды обнаруживают по появлению соответствующей ферментативной активности. В часто используемых векторах серии pUC таким селектируемым маркером является 5’-концевая часть гена b‑галактозидазы E. coli – lacZ’ (см. рис. II.5, б). Эта часть гена, находящаяся под контролем lac-промотора, кодирует N-концевую часть b-галактозидазы (так называемый a-пептид), которая путем объединения с недостающей С-концевой частью полипептида без образования пептидной связи восстанавливает ферментативную активность b-галактозидазы. b‑Галактозидаза обладает способностью расщеплять искусственный субстрат Xgal (5-бром-4-хлор-3-индолил-b- D -галактопиранозид) с образованием окрашенного в голубой цвет продукта реакции. В том случае, когда в бактериальных клетках, которые содержат в хромосоме недостающую экспрессирующуюся 3’-концевую часть гена lacZ и выращиваются на среде с Xgal, в результате комплементации a-пептидом вектора появляется активность b-галактозидазы, образованные этими клетками бактериальные колонии окрашиваются в голубой цвет. Уникальные сайты рестрикции для клонирования ДНК локализованы в начале гена b-галактозидазы в составе полилинкера (синтетической последовательности нуклеотидов, содержащей несколько перекрывающихся уникальных сайтов рестрикции), который не нарушает функциональной целостности последовательности нуклеотидов a-пептида. Вставка рекомбинантной ДНК в эти векторы разрывает структурную часть гена b-галактозидазы и инактивирует его, в связи с чем колонии бактерий с подобными рекомбинантными плазмидами, выросшие на питательной среде с Xgal, не окрашены. Поскольку векторы серии pUC одновременно содержат и ген устойчивости к ампициллину, отбор бактерий, несущих рекомбинантные плазмиды, можно проводить одновременно по этим двум маркерам. На питательной среде с ампициллином и Xgal вырастают только бактерии, устойчивые к антибиотику, т.е. содержащие плазмиду pUC, а среди выросших колоний лишь неокрашенные содержат вставку чужеродной ДНК. В качестве селектируемых маркеров в векторных молекулах часто используются гены, присутствие которых может быть обнаружено косвенно по комплементации генетических дефектов бактериальных клеток-хозяев, что делает их жизнеспособными в определенных селективных условиях. Подробнее об одной из таких систем см. в разделе 7.3.3.
За короткий период развития генной инженерии было сконструировано труднообозримое количество векторных плазмид, обеспечивающих конкретные потребности исследователей. Одной из вершин генно-инженерного искусства, прекрасно иллюстрирующей возможности генной инженерии, в настоящее время являются полифункциональные векторы серии Bluescript, полученные фирмой "Stratagene" (США) (см. рис. II.5, г). Вектор Bluescript M13+ представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной около 3 т.п.о. Он включает в себя ген устойчивости к ампициллину Ampr, ген b-галактозидазы lacZ, в N-концевую часть которого встроен полилинкер, содержащий уникальные сайты рестрикции для 21 рестриктазы, промоторно-операторную область lacZ, а также ген lac-репрессора lacI. В результате встраивания клонируемого фрагмента ДНК в полилинкер происходят разрыв кодирующей части гена lacZ и инактивация b-галактозидазы, что, как и в случае вектора pUC18, можно обнаружить по исчезновению окраски колоний бактерий, содержащих этот вектор со вставкой клонированной ДНК. Кроме того, встроенный в полилинкер фрагмент ДНК попадает под контроль промоторно-операторной регуляторной последовательности гена lacZ и в присутствии индуктора IPTG может быть экспрессирован в клетках E. coli. В дополнение к этому полилинкер в векторной плазмиде содержит на одном конце промотор для Т7-, а на другом – для Т3-РНК-полимераз, которые ориентированы навстречу друг другу. Это позволяет транскрибировать любую из цепей клонированного фрагмента ДНК in vitro с помощью той или другой РНК-полимеразы и получать препаративные количества мРНК или же комплементарной ей антисмысловой РНК. Кроме того, вектор Bluescript M13+ обладает межгенной областью (IG) фага f1, родственного фагу M13. Эта область детерминирует все цис- действующие функциональные последовательности нуклеотидов фага, необходимые для репликации его хромосомы и упаковки ее в фаговые частицы. В присутствии фага-помощника M13 происходит преимущественная упаковка образовавшейся в результате репликации одноцепочечной плазмиды в фаговые частицы M13. Одноцепочечная ДНК Bluescript M13+ после очистки может быть использована непосредственно для секвенирования клонированной ДНК или проведения сайт-специфического мутагенеза. Векторы типа Bluescript M13+, способные существовать либо в виде плазмиды, либо в составе фаговых частиц нитевидных бактериофагов, называют фагмидами.