Разложения
Одной из сложных задач кинетики химических процессов является расчёт энергии активации Еакт, то есть определение избыточного количества энергии, которым должна обладать молекула в момент столкновения, чтобы началась химическая реакция. Такие исследования очень трудоёмки и требуют высокой точности эксперимента. В последнее время применяются косвенные методы расчёта, не уступающие по точности прямым расчётным методам.
Так, для расчёта Еакт реакций типа Атв 
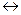 Втв + Сг могут быть использованы кривые дифференциально-термического анализа (ДТА), термогравиметрического (ТГ) и дифференциально-термогравиметрического (ДТГ) методов анализа.
Втв + Сг могут быть использованы кривые дифференциально-термического анализа (ДТА), термогравиметрического (ТГ) и дифференциально-термогравиметрического (ДТГ) методов анализа.
Энергия активации по кривой дифференциально-термического анализа может быть рассчитана по уравнению:
 , (1)
, (1)
где ∆t – изменение температуры, 0С, соответствующее глубине пика ДТА при заданной температуре (между величиной пика и температурой существует пропорциональная зависимость, глубина пика выражается в миллиметрах);
Еакт – энергия активации, кДж/моль, то есть энергия, которую необходимо сообщить молекуле для того, чтобы она вступила в реакцию;
R – универсальная газовая постоянная, Дж/моль·К;
c' – константа.
По кривой термогравиметрического анализа энергия активации рассчитывается по уравнению:
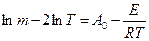 , (2)
, (2)
где m – уменьшение массы вещества, определяемое по ТГ – кривой и обычно выражаемое в % или мг. Вследствие того, что между уменьшением массы вещества и глубиной ТГ – кривой существует пропорциональная зависимость, глубина ТГ – кривой выражается в миллиметрах. Глубина ТГ – кривой при температуре t 0С определяется перпендикуляром, опущенным из точки на ТГ – кривой, соответствующей t 0С, на базисную линию. Базисная линия ТГ – кривой – это линия, проходящая через точку нулевого превращения параллельно оси абсцисс;
А0 – константа.
По кривой дифференциально-термогравиметрического анализа энергия активации рассчитывается по уравнению:
 , (3)
, (3)
где υm – скорость уменьшения массы исходного вещества, мг/мин или мг/0С. Существующая пропорциональная зависимость между скоростью уменьшения массы вещества и глубиной ДТГ - кривой позволяет для удобства расчёта выразить глубину ДТГ - кривой в миллиметрах. Глубина ДТГ - кривой при температуре t 0С представляет собой перпендикуляр, опущенный из точки на ДТГ – кривой, соответствующей температуре t 0С, на базисную линию; В – константа; Т – температура в градусах Кельвина (Т = t 0С + 273 0С).
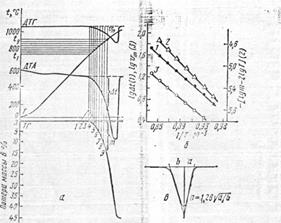
Рис. 9 – Дериватограмма СаСО3 (а); графики расчёта энергии активации процесса диссоциации (б); схема определения порядка химической реакции по Киссингеру (в):
1 – по ДТА; 2 – по ТГ; 3 - по ДТГ
Для получения более точных результатов необходимо соблюдать следующие условия: кривые ДТА и ДТГ после окончания фазовых превращений должны выходить на базисную линию; недопустимо наложение на эффект, принимаемый для расчёта энергии активации других термических эффектов; расчёт необходимо проводить по начальной ветви эффекта на участке, отвечающем степени превращения α < 0,4ч0,5.
Пример расчёта энергии активации процесса диссоциации СаСО3.
Строится дериватограмма (рисунок 9), отражающая процесс диссоциации СаСО3. Расчёт проводится в интервале температур 760 – 920 0С, что соответствует степени превращения α < 0,35. Последовательность расчёта.
1. Из дериватограммы следует, что диссоциация СаСО3 начинается при 760 0С (определяется по кривой ДТГ). Эта температура взята в качестве исходной точки. Далее через определённые интервалы температуры (например, через 20 0С) на кривой Т отмечается ряд точек. Последняя точка соответствует произвольно взятой температуре 920 0С. С температурной кривой точки переносятся на три кривые: ДТА, ТГ и ДТГ.
2. Далее переводятся 0С в К (Т = t 0С + 273) и для каждой точки определяется величина 1/Т · 10–3.
3. Находятся величины, необходимые для расчёта энергии активации.
По кривой ДТА энергия активации определяется следующим образом:
а) с помощью циркуля и линейки ∆t замеряется и выражается в мм;
б) находится ln ∆t, и по этим данным строится график в координатах ln ∆t – 1/Т.
График представляет собой прямую линию, тангенс угла наклона которой (tg α) показывает величину энергии активации процесса диссоциации СаСО3.
По дифференциальной кривой (ДТГ) энергия активации определяется следующим образом:
а) υm – замеряется с помощью циркуля или линейки и выражается в мм;
б) вычисляется lg υm;
в) по данным таблицы строится график в координатах lg υm - 1/Т · 10-3 (рисунок 1).
Полученный график представляет собой прямую линию, тангенс угла наклона которой показывает величину энергии активации процесса диссоциации СаСО3.
По термогравиметрической кривой (ТГ) энергия активации определяется следующим образом:
а) m – замеряется с помощью циркуля и линейки (выражается в мм);
б) определяется ln m и 2 lgТ;
в) находится разность (ln m – 2 lgТ).
По расчётным данным строится график в координатах (ln m – 2 lgТ) – величина 1/Т · 10-3.
Тангенс угла наклона полученной прямой линии отвечает величине энергии активации процесса диссоциации СаСО3.
Из литературы [1] известно, что значения энергии активации процесса диссоциации, полученные различными методами, находятся в пределах 146-203 кДж/моль.
Лабораторная работа №
ОПРЕДЕЛЕНИЕ ЭНЕРГИИ АКТИВАЦИИ ДИССОЦИАЦИИ НЕОРГАНИЧЕСКИХ ОКИСЛИТЕЛЕЙ
Цель работы. Изучение кинетики термического разложения карбоната кальция (СаСОз) и определение энергии активации процесса.
Приборы и реактивы. Порошкообразный карбонат кальция, фарфоровые лодочки, весы аналитические …, весы ВЛТК-1100, печь «Тулячка 10П», дериватограф.
Сущность работы.
В настоящее время разработано много методов изучения кинетики термического разложения твёрдых веществ [1, 2]. Однако самым простым и доступным является метод термогравиметрии (ТГ) - весовой способ изучения скорости термического разложения твердых веществ, заключающийся в периодическом или непрерывном изучении изменения массы твердого вещества по ходу его разложения.
В данной работе взвешивание проводят периодически с перерывами по ходу реакции. Скорость процесса определяют по изменению массы вещества во времени, а именно, по убыли массы вещества m. Энергию активации процесса определяют графическим путём по заданным температурам нагрева Т и полученным при этих температурах значениям убыли массы m исследуемого вещества [1].
Порядок выполнения работы.
Исследования проводят в интервале температур 400 - 600°С.
Сначала определяют массу фарфоровых лодочек на весах ВЛТК 1100 с точностью до 0,01 г, затем на аналитических весах с точностью до 0,0001 г. На каждую заданную температуру Т берут две лодочки. Навески исследуемого вещества массой 1 г, предварительно взятые на весах ВЛТК 1100, засыпают в фарфоровые лодочки и на аналитических весах определяют общую массу лодочек с веществом. После этого две лодочки с веществом помещают в нагретую до первой заданной температуры печь и выдерживают в ней в течение 20 минут. По истечении заданного времени лодочки с веществом осторожно вынимают из печи, ставят на керамическую подставку, охлаждают на воздухе до комнатной температуры и снова взвешивают на аналитических весах. Затем температуру в печи снова повышают до второй заданной температуры. При её достижении в печь помещают следующие две лодочки с веществом и также проводят их нагрев в течение 20 минут. В дальнейшем все операции повторяют.
Скорость процесса определяют по изменению массы вещества (по убыли массы m) во времени.
Энергию активации определяют по уравнению (3).
Для удобства построения уравнение (3) преобразуют в выражение вида у = А - В·х, принимая (ln m – 2 ln T) за у, 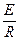 за константу В,
за константу В,  за х. По полученным данным строят график прямой линии в координатах (ln m – 2 ln T) - 1/Т·10-3, тангенс угла наклона которой покажет величину энергии активации.
за х. По полученным данным строят график прямой линии в координатах (ln m – 2 ln T) - 1/Т·10-3, тангенс угла наклона которой покажет величину энергии активации.
Все расчётные и экспериментальные данные, записанные в системе СИ, сводят в таблицу 1.
Таблица 1 – Экспериментальные и расчётные данные
| Расчётная и измеряемая величина | |||||
| t, 0С | |||||
| Т, К | |||||
| 1/Т·10-3 | |||||
| m, % | |||||
| ln m | |||||
| 2 ln T | |||||
| (ln m – 2 ln T) |
Значение энергии активации, полученное в данной работе, сравнивается со значениями, взятыми из литературы [1]. Большие значения энергии активации свидетельствуют о резком изменении скорости взаимодействия с изменением температуры, а малые характеризуют сравнительную нечувствительность скорости процесса к изменению температуры.