Длина связи C-C в бензоле (0,139 нм) лежит между длиной одинарной связи (0,154 нм) и длиной двойной связи (0,134 нм).
р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних р-орбиталей, расположенных перпендикулярно плоскости, проходящей через бензольное кольцо. В результате перекрывания происходит их делокализация с образованием единого циклического -электронного облака, находящегося над и под плоскостью кольца в виде двух торов (тор – это предмет имеющий форму бублика).

Критерии ароматичности
1. Атомы в sp2-гибридизованном состоянии образуют плоскую циклическую
систему.
2. Сопряжение охватывает весь цикл, в цикле нет разрывов сопряжения.
3. Правило Хюккеля. Число сопряжѐнных p-электронов (N) в замкнутой
системе сопряженных связей равно 4n+2.
N = 4n + 2
N – чиcло p-электронов сопряжѐнных в цикле.
n – целое число 0,1,2,3….∞
Правило Хюккеля приложимо также и углеводородам с конденсированными
циклами. Рассмотрим нафталин.

Молекула нафталина плоская, число сопряжѐнных p-электронов равно 10.
10 = 4n + 2, следовательно, n = 2.
Отсюда следует, что нафталин является ароматическим соединением.
Нафталин - твердое кристаллическое вещество с характерным запахом. В воде не растворяется, но хорошо растворим в бензоле, эфире, спирте, хлороформе. Нафталин по химическим свойствам сходен с бензолом: легко нитруется, сульфируется, взаимодействует с галогенами. Отличается от бензола тем, что ещё легче вступает в реакции. Нафталин получают из каменноугольной смолы. Также нафталин можно выделять из тяжёлой смолы пиролиза (закалочное масло), которая применяется в процессе пиролиза на этиленовых установках. Еще одним способом промышленного получения нафталина является деалкилирование его алкилпроизводных. Важное сырьё химической промышленности: применяется для синтеза фталевого ангидрида, тетралина, декалина, разнообразных производных нафталина.

Производные нафталина применяют для получения красителей и взрывчатых веществ, в медицине, как инсектицид моли в быту.
Крупные монокристаллы применяются в качестве сцинтилляторов для регистрации ионизирующих излучений.
Может использоваться для создания синтетических аналогов каннабиноидов.
Антраце́н — бесцветные кристаллы. Нерастворим в воде, растворим в ацетонитриле и ацетоне, при нагревании растворим в бензоле. По химическим свойствам сходен с нафталином (легко нитруется, сульфируется и т. д.), но отличается от него тем, что легче вступает в реакции присоединения и окисления.

Антрацен может фотодимеризоваться под действием УФ излучения. Это приводит к существенному изменению свойств вещества.
Антрацен — сырьё для получения антрахинона, многочисленных красителей, например ализарина. В виде кристаллов применяется как сцинтиллятор.
Фенантрен — трициклический ароматический углеводород.

Фенантрен представляет собой блестящие бесцветные кристаллы. Не растворяется в воде, растворяется в органических растворителях (диэтиловом эфире, бензоле, хлороформе, метаноле, уксусной кислоте). Растворы фенантрена флуоресцируют голубым цветом.
По химическим свойствам напоминает нафталин:
· при действии хлора и брома образует соответствующие 9,10-дигалогенфенантрены
· нитруется с образованием 9-, 1- и 3-нитрофенантренов
· сульфируется до 2-, 3- и 9-фенантренсульфокислот
· восстанавливается натрием в амиловом спирте до 9,10-дигидрофенантрена и далее до тетрантрена
· окисляется до фенантрен-9,10-хинона
Содержится в каменноугольной смоле вместе со своим линейным изомером антраценом. Производные фенантрена широко распространены в живой природе (стероиды, алкалоиды группы морфина).
Фенантрен применяется при производстве красителей. Является стабилизатором взрывчатых веществ.
Бензпире́н — ароматическое соединение, представитель семейства полициклических углеводородов, вещество первого класса опасности. Образуется при сгорании углеводородного жидкого, твёрдого и газообразного топлива. В чистом виде представляет собой жёлтые пластинки и иглы, легко расслаивающиеся на более мелкие. Хорошо растворим в неполярных органических растворителях, бензоле, толуоле, ксилоле, ограниченно растворим в полярных, практически нерастворим в воде.

В качестве примеров небензоидных ароматических систем можно привести циклопропенилий-катион I (2π-электронная система), циклопентадиенил-анион II (6π-электронная система), циклогептатриенил-катион III (6π-электронная система), циклооктатетраенил-дианион IV (10π-электронная система)


Небензоидные ароматические соединения обладают заметной устойчивостью, которая обусловлена их ароматическими свойствами.
Галогенирование

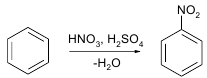
Нитрование
Сульфирование

Алкилирование

Ацилирование

Активирующие заместители – те, что могут способствовать реакции замещения. дезактивирующие заместители – те, что могут замедлять скорость химической реакции. По ориентирующему и активирующему/дезактивирующему действию заместители можно разделить на 3 группы:
· Заместители первого рода: направляют электрофильное замещение в орто
и пара-положения и активируют реакцию – она протекает легче, чем с
незамещѐнным бензолом.
Эти заместители являются электронодонорами (алкильные группы, OH,
NH2, CH3O,)
· Галогены. Направляют электрофильное замещение в орто и пара положения и дезактивируют реакцию (F, Cl, Br, I).
· Заместители второго рода: направляют электрофильное замещение в
мета-положения и дезактивируют реакцию – она протекает труднее, чем с
незамещѐнным бензолом.
Эти заместители являются электроноакцепторами (COOH, CHO, CONH2,
SO3H, NO2)




10) Простые эфиры - органические вещества, имеющие формулу R-O-R', где R и R' — углеводородные радикалы.
Номенклатура

Классификация
· простые эфиры с открытой цепью;
· циклические;
· насыщенные;
· ненасыщенные;
· ароматические и т. д.
Физические свойства простых эфиров. Неспособность молекул простых эфиров образовывать водородные связи делает эти соединения более легколетучими по сравнению со спиртами с близкой молекулярной массой. В смесях с оксисодержащими соединениями, в частности, с водой, простые эфиры образуют водородные связи за счет атома кислорода как донора пары электронов, поэтому низшие эфиры ограниченно растворимы в воде. Циклические простые эфиры, имея более доступный для сольватации атом кислорода, образуют более прочные водородные связи, поэтому они хорошо растворимы в воде
Органические гидропероксиды — соединения состава ROOH, содержащие пероксидную группу O−O и являющиеся органическими производными пероксида водорода, в молекуле которого один из атомов водорода замещён на углеводородный радикал R. Получение: