1. Кондуктометрическое титрование проводят в соответствии с пунктом 14.2.1.3, приливая титрант раствор ЭДТА по 0,5 см3 .
2. Результаты измерений записывают в таблицу 14.1.
3. Строят кривую титрования в координатах  и дифференциальную кривую титрования в координатах
и дифференциальную кривую титрования в координатах
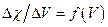 .
.
4. Находят объем раствора ЭДТА, израсходованный на титрование и выполняют расчет содержания никеля (II) и кальция в испытуемом образце в граммах по известной формуле с учетом разбавления.
Определение солесодержания вод скважин.
Определение солесодержания основано на кондуктометрическом определении концентрации протонов, выделившихся при пропускании солесодержащих вод через катионообменную колонку.
Приборы и реактивы:
1. Кондуктометр КП – 001.
2. Магнитная мешалка.
3. Стакан вместимостью 250 см3.
4. Мерная колба вместимостью 250 см3 – 7 шт.
5. Колонка (диаметр 15мм, длина 300 мм), содержащая 10 г катионообменника КУ-1 в Н – форме.
6. Хлороводородная кислота, раствор  моль/дм3 .
моль/дм3 .
7. Хлорид натрия, раствор 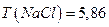 мг/дм3 .
мг/дм3 .
8. Пипетка вместимостью 2 см3.
9. Мерный цилиндр вместимостью 200 см3.
10. Испытуемый образец воды.
Ход работы:
Градуировка датчика (составление таблиц)
1. Разбавлением исходного раствора  готовят 7 стандартных растворов с концентрацией 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3 по 250 см3 каждого.
готовят 7 стандартных растворов с концентрацией 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3 по 250 см3 каждого.
2. К 200 см3 первого стандартного раствора добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
3. Полученный раствор помещают в стакан и опускают в него кондуктометрический датчик. Раствор должен полностью покрывать рабочую часть датчика.
4. Нажимают кнопку включения на измерительном преобразователе кондуктометра. Заносят значение удельной электропроводности раствора в таблицу 14.2.
5. Аналогично пропускают через катионообменник и измеряют удельную электропроводность для всех 7 стандартных растворов.
6. Строят график зависимости удельной электропроводности 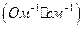 от солесодержания (мг/дм3).
от солесодержания (мг/дм3).
Данные для построения градуировочного графика.
Таблица 14.2
| № стандарта | Удельная электропроводность 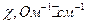
| Солесодержание, мг/дм3 |
Контрольная задача. Определение солесодержания испытуемого образца воды
1. К 200 см3 испытуемого образца воды добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
2. Измеряют удельную электропроводность полученного раствора по пункту 14.2.3.1 и значение заносят в таблицу 14.2.
3. Находят солесодержание по предварительно составленным таблицам или графику.
4. Рассчитывают солесодержание по формуле:
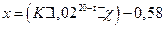
где K- коэффициент датчика, определяемый как отношение солесодержания к удельной электропроводности в любой точке графика;
t – температура пробы, оС;
c - удельная электропроводность,  .
.
Вопросы для самоконтроля.
1. В чем различие прямой и косвенной кондуктометрии? Какой метод более селективен? Почему?
2. В каком современнном методе анализа используют кондуктометрические детекторы?
3. Электропроводность раствора азотной кислоты, как показали соответствующие измерения, составляет 0,02273 см. Константа ячейки, в которой проводили измерения, была определена в специальном эксперименте. Рассчитайте концентрацию азотной кислоты в растворе, если константа ячейки равна 0,0053 м-1.
4. Растворимость  в воде при
в воде при 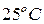 и давлении
и давлении  1 атм составляет 1,45 г/дм3. Используя соответствующие величины предельной подвижности ионов и удельной электропроводности воды, находящейся в равновесии с воздухом, рассчитайте степень диссоциации диоксида углерода в воде при
1 атм составляет 1,45 г/дм3. Используя соответствующие величины предельной подвижности ионов и удельной электропроводности воды, находящейся в равновесии с воздухом, рассчитайте степень диссоциации диоксида углерода в воде при 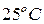 . Мольная доля
. Мольная доля  в сухом воздухе равна 0,000314.
в сухом воздухе равна 0,000314.
5. Кондуктометрическое титрование 10 см3 0,01 моль/дм3 раствора 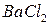 проводилось 0,01 моль/дм3 стандартным водным раствором
проводилось 0,01 моль/дм3 стандартным водным раствором  . Рассчитайте удельную электропроводность раствора а) перед началом титрования до добавления серной кислоты, б) в точке эквивалентности и в) после добавления к раствору
. Рассчитайте удельную электропроводность раствора а) перед началом титрования до добавления серной кислоты, б) в точке эквивалентности и в) после добавления к раствору 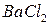 вдвое большего по сравнению с стехиометрическим количеством
вдвое большего по сравнению с стехиометрическим количеством  . Суммарным ионным эффектом можно пренебречь. Обсудите, насколько целесообразно такое титрование.
. Суммарным ионным эффектом можно пренебречь. Обсудите, насколько целесообразно такое титрование.
6. Произведение растворимости сульфата свинца (II) равно приблизительно 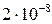 моль2/дм6. Рассчитайте удельную электропроводность насыщенного раствора сульфата свинца (II), полагая, что при нейтральном рН ионы существуют в растворе в виде простых ионов.
моль2/дм6. Рассчитайте удельную электропроводность насыщенного раствора сульфата свинца (II), полагая, что при нейтральном рН ионы существуют в растворе в виде простых ионов.