1. Испытуемый раствор переносят в мерную колбу объемом 100 см3 и доводят объем до метки дистиллированной водой.
2. В катодное пространство ячейки помещают 30 см3 раствора фонового электролита и доводят объем раствора до 150 см3 дистиллированной водой.
3. Заполняют анодную камеру раствором фонового электролита.
4. Опускают генераторный и индикаторные электроды в катодное пространство, а вспомогательный – в анодное простраство титрационной ячейки и закрепляют таким образом, чтобы все электроды были погружены в раствор на 1 см.
5. Заполняют соединительный мостик раствором хлорида калия и помещают один его конец в анодную камеру, а другой - в катодное пространство.
6. Для работы источника постоянного тока в режиме стабилизации тока устанавливают кодовый переключатель выходного тока в положение, соответствующее 2-50 мА, а переключатель напряжения в положение 299В.
7. На индикаторные электроды подают постоянное напряжение (порядка 0,01В). Фиксируют силу тока в индикаторной цепи.
13.2.3.2. Контрольная задача Определение содержания ионов  .
.
1. Аликвотную часть испытуемого раствора (например, 10 см3) из бюретки переносят в катодное пространство ячейки и включают мешалку. Записывают значение силы тока в индикаторной цепи в таблицу 13.4.
Данные для определения точки эквивалентности.
Таблица 13.4.
| № точки | Время, сек | Ток в индикаторной цепи, mA |
2. Одновременно включают секундомер и тумблер ВКЛ источника постоянного тока. Фиксируют с помощью миллиамперметра точное значение тока генерации.
3. Во время электролиза записывают значения силы тока в индикаторной цепи через каждые 10 секунд.
4. Строят кривые титрования в координатах 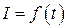 силы тока в индикаторной цепи от времени. Определяют время электролиза до точки эквивалентности.
силы тока в индикаторной цепи от времени. Определяют время электролиза до точки эквивалентности.
5. Проводят многократное (3-5 раз) титрование различных по объему (от 2 до 5 см3) порций испытуемого раствора. Результаты заносят в таблицу 13.4.
Данные кулонометрического титрования.
Таблица 13.4.
| Объем раствора, см3 | Генерационный ток, мА | Время электролиза, сек | Найдено ионов  , мг , мг
|
6. Находят конечную точку титрования и рассчитывают содержание иона цинка в мг в каждой аликвоте по формуле:
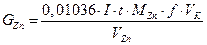
где 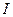 - генерационный ток, А;
- генерационный ток, А;
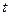 – время генерации, сек;
– время генерации, сек;
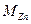 – атомная масса
– атомная масса 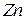 , г/моль;
, г/моль;
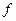 – фактор эквивалентности;
– фактор эквивалентности;
 – объем мерной колбы, см 3;
– объем мерной колбы, см 3;
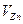 - объем аликвоты испытуемого раствора, см3.
- объем аликвоты испытуемого раствора, см3.
7. Находят концентрацию иона цинка для каждого опыта и среднее значение концентрации иона цинка в анализируемом растворе.
13.2.4. Определение ионов  .
.
Потенциометрическое определение ионов  основано на электроокислении в кислых растворах до
основано на электроокислении в кислых растворах до  при контролируемом потенциале платинового рабочего электрода (+0,95 В относительно хлорсеребряного электрода сравнения):
при контролируемом потенциале платинового рабочего электрода (+0,95 В относительно хлорсеребряного электрода сравнения):
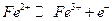 на аноде.
на аноде.
Для определения рабочего потенциала предварительно снимают поляризационные кривые (зависимость ток-потенциал) в растворе фона в отсутствие и в присутствии анализируемого вещества. По поляризационной кривой находят область потенциалов, в которой достигается предельный ток определяемого вещества. Потенциал рабочего электрода выбирают в этой области (в середине площадки предельного тока).
Приборы и реактивы
1. Установка для кулонометрии в потенциостатическом режиме.
2. Генераторный электрод – пластина из платины размером 1х1 см.
3. Генераторный электрод – платиновая сетка.
4. Вспомогательный электрод – стальной стержень.
5. Хлорсеребряный электрод сравнения.
6. Магнитная мешалка.
7. Мерная колба вместимостью 100 см3.
8. Мерный цилиндр вместимостью 50 см3.
9. Пипетка вместимостью 2 см3.
10. Раствор серной кислоты, 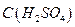 = 1моль/дм3.
= 1моль/дм3.
11. Cульфат железа (II), 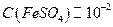 моль/дм3.
моль/дм3.
Ход работы