Метод основан на пропорциональной зависимости между концентрацией сульфатов в сильнокислом растворе и временем 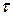 , через которое достигается заданная оптическая плотность суспензии малорастворимого сульфата бария.
, через которое достигается заданная оптическая плотность суспензии малорастворимого сульфата бария.
Приборы и реактивы:
1. Фотоэлектроколориметр КФК-2;
2. Рабочий раствор сульфата натрия,  = 0,47 мг/см3. Получают разбавлением в 10 раз раствора
= 0,47 мг/см3. Получают разбавлением в 10 раз раствора  моль/дм3, приготовленного из фиксанала.
моль/дм3, приготовленного из фиксанала.
3. Хлорид бария, раствор в 0,1 М  , w
, w  = 30%;
= 30%;
4. Хлороводородная кислота,х.ч.,  = 4 моль/дм3, (
= 4 моль/дм3, ( = 1,17 г/см3);
= 1,17 г/см3);
5. Мерные колбы вместимостью 100 см3, 7 шт.;
6. Градуированная пипетка вмес тимостью 10 см3 , 1 шт.;
7. Градуированная пипетка вместимостью 5 см3 , 1 шт.;
8. Мерный цилиндр вместимостью 50 см3 , 1 шт.
Ход работы:
10.2.2.1. Приготовление стандартных растворов и раствора сравнения:
Готовят 6 стандартных растворов, содержащих 2,9; 3,8; 4,8; 5,8; 6,7 и 7,2 мг  в 100 см3 раствора.
в 100 см3 раствора.
Для этого в мерные колбы вместимостью 100 см3 вносят 6; 8; 10; 12; 14 и 15 см3 рабочего раствора 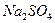 .
.
В каждую колбу приливают по 50 см3 раствора  , разбавляют до метки дистиллированной воды и перемешивают.
, разбавляют до метки дистиллированной воды и перемешивают.
10.2.2.2. Построение градуировочного графика:
В первый световой пучок фотоэлектроколориметра помещают кювету с анализируемым раствором, налитым точно до риски, в левый - кювету с дистиллированной водой.
С помощью оптического клина устанавливают оптическое равновесие при А = 0,0 на правом барабане, затем переводят значение оптической плотности на А = 0,3 и в правую кювету из пипетки добавляют 3 см3 хлорида бария. Одновременно включают секундомер.
Когда стрелка гальванометра достигнет нулевого положения, секундомер выключают и записывают время протекания реакции  в секундах. Результаты измерений заносят в таблицу 10.2.
в секундах. Результаты измерений заносят в таблицу 10.2.
По данным строят градуировочный график, откладывая по оси ординат значение скорости образования сульфата бария в 0,3/  (
( ), а по оси абсцисс концентрацию
), а по оси абсцисс концентрацию  (мг/см3).
(мг/см3).
Данные для построения градуировочного графика.
Таблица 10.2
| № стандарта | Т( ), мг/см3 ), мг/см3
|  , сек , сек
| 0,3/  , сек-1 , сек-1
|
10.2.2.3. Контрольная задача. Определение содержания  в анализируемом растворе.
в анализируемом растворе.
Пробу анализируемого раствора переносят в мерную колбу, вместимостью 100 см3, приливают по 50 см3 раствора  , доводят до метки дистиллированной водой и тщательно перемешивают.
, доводят до метки дистиллированной водой и тщательно перемешивают.
Действуя также, как и при построении градуировочного графика по пункту 10.2.2.2), измеряют время протекания реакции.
Пользуясь градуировочным графиком, находят концентрацию  в исследуемом растворе.
в исследуемом растворе.
Вопросы для самоконтроля
1. В чем заключается суть и отличие методов турбидиметрии и нефелометрии?
2. Приведите примеры применения методов нефелометрии и турбидиметрии в химическом анализе. Перечислите недостатки и достоинства этих металлов.
3. Напишите уравнение Кубелки-Мунка и перечислите следствия, вытекающие из него при измерении спектров, связанных с поглощением света.
4. Перечислите факторы, влияющие на диффузное отражение, погрешности в спектроскопии диффузного отражения. Как измеряют спектры диффузного отражения слабоокрашенных образцов?
5. Перечислите основные достоинства и недостатки метода оптико-акустической спектроскопии в химическом анализе.
Рефрактометрия
Цель и задачи работы
Изучение работы рефрактометра, овладение навыками практического применения рефрактометрического метода анализа.
Программа работы