Важнейшими факторами, определяющими устойчивость раствора тиосульфата, являются значения 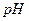 , присутствие микроорганизмов, концентрация раствора, присутствие атмосферного кислорода, примесей ионов тяжелых металлов (катализаторов окисления тиосульфата кислородом воздуха), воздействие прямого солнечного света.
, присутствие микроорганизмов, концентрация раствора, присутствие атмосферного кислорода, примесей ионов тяжелых металлов (катализаторов окисления тиосульфата кислородом воздуха), воздействие прямого солнечного света.
Первичными стандартами для растворов  могут быть окислители:
могут быть окислители: 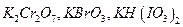 , выделяющие при взаимодействии с избытком иодид-ионов эквивалентное количество иода, который титруют стандартизируемым раствором тиосульфата. Способ стандартизации бихроматом калия основан на реакциях:
, выделяющие при взаимодействии с избытком иодид-ионов эквивалентное количество иода, который титруют стандартизируемым раствором тиосульфата. Способ стандартизации бихроматом калия основан на реакциях:
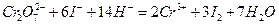

Ход работы:
1. В коническую колбу для титрования переносят пипеткой аликвотную часть раствора установочного вещества  , добавляют 10 см3 раствора
, добавляют 10 см3 раствора  и 1 г кристаллического
и 1 г кристаллического  (или соответствующий объем его концентрированного раствора).
(или соответствующий объем его концентрированного раствора).
2. Колбы закрывают стеклянными пробками, содержимое перемешивают, дают постоять 5—10 мин в темном месте пока не завершится реакция.
3. Выделившийся  титруют раствором
титруют раствором  до тех пор, пока окраска не станет слабо-желтой.
до тех пор, пока окраска не станет слабо-желтой.
4. Затем титруемый раствор разбавляют водой приблизительно в 2 раза, добавляют индикатор крахмал и продолжают титрование до перехода окраски раствора из синей в светло-зеленую (ионы  ).
).
5. Проводят 3-5 титрований. Результаты заносят в таблицу 6.1:
Результаты стандартизации раствора тиосульфата натрия.
Таблица 6.1.
| № п/п | V(K2Сr2О7), См3 | С(1/6K2Сr2О7), моль/дм3 | V(Na2S2О3), см3 | С(1/1Na2S2О3), моль/дм3 | Т(Na2S2О3), г/см3 |
Используя средний объем титранта, затраченного на титрование, рассчитывают характеристики раствора  . При расчете учитывают, что в точке эквивалентности число молей эквивалента титруемого вещества и титранта равны:
. При расчете учитывают, что в точке эквивалентности число молей эквивалента титруемого вещества и титранта равны: 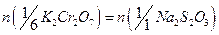 .
.
Контрольная задача:Определение меди (II).
Определение основано на взаимодействии ионов  и
и  и последующем титровании образовавшегося в эквивалентном количестве
и последующем титровании образовавшегося в эквивалентном количестве  стандартным раствором
стандартным раствором 
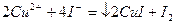

Ход определения:
1. Исследуемый раствор, содержащий ионы  , в мерной колбе разбавляют дистиллированной водой до метки и тщательно перемешивают.
, в мерной колбе разбавляют дистиллированной водой до метки и тщательно перемешивают.
2. Аликвотные части анализируемого раствора пипеткой переносят в 3 конические колбы для титрования, добавляют по 2—3 г твердого 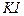 и 5 см3 раствора
и 5 см3 раствора  .
.
3. Колбы закрывают стеклянными пробками, которые перед титрованием обмывают дистиллированной водой и оставляют на 10-15 мин в темном месте.
4. Выделившийся  после завершения реакции титруют стандартным раствором
после завершения реакции титруют стандартным раствором  в присутствии крахмала.
в присутствии крахмала.
5. Результаты заносят в таблицу 6.2:
Результаты титрования раствора, содержащего ионы  ,
,
раствором тиосульфата натрия.
Таблица 6.2.
| № п/п | V(Na2S2О3), см3 | С(1/1Na2S2О3), моль/дм3 | V(Cu2+), см3 | С(1/1 Cu2+), моль/дм3 | Т(Cu2+), г/см3 |
6. Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание меди (II), учитывая, что в точке эквивалентности  . Содержание
. Содержание  (в г) вычисляют по формулам:
(в г) вычисляют по формулам:


где  ,
,  — вместимость колбы и пипетки соответственно.
— вместимость колбы и пипетки соответственно.
Вопросы для самоподготовки.
1. Почему иодид калия нельзя использовать для прямого титрования меди?
2. Напишите реакции, протекающие при титриметрическом определении:
а) белильной извести, нитратов, железа (III), пероксида водорода, брома, хлора, хрома (VI), хрома (III), сульфидов, сульфитов иодометрически; б) пероксида водорода, нитратов, диоксида марганца, кальция (II), марганца (II) перманганатометрически.
3. Каковы особенности приготовления стандартного раствора  и условия его хранения?
и условия его хранения?
4. Почему фактор эквивалентности  различен при проведении реакций в кислой, щелочной или нейтральной средах? Рассчитайте его значение в этих средах.
различен при проведении реакций в кислой, щелочной или нейтральной средах? Рассчитайте его значение в этих средах.
5. Какие вещества применяют для установки характеристик раствора  ? Какие требования к ним предъявляют?
? Какие требования к ним предъявляют?
6. Как определить перманганатометрическим методом вещества, не обладающие окислительно-восстановительными свойствами, например  ?
?
7. Как определить окислители перманганатометрическим методом:  ?
?
8. Вычислите молярную концентрацию эквивалентов раствора  с Т= 0,005815 г/мл при использовании его в качестве титра в кислой и нейтральной средах.
с Т= 0,005815 г/мл при использовании его в качестве титра в кислой и нейтральной средах.
9. В каких условиях проводят определение ионов  при отсутствии хлорид-ионов перманганатометрическим методом?
при отсутствии хлорид-ионов перманганатометрическим методом?
10. В мерной колбе вместимостью 100 мл приготовлен раствор, содержащий 0,6384 г  . Какой объём 0,09349
. Какой объём 0,09349  раствора
раствора  будет израсходован на титрование 10,00 мл раствора оксалата натрия? Рассчитайте константу равновесия окислительно-восстановительной реакции, пользуясь таблицей окислительно-восстановительных потенциалов.
будет израсходован на титрование 10,00 мл раствора оксалата натрия? Рассчитайте константу равновесия окислительно-восстановительной реакции, пользуясь таблицей окислительно-восстановительных потенциалов.
11. На титрование раствора  израсходовано 17,25 мл раствора
израсходовано 17,25 мл раствора  с
с  Сколько граммов железа содержится в пробе?
Сколько граммов железа содержится в пробе?
12. Сравните достоинства и недостатки бихроматометрии с другими методами титриметрического анализа с использованием окислительно-восстано-вительных реакций.
13. Почему титрование растворов бихромата проводят в кислой среде?
14. Напишите окислительно-восстановительные реакции для дифениламина.
15. Рассчитайте погрешность титрования железа (II) бихроматом: а) в присутствии фосфорной кислоты; б) в отсутствии фосфорной кислоты.
16. Как устанавливают конец титрования при броматометрическом титровании сурьмы (III)?
Комплексонометрия.
Цель и задачи работы.
Закрепление знаний теории реакций комплексообразования и комплексометрического титрования на примере комплексонометрии. Получение навыков комплексонометрического титрования, использования металлоиндикаторов, проведения расчетов результатов анализа и их обработки.
Контрольная задача — определение ионов металлов в растворах неизвестной концентрации.
Оборудование и реактивы:
1. Бюретка вместимостью 25 см3;
2. Мерные колбы вместимостью 100, 250 и 500 см3;
3. Колбы для титрования вместимостью 250 см3;
4. Пипетки Мора на 5, 10, 15, 25 см3;
5. Аналитические весы с разновесами;
6. Набор ареометров;
7. ЭДТА, раствор  = 0,025 моль/дм3;
= 0,025 моль/дм3;
8. Хлорид кальция, раствор  = 0,025 моль/дм3;
= 0,025 моль/дм3;
9. Хлорид железа (III), раствор  = 0,025 моль/дм3;
= 0,025 моль/дм3;
10. Аммиачный буферный раствор с 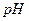 =10;
=10;
11. Ацетатный буферный раствор, 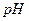 = 4,5;
= 4,5;
12. Комплексонат магния,  = 0,025 моль/дм3;
= 0,025 моль/дм3;
13. Эриохромовый черный Т, смесь с хлоридом натрия в отношении 1:100;
14. Сульфосалициловая кислота, раствор  = 5%-й раствор.
= 5%-й раствор.
Программа работы
Определение кальция
Комплексонометрическое определение кальция основано на прямом титровании его раствором двунатриевой соли - этилендиаминтетрауксусной кислоты -  (ЭДТА) в присутствии мурексида, эриохромового черного Т или другого индикатора.
(ЭДТА) в присутствии мурексида, эриохромового черного Т или другого индикатора.
Реакция протекает по следующему уравнению:

Образующийся хелат обладает невысокой устойчивостью,  Ионы водорода, выделяющиеся в процессе титрования, приводят к смещению равновесия данной реакции в сторону разрушения комплекса.
Ионы водорода, выделяющиеся в процессе титрования, приводят к смещению равновесия данной реакции в сторону разрушения комплекса.
Оптимальным 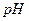 для определения ионов кальция будет
для определения ионов кальция будет 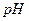 =11.
=11.
При титровании с эриохромовым черным Т изменение окраски в конечной точке титрования недостаточно четкое, что можно объяснить незначительной устойчивостью образующегося металлоиндикаторного комплекса. Для получения более резкого изменения окраски индикатора в конечной точке титрования к анализируемому раствору перед титрованием можно добавить небольшое количество комплексоната магния. Переход окраски индикатора в конечной точке титрования становится очень четким. При этом протекает реакция:

Исчезает окраска комплекса магния с эриохромовым черным Т, и появляется окраска свободного индикатора.
Ход работы:
1. Анализируемый раствор переносят в мерную колбу вместимостью 100 см3 доводят до метки дистиллированной водой и тщательно перемешивают.
2. В коническую колбу для титрования переносят аликвотную часть раствора (10 см3), добавляют 5 см3 аммиачного буферного раствора, 1 см3 раствора комплексоната магния, индикатора эриохромового черного Т на кончике шпателя и после полного растворения индикатора титруют раствором ЭДТА до изменения окраски индикатора от красно-фиолетовой к синей.
3. Титрование повторяют 3-5 раз до получения не менее трех сходящихся результатов титрования. Результаты заносят в таблицу 7.1:
Результаты титрования раствора кальция раствором ЭДТА.
Таблица 7.1.
| № п/п | V(Na2H2Y), см3 | С(1/1 Na2H2Y), моль/дм3 | V(Са), см3 | С(1/1 Са), моль/дм3 | Т(Са), г/см3 |
4. Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание кальция в растворе и количество определяемого вещества, учитывая что в точке эквивалентности образуется комплекс состава 1:1.
Определение железа
Определение железа (III) основано на прямом титровании его раствором ЭДТА в присутствии салициловой или сульфосалициловой кислот, тайрона, роданидов, хромазурола S, бензогидроксамовой кислоты. Реакция протекает по уравнению

Железо (III) образует с ЭДТА один из самых устойчивых комплексов,  . Высокое значение константы устойчивости комплексоната железа позволяет проводить титрование в кислых средах при
. Высокое значение константы устойчивости комплексоната железа позволяет проводить титрование в кислых средах при 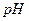 <3. Наиболее удобно проводить титрование при
<3. Наиболее удобно проводить титрование при 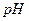 =2,5, при данной кислотности раствора логарифм условной константы устойчивости комплексоната железа равен
=2,5, при данной кислотности раствора логарифм условной константы устойчивости комплексоната железа равен  . Титрование железа возможно и при более низких значениях
. Титрование железа возможно и при более низких значениях 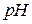 раствора, но при этом значительно возрастает коэффициент побочных реакций ЭДТА, что приводит к уменьшению условной константы устойчивости комплексоната железа, следовательно, к увеличению погрешности определения.
раствора, но при этом значительно возрастает коэффициент побочных реакций ЭДТА, что приводит к уменьшению условной константы устойчивости комплексоната железа, следовательно, к увеличению погрешности определения.
Железо (II) также образует с ЭДТА комплекс, но устойчивость этого комплекса ( ) значительно меньше устойчивости комплексоната железа (III). При
) значительно меньше устойчивости комплексоната железа (III). При 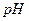 =2,5 железо (II) с ЭДТА не взаимодействует, поэтому перед титрованием его необходимо окислить до железа (III) нагреванием с
=2,5 железо (II) с ЭДТА не взаимодействует, поэтому перед титрованием его необходимо окислить до железа (III) нагреванием с  или добавлением пероксида водорода. Определение в кислых средах более избирательно. Определению железа (III) не мешают
или добавлением пероксида водорода. Определение в кислых средах более избирательно. Определению железа (III) не мешают  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 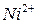 .
.
Ход работы
1. Анализируемый раствор в мерной колбе вместимостью 100 мл доводят до метки дистиллированной водой и тщательно перемешивают.
2. В коническую колбу для титрования переносят аликвотную часть раствора (10 см3), добавляют 5 см3 ацетатного буферного раствора, нагревают до 60 °С, добавляют 1 см3 раствора сульфосалициловой кислоты и титруют раствором ЭДТА до изменения окраски раствора от красно-фиолетовой к желтой.
3. Титрование повторяют 3-5 раз до получения не менее трех сходящихся результатов титрования. Результаты заносят в таблицу 7.2:
Результаты титрования раствора железа (III) раствором ЭДТА.
Таблица 7.2.
| № п/п | V(Na2H2Y), См3 | С(1/1 Na2H2Y), моль/дм3 | V(Fe(III), см3 | С(1/1Fe(III), моль/дм3 | Т(Fe(III), г/см3 |
Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание железа (III) в растворе и количество определяемого вещества, учитывая, что в точке эквивалентности образуется комплекс состава 1:1.
Вопросы для самоподготовки
1. Перечислите основные требования к реакциям, применяемым в методе комплексометрического титрования?
2. Какие факторы влияют на величину титрования?
3. Чем объясняется ограниченность применения неорганических реагентов в комплексометрическом титровании?
4. Назовите способы обнаружения конечной точки титрования.
5. Объясните сущность прямого, обратного, вытеснительного и косвенного приёмов комплексометрического титрования. В каких случаях применяется каждый из названных приёмов?
6. Что такое металлохромные индикаторы?
7. Напишите равновесие в растворе металлохромного индикатора.
8. Приведите графическую формулу ЭДТА. Какова дентатность ЭДТА?
9. Какова стехиометрия компонентов ЭДТА? Приведите графическую формулу комплексов двух- и трёхзарядных ионов металлов с ЭДТА.
10. Напишите уравнения реакций образования протонированных, нормальных и гидроксокомплексов ЭДТА.
11. Как готовят раствор ЭДТА?
12. Какие вещества могут быть использованы для стандартизации раствора ЭДТА?
13. В каких условиях проводят титрование ионов кальция раствором ЭДТА?
14. Как проводят комплексометрическое определение кальция и магния при совместном присутствии?
15. Почему следует удалить аммонийные соли при титровании кальция в присутствии магния?
16. В каких условиях проводят титрование железа (III) раствором ЭДТА? Укажите состав комплекса железа с сульфосалициловой кислотой в условиях проведения титрования.
17. Почему ионы трёхвалентных металлов титруют раствором ЭДТА в кислой среде, а щёлочноземельных — в щелочной?
18. Как можно предотвратить образование гидроксидов ионов металлов  при их титровании раствором ЭДТА в щелочной среде?
при их титровании раствором ЭДТА в щелочной среде?
19. Предложите способ комплексометрического определения ионов  в присутствии
в присутствии  , ионов
, ионов  в присутствии
в присутствии  , ионов
, ионов  в присутствии
в присутствии  .
.
20. Рассчитайте навеску металлического цинка для установления характеристик ЭДТА методом отдельных навесок, чтобы на её титрование после растворения расходовалось 10,00 мл 0,0505 М раствора ЭДТА.
Ответ: 0,0330 г.
21. Из навески 1,200 г образца, содержащего хромат калия, приготовлен раствор в мерной колбе вместимостью 100 мл. К 25,00 мл полученного раствора прилит избыток раствора нитрата свинца. Полученный осадок отфильтровали, промыли, перевели в раствор и обработали 10,00 мл 0,1000 М раствора ЭДТА, избыток которого оттитровали 8,00 мл 0,05105 М раствора 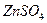 . Рассчитайте процентное содержание хромат-ионов в образце.
. Рассчитайте процентное содержание хромат-ионов в образце.
Ответ: 23,27%.
22. Вычислите процентное содержание  и
и  в известняке, если после растворения 1,0000 г пробы и соответствующей обработки раствора довели водой до 100 мл, на титрование 20 мл для определения суммы
в известняке, если после растворения 1,0000 г пробы и соответствующей обработки раствора довели водой до 100 мл, на титрование 20 мл для определения суммы  и
и  затратили 19,25 мл 0,05140 М раствора ЭДТА, а на титрование
затратили 19,25 мл 0,05140 М раствора ЭДТА, а на титрование  израсходовали 6,26 мл раствора ЭДТА.
израсходовали 6,26 мл раствора ЭДТА.
Ответ:  — 16,0 %;
— 16,0 %;  — 28,1 %.
— 28,1 %.
Инструментальные методы анализа
|