Салициловая кислота в щелочной среде с иодом образует желтый осадок тетраиодфениленхинона:

Ход работы.
Анализируемый образец, содержащий не более 30 мг салициловой кислоты, растворяют в 1 М растворе карбоната натрия, разбавляют водой до 50 см3 и приливают при перемешивании раствор иода в небольшом избытке. Необходимо добавить 10-12 см3 0,025 М раствора иода на каждые 10 мг салициловой кислоты. Через 2 ч проверяют полноту осаждения. Осадок пропускают через стеклянный фильтр и промывают 3 раза холодной дистиллированной водой. Фильтр с осадком сушат при 80° С в термостате до постоянной массы и взвешивают.
Расчет и оформление результатов анализа см. п. 3.2.1.
Вопросы для самоподготовки
1. Какие требования предъявляются к осаждаемой и гравиметрической формам?
2. От каких факторов зависят размер и число частиц остатка.
3. Какие требования предъявляются к осадителю в гравиметрическом анализе.
4. Как влияют на растворимость осадка присутствие одноименных с осадком ионов, 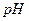 среды, ионная сила раствора, конкурирующие реакции комплексообразования?
среды, ионная сила раствора, конкурирующие реакции комплексообразования?
5. Какими причинами обусловлено загрязнение кристаллических и аморфных осадков?
6. Обоснуйте условия осаждения кристаллических и аморфных осадков.
7. Какими преимуществами обладают органические осадители перед неорганическими? Какие органические осадители вы знаете?
8. Предложите и обоснуйте состав промывной жидкости для промывания осадков: 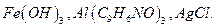
9. Какие фильтры применяют в гравиметрии для отделения осаждаемой формы?
10. Какой объем 3% раствора 8-гидроксихинолина  следует взять для осаждения алюминия из раствора, содержащего 0,1500 г сульфата алюминия (р = 1 г/мл)?
следует взять для осаждения алюминия из раствора, содержащего 0,1500 г сульфата алюминия (р = 1 г/мл)?
11. Какой объем 4% раствора тетрафинилбората натрия  следует взять для осаждения калия из раствора, содержащего 0,1011 г нитрата калия (ρ = 1 г/мл)?
следует взять для осаждения калия из раствора, содержащего 0,1011 г нитрата калия (ρ = 1 г/мл)?
12. Какую массу бензидина  следует взять для осаждения сульфат-ионов в слабокислой среде в виде
следует взять для осаждения сульфат-ионов в слабокислой среде в виде  .·
.·  из раствора, содержащего 0,1920 г сульфата натрия?
из раствора, содержащего 0,1920 г сульфата натрия?
13. Какую навеску технического карбоната кальция, содержащего 80%  следует взять для гравиметрического анализа, если осаждаемая форма
следует взять для гравиметрического анализа, если осаждаемая форма 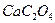 , гравиметрическая форма
, гравиметрическая форма 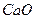 ?
?
14. Чему равны гравиметрические факторы в следующих определениях:
а) 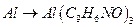 ; б)
; б)  ;
;
в) 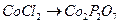 ; г)
; г)  ;
;
д)  ; е)
; е)  ;
;
ж)  ; з)
; з)  ;
;
15. Вычислить процентное содержание железа в сплаве, если масса гравиметрической формы  0,8000 г, навеска сплава, взятая для гравиметрического анализа, 0,5600 г.
0,8000 г, навеска сплава, взятая для гравиметрического анализа, 0,5600 г.
16. Вычислить процентное содержание кремня в чугуне, если из навески чугунных стружек, равной 1,4255 г, в результате гравиметрического анализа получена гравиметрическая форма  массой 0,0420 г.
массой 0,0420 г.
17. Определить процентное содержание калия в навеске гербицида, равной 0,8100 г, если масса гравиметрической формы  равна 3,4780 г.
равна 3,4780 г.
18. Какую навеску органического вещества, содержащего 6% фосфора, следует взять для анализа, если после соответствующей обработки масса гравиметрической формы  равна 0,5000 г?
равна 0,5000 г?
19. Сколько граммов салициловой кислоты  содержалось в растворе, если при определении ее гравиметрическим методом масса гравиметрической формы
содержалось в растворе, если при определении ее гравиметрическим методом масса гравиметрической формы 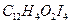 равна 0,5780?
равна 0,5780?
20. Вычислить процентное содержание хлормицина 
 в навеске глазной мази, равной 0,5150 г, если после соответствующей обработки масса гравиметрической формы
в навеске глазной мази, равной 0,5150 г, если после соответствующей обработки масса гравиметрической формы  равна 0,0065 г.
равна 0,0065 г.
21. Вычислить процентное содержание серы в навеске образца угля (влажность образца 1,30%), равной 0,8460 г, если после соответствующей обработки масса гравиметрической формы  равна 0,1025 г.
равна 0,1025 г.
22. Рассчитать содержание алюминия (в г) в анализируемом растворе, если масса гравиметрической формы 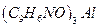 равна 4,5900 г.
равна 4,5900 г.
23. Выпадет ли осадок  при смешении равных объемов 0,2 М раствора
при смешении равных объемов 0,2 М раствора  и 0,1 М раствора
и 0,1 М раствора  ? ПРАgCl=1,78·10-10.
? ПРАgCl=1,78·10-10.
24. Выпадет ли осадок  при смешении равных объемов 0,1 М раствора
при смешении равных объемов 0,1 М раствора  и 0,05 М
и 0,05 М  ?
?  .
.
25. Сколько моль и граммов бария останутся неосажденными при приливании 50 мл 0,1 М раствора серной кислоты к 100 мл 0,1 М хлорида бария?
26. Сколько граммов  перейдет в раствор при промывании осадка:
перейдет в раствор при промывании осадка:
а) 200 мл воды; б) 200 мл 0,1 М раствора  ; в) 200 мл 2,8% водного раствора аммиака (
; в) 200 мл 2,8% водного раствора аммиака ( =0,98 г/мл)?
=0,98 г/мл)?  .
.
27. Сколько процентов  будет потеряно при промывании навески
будет потеряно при промывании навески  , равной 0,4200 г: а) 250 мл воды; б) 250 мл 0,1 М
, равной 0,4200 г: а) 250 мл воды; б) 250 мл 0,1 М 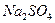 ? ПРВаSO4 = 1,1·10-10.
? ПРВаSO4 = 1,1·10-10.
28. Вычислить растворимость 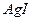 : а) в воде; б) в 0,1 М растворе
: а) в воде; б) в 0,1 М растворе  ; в) в 0,01 М растворе
; в) в 0,01 М растворе 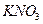 . ПР AgI=8,3·10-17.
. ПР AgI=8,3·10-17.
29. Вычислить растворимость в 0,001 М растворе  : а)
: а)  (
( = 4,0·10-10;
= 4,0·10-10; 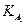 = 4,5·10-7;
= 4,5·10-7;  = 4,8·10-11); б)
= 4,8·10-11); б)  (ПРAlPO4 = 5,75·10-19); в)
(ПРAlPO4 = 5,75·10-19); в)  (ПРCa3(PO4)2 = 2,0·10-29;
(ПРCa3(PO4)2 = 2,0·10-29; 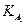 = 7,1·10-3;
= 7,1·10-3;  = 6,2·10-8;
= 6,2·10-8;  = 5,0·10-13).
= 5,0·10-13).
30. Вычислить растворимость: а)  в 1М водном растворе аммиака (ПРАgCl = 1,78·10-10; К1=2,1·10-3; К2=1,7·10-7); б)
в 1М водном растворе аммиака (ПРАgCl = 1,78·10-10; К1=2,1·10-3; К2=1,7·10-7); б)  в 1М растворе
в 1М растворе 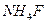 (ПРFePO4 = 1,3·10-22; К1=1,10·10-6 К2=5,49·10-10; К3 =5,49·10-13; К4=5,49·10-15; К5=1,03·10-16; К6=1,03·10-16).
(ПРFePO4 = 1,3·10-22; К1=1,10·10-6 К2=5,49·10-10; К3 =5,49·10-13; К4=5,49·10-15; К5=1,03·10-16; К6=1,03·10-16).