Обнаружение карбонатов.
| Рис.1.1. Устройство для определения CO2 и летучих кислот. 1 пробка; 2 пробирка; 3 стеклянная палочка с шариком; 4 анализируемый раствор. |
Одну-две капли анализируемого раствора или кусочек твёрдого вещества обрабатывают в приборе тремя каплями 1 М серной кислоты. Шарик пробки опускают в реагент и устанавливают на место. Капля реагента на шарике обесцвечивается немедленно или через короткое время в зависимости от количества выделяющегося оксида углерода (IV). Чтобы избежать неправильных выводов вследствие влияния углекислого газа воздуха, необходимо параллельно проводить холостой опыт в таком же приборе.
Предел обнаружения: 4 мкг.
Реагент: смешивают 1 см3 0,05 М раствора карбоната натрия с 2 см3 0,5% (масс) этанольного раствора фенолфталеина и доводят до 10 см3 дистиллированной водой.
Обнаружению мешают летучие кислоты, влияние которых устраняется по специальным методикам.
Обнаружение нитратов
На предметное стекло вместе с каплей анализируемого раствора помещают кристаллик сульфата железа (II). Добавляют каплю концентрированной серной кислоты так, чтобы она стекала сбоку. В присутствии нитратов вокруг кристаллика образуется коричневое кольцо.
Предел обнаружения: 2,5 мкг.
Обнаружению мешают нитриты, иодиды, бромиды, циан иды, цианоферраты, хроматы, сульфиты, тиосульфаты, иодаты и др.
Обнаружение ортофосфатов
На фильтровальную бумагу наносят каплю анализируемого раствора и высушивают. Затем бумагу погружают или опрыскивают реагентом I и через 30 с реагентом II. Фосфаты образуют синее пятно.
Предел обнаружения: 0,1 мкг.
Реагенты: метилвиолет, водный раствор, w = 1% (масс); в 150 см3 растворяют 12 г молибдата аммония и подкисляют 35 см3 10 М раствором хлороводородной кислоты.
Обнаружение силикатов
На фильтровальную бумагу помещают каплю анализируемого раствора и каплю первого реагента. Затем к раствору добавляют каплю второго реагента, после чего бумагу некоторое время держат над аммиаком. Появление голубого окрашивания свидетельствует о присутствии в растворе кремниевой кислоты.
Предел обнаружения: 1 мкг.
Реагенты: в 150 см растворяют 12 г молибдата аммония и подкисляют 35 см3 10 М раствором хлороводородной кислоты; бензидин, водный раствор, w = 0,1% (масс).
Обнаружению мешают фосфаты.
Обнаружение сульфидов
К 1-2 каплям анализируемого раствора, помещенным на предметное стекло добавляют 2-3 капли реагента. В присутствии сульфидов выпадает черный осадок сульфида свинца.
Предел обнаружения: 1,8 мкг.
Регент: ацетат свинца, водный раствор, С=1 моль/дм3.
Обнаружению мешают ионы, образующие со свинцом нерастворимые соли.
Обнаружение сульфатов
На предметном стекле смешивают три капли анализируемого раствора с каплей насыщенного раствора перманганата калия. Каплю полученной смеси наносят на фильтровальную бумагу, пропитанную хлоридом бария, и выдерживают ее 7-8 мин над печью при 70-80o С. Избыток хлорида бария удаляют промыванием в воде в течение 1 мин. Бумагу помещают в 1 М раствор щавелевой кислоты для разрушения  и
и  . Если в анализируемом растворе присутствует сульфат — ион, то на бумаге остается яркое фиолетовое пятно.
. Если в анализируемом растворе присутствует сульфат — ион, то на бумаге остается яркое фиолетовое пятно.
Предел обнаружения: 2,5 мкг.
Реагент: бумага, пропитанная 0,5 М раствором хлорида бария и высушенная.
Обнаружению мешают сульфид-, сульфит-, роданид-, селенат- и селенит-ионы.
Обнаружение хлоридов
Используется прибор (рис.1.1). Несколько крупинок образца помещают в пробирку прибора или же каплю испытуемого раствора выпаривают в ней. Затем добавляют две капли концентрированной азотной кислоты. На стеклянный шарик пробки наносят реагент и закрывают пробирку. Прибор нагревают на асбестовой сетке до появления первых пузырьков. При малых количествах хлорид-ионов, чтобы увидеть помутнение реагента, каплю переносят на черную фарфоровую пластинку.
Предел обнаружения: 1 мкг хлороводородной кислоты.
Реагент: нитрат серебра, водный раствор, С = 0,1 моль/дм3.
Обнаружению мешают иодиды и бромиды.
Результаты работ 1.2.2, 1.2.3 и анализ объекта неизвестного состава вносят в таблицу 1.1:
Результаты обнаружения неорганических ионов.
Таблица 1.1
| № п/п | Обнаруживаемый ион | Реагент | Внешний эффект | Вывод | |
| Стандартный раствор | Анализ | ||||
Вопросы для самоподготовки
1. В чем принципиальное отличие дробного метода анализа от систематического? Каковы преимущества и недостатки методов друг перед другом?
2. Какой метод, дробный или систематический, следует применить при обнаружении нескольких ионов в смеси, состав которой приблизительно известен?
3. Назовите критерии оценки аналитических реакций.
4. Какие реакции называются общими, специфическими, частными?
5. Дайте определения понятиям "качественная реакция", "селективность реакции", "предел обнаружения".
6. Назовите признаки по которым классифицируются аналитические реакции.
7. Какова аналитическая классификация катионов по сероводородному методу анализа?
8. На чем основано деление катионов и анионов на аналитические группы в систематическом анализе?
9. Что такое групповой реагент? Каким требованиям он должен отвечать? Как проверить полноту осаждения ионов?
10. Каков порядок осаждения катионов в систематическом ходе анализа? Почему анализ начинают с обнаружения иона  ?
?
11. Назовите групповые реагенты аналитических групп по сероводородному методу.
12. Что такое маскирование ионов? В каких случаях эта операция применяется?
13. Какие методы и способы группового и селективного разделения ионов вы знаете?
14. Вычислите 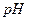 раствора серной кислоты с молярной концентрацией эквивалента 0,005 моль/дм3 (считая кислоту сильной по обеим степеням диссоциации).
раствора серной кислоты с молярной концентрацией эквивалента 0,005 моль/дм3 (считая кислоту сильной по обеим степеням диссоциации).
15. Рассчитайте молярную концентрацию ионов  в растворе с
в растворе с  .
.
16. Вычислите 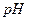 раствора, содержащего в 1 дм3 0,2 г гидроксида натрия.
раствора, содержащего в 1 дм3 0,2 г гидроксида натрия.
17. Рассчитайте 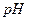 0,1 моль/дм3 раствора уксусной кислоты.
0,1 моль/дм3 раствора уксусной кислоты.
18. Рассчитайте 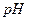 0,01 моль/дм3 раствора гидроксида аммония.
0,01 моль/дм3 раствора гидроксида аммония.
19. Рассчитайте константу гидролиза, степень гидролиза и 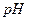 0,1 моль/дм3 раствора роданида аммония. Какие факторы усиливают и какие подавляют гидролиз?
0,1 моль/дм3 раствора роданида аммония. Какие факторы усиливают и какие подавляют гидролиз?
20. Вычислите 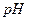 ацетатной буферной смеси, содержащей по 0,1 моль/дм3 уксусной кислоты и ацетата натрия. Для чего применяются буферные растворы? Что такое буферная емкость?
ацетатной буферной смеси, содержащей по 0,1 моль/дм3 уксусной кислоты и ацетата натрия. Для чего применяются буферные растворы? Что такое буферная емкость?
21. Как изменится 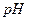 аммонийной буферной смеси, содержащей по 0,1 моль в 1 дм3 гидроксида и хлорида аммония, при добавлении к 1 дм3 смеси 0,01 моль соляной кислоты.
аммонийной буферной смеси, содержащей по 0,1 моль в 1 дм3 гидроксида и хлорида аммония, при добавлении к 1 дм3 смеси 0,01 моль соляной кислоты.
22. Вычислите произведение растворимости гидроксида магния, если его растворимость в 1 дм3 воды равна 0,0120 г.
23. Вычислите растворимость хлорида свинца в воде, если ПР =  .
.
24. Выпадет ли осадок, если смешать 30 см 0,003 моль/дм3 раствора хромата калия и 20 см3 0,0002 моль/дм3 раствора нитрата серебра? (ПР =  ).
).