1. Аликвотную часть раствора уксусной кислоты неизвестной концентрации титруют стандартным раствором гидроксида натрия в присутствии индикатора фенолфталеина (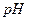 в точке эквивалентности для 0,1 раствора составляет 8,9;
в точке эквивалентности для 0,1 раствора составляет 8,9;  для фенолфталеина 9,0) до окрашивания раствора в бледно-розовый цвет.
для фенолфталеина 9,0) до окрашивания раствора в бледно-розовый цвет.
2. Титрование повторяют 3-5 раз. Результаты заносят в таблицу 4.3:
Результаты титрования уксусной кислоты.
Таблица 4.3.
| № п/п | V (NaOH) cм3 | C (1/1NaOH), моль/дм3 | V (CH3COOH),см3 | C (1/1CH3COOH), моль/дм3 | Т (CH3COOH), г/см3 |
3. Неизвестную концентрацию кислоты рассчитывают по среднему значению объема раствора гидроксида натрия, пошедшего на титрования (из 3-5 параллельных проб):


4. Рассчитывают ошибку титрования.
Контрольная задача. Определение карбоната и гидроксида натрия при совместном присутствии.
Определение компонентов смесей  и
и  в растворе основано на титровании его стандартным раствором
в растворе основано на титровании его стандартным раствором 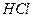 сначала в присутствии индикатора фенолфталеина и затем — метилового оранжевого.
сначала в присутствии индикатора фенолфталеина и затем — метилового оранжевого.
При титровании раствора смеси  по фенолфталеину фиксируется момент титрования, когда оттитрованы
по фенолфталеину фиксируется момент титрования, когда оттитрованы 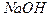 и
и  до
до  расход титранта при этом составит
расход титранта при этом составит  . При титровании этого раствора по метиловому оранжевому
. При титровании этого раствора по метиловому оранжевому  титруется до угольной кислоты, расход титранта составит
титруется до угольной кислоты, расход титранта составит  , причем
, причем  >
>  . Объем титранта
. Объем титранта  эквивалентен содержанию
эквивалентен содержанию  , ¦экв
, ¦экв  = 1/1, а
= 1/1, а  эквивалентен содержанию
эквивалентен содержанию 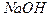 . Для пояснения сказанного титрование раствора смеси
. Для пояснения сказанного титрование раствора смеси  схематично изображено на рис. 4.1.
схематично изображено на рис. 4.1.

Рис. 4.1. Схема титрования раствора смеси 
Ход работы:
1. Отбирают пипеткой аликвотные части раствора Vп из мерной колбы Vк и переносят их в колбы для титрования, добавляют 3 капли раствора фенолфталеина и медленно при перемешивании титруют стандартным раствором 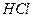 до обесцвечивания розовой окраски. Фиксируют расход титранта —
до обесцвечивания розовой окраски. Фиксируют расход титранта —  .
.
2. Добавляют в титруемый раствор 1 каплю раствора метилового оранжевого и продолжают титрование до перехода окраски раствора из желтой в оранжевую, расход титранта —  . Титрование повторяют 3-5 раз.
. Титрование повторяют 3-5 раз.
Результаты заносят в таблицу 4.4:
Результаты титрования раствора
смеси карбоната и гидроксида натрия.
Таблица 4.4.
| № п/п | V1, cм3 | V2, cм3 | Vк, см3 | Vп, см3 | С(1/1HCl), моль/дм3 |
3. По результатам 3-5 титрований находят средние значения V1 и V2. Содержание компонентов смеси рассчитывают по следующим формулам:


Контрольная задача. Определение карбоната и гидрокарбоната натрия при совместном присутствии.
При титровании раствора смеси  и
и  по фенолфталеину фиксируется момент титрования, когда
по фенолфталеину фиксируется момент титрования, когда  оттитрован до
оттитрован до  ,— расход титранта V1, а при титровании по метиловому оранжевому, когда оба компонента оттитрованы до угольной кислоты,— расход титранта V2, причем V1 < V2. Объем титранта V1 эквивалентен содержанию
,— расход титранта V1, а при титровании по метиловому оранжевому, когда оба компонента оттитрованы до угольной кислоты,— расход титранта V2, причем V1 < V2. Объем титранта V1 эквивалентен содержанию  — ¦экв
— ¦экв  = 1/1, a V2—V1 эквивалентен содержанию
= 1/1, a V2—V1 эквивалентен содержанию  . Схема титрования раствора смеси
. Схема титрования раствора смеси  приведена на рис. 4.2.
приведена на рис. 4.2.

Рис. 4.2. Схема титрования раствора смеси 
Ход работы:
1. Титрование смеси по фенолфталеину и метиловому оранжевому проводят по п. 4.2.2.
2. Содержание компонентов смеси рассчитывают по следующим формулам:


Вопросы для самоподготовки.
1. Какова роль кривых титрования?
2. В каких координатах строят кривые в разных методах титрования?
3. Обязательно ли совпадение точки эквивалентности и конечной точки титрования?
4. Назовите факторы, влияющие на вид кривой титрования (величина скачка, положение точки эквивалентности, наклон ветвей).
5. Можно ли оттитровать в водном растворе прямым способом борную кислоту. Соли аммония, ацетат-ион?
6. Сколько скачков на кривых титрования щавелевой, серной, этилендиаминтетрауксусной, угольной и фосфорной кислот гидроксидом натрия; карбоната натрия, фосфата натрия и гидрозина соляной кислоты?
7. Почему скачок титрования борной кислоты увеличивается в присутствии глицерина?
8. Укажите на кривых титрования области буферного действия, а также точку с максимальной буферной ёмкостью.
9. Как оттитровать угольную кислоту по второй ступени, фосфорную кислоту по третьей ступени?
10. Какие приёмы используют для титрования кислот и оснований с константами менее  ?
?
11. Какие приёмы используют для титрования смеси электролитов с близкими константами?
12. Рассчитайте эквивалентную массу карбоната натрия, бикарбоната натрия, тетрабората натрия, карбоната кальция, оксалата натрия, иодата калия, оксида ртути, щавелевой кислоты, янтарной кислоты, бензойной кислоты, бифталата калия, бииодата калия.
13. Назовите вторичные стандартные растворы, применяемые в методе кислотно-основного титрования.
14. Почему раствор щёлочи не должен содержать карбонат-ион? Перечислите несколько способов приготовления раствора щёлочи, не содержащего карбонат-ион.
15. Как меняется вид кривой (величина скачка, положение точки эквивалентности) при изменении: а) концентрации растворов; б) констант диссоциации кислот и оснований; в) температуры?
16. Каковы предельные значения концентрации кислот и оснований, а также константы диссоциации кислот и оснований, при которых наблюдается скачок титрования?
17. Можно ли прямым методом титровать борную кислоту, соли аммония, соли уксусной муравьиной, щавелевой кислот, угольную кислоту по второй ступени и фосфорную кислоту по третьей ступени?
18. При каком условии возможно реальное титрование смеси кислот (или многоосновных кислот по ступеням)? Можно ли оттитровать по ступеням щавелевую, серную кислоту?
19. Изложите сущность ионной, хромофорной и ионно-хромофорной теорий индикаторов.
Перманганатометрия.
Цель и задачи работы.
Закрепление знаний теории окислительно-восстановительных равновесий и титриметрического анализа с применением окислительно-восстановительных реакций. Получение навыков титрования и проведения расчетов результатов анализа и их обработка. Освоение способов прямого, заместительного титрования и титрования по остатку. Контрольная задача — определение восстановителей в растворах неизвестной концентрации.
Программа работы