Наиболее характерными режимными факторами влияющими на процесс накипеобразования являются гидродинамика, щелочность и газосодержание подогретого раствора. Влияние температуры на накипеобразование в чистых водных и промышленных растворов различно [5]. Наиболее сильно оказывает влияние на процесс накипеобразования свойства используемой воды. Совокупность свойств воды, обусловлена наличием в ней присутствием в ней различных солей: преимущественно катионов Са 2+ (кальциевая жесткая вода) и Мg 2+ (магниевая жесткая вода). Сумма концентрации Са 2+ и Мg 2+ называют жесткостью воды [6]. Первая вызвана присутствием в воде гидрокарбонатов Са и Мg [при кипячении разлагаются на СаСO3 и Мg(ОН)2 с выделением СО2], вторая - наличием сульфатов, хлоридов, силикатов, нитратов, фосфатов этих металлов. Одним из возможных источников этих солей являются горные породы (известняки, доломиты), которые растворяются в результате контакта с природной водой и грунты. Жесткость воды выражается в мг-экв/л: карбонатная жесткость отвечает той части катионов Са 2+ и Мg 2+ , кратна эквививалентна содержащимся в воде анионам 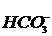 , некарбонатная – анионам
, некарбонатная – анионам 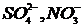 и другим.
и другим.
Повышенная жесткость способствует усиленному образованию накипи в паровых котлах, отопительных приборах и бытовой металлической посуде, что значительно снижает интенсивность теплообмена, приводит к большим расходам топлива и перегреву металлических поверхностей [4].
Вода, применяемая в промышленности, как правило, содержит глину, песок и взвеси – около 8-19 мг/л, органические вещества (водоросли, коллоиды, гуминовые вещества из плодородной почвы – около 5 мг/л), соли – земельных металлов (натрий, калий (4-15 мг/л)), соли жесткости (кальций, магний, силикаты – 8-95 мг/л), растворенный кислород (5-12 мг/л), углекислый газ (100-700 мг/л).
Неорганические примеси, находящиеся в воде в основном в виде ионов: Na +, Са 2+, Мg 2+, К+, Cl-, SO4 2-, НСО3 –.
Главным накипеобразователем является Са2+ и Мg2+, образуются вначале гидрокарбонаты, а затем нерастворимые карбонаты этих металлов.
Гипс кристаллизуется из природной воды в виде двугидрата сульфата кальция СаSО4 · 2Н2О. При подогреве до 100ºС он переходит в менее растворимый полугидрат СаSО4 · 0,5Н2О, а при повышении температуры до
130ºС – в еще менее растворимый СаSО4.
При кипячении гидрокарбонаты переходят в малорастворимые карбонаты:
Са(НСО3)2 → СаСО3 + СО2 + Н2О
Мg(НСО3)2 → МgСО3 + СО2 + Н2О
Чем интенсивнее нагревание, тем интенсивнее идут эти реакции. Содержание Са(НСО3)2 в растворе повышается при нарушении технологического режима, а также зависит от рН раствора. Гидрокарбонаты кальция в растворах находятся в нестабильном состоянии и любое внешнее воздействие ускоряет кристаллизацию гидрокарбонатов.
Таблица 2.1 - Содержание Са(НСО3)2 в растворе после нагревания (%)
| Время, минут | 75 ºС | 90 ºС | 100 ºС умеренно | 100 ºС интенсивно |
| 2,3 | 2,3 | |||
| 2,3 | 2,3 |
Гидрокарбонаты магния ведут себя аналогично Са(НСО3)2, но разложение на малорастворимые карбонат и оксид углерода (ІІ) идет в полтора раза медленее. В определенных физико-химических условиях Мg(НСО3)2 переходит в труднорастворимый гидроксид - Мg(ОН)2.
Карбонаты СаСО3 и МgСО3 ведут себя по-разному. Так при повышении температуры, но при постоянном давлении их растворимость уменьшается, а при повышении температуры и давления растворимость резко увеличивается (табл. 2.2), причем МgСО3 растворяется интенсивнее, чем СаСО3, а при высоких температурах раствора он гидролизуется и теряя СО2 переходит в Мg(ОН)2 [5].
Таблица 2.2 - Зависимость растворимости карбонатов от изменения температуры и давления
| Температура, ºС | Давление, МПа | Растворимость, мг/л | |
| СаСО3 | МgСО3 | ||
| 0,05 | 15,0 | 10,0 | |
| 0,10 | 17,0 | 20,0 | |
| 0,50 | 21,7 | 25,0 | |
| 0,90 | 23,6 | 29,7 | |
| 1,60 | 25,5 | 35,5 |
Таким образом, происходит устранение временной жесткости воды, постоянная жесткость воды не может быть удалена кипячением.
Железо концентрируется в котловой воде в меньшей степени чем легкорастворимые соли (хлориды, сульфаты, натрий и т.д.), вследствие того, что значительная часть его расходуется на образование накипи.
Процесс железоокисного накипеобразования не зависит от скорости образования медных отложений. Скорость каждого из них определяется величиной тепловой нагрузки. При этом скорость отложения меди существенно меньше скорости отложения железоокисных соединений. Это подтверждено исследованиями результаты которых приведены в таблице 2.3.
Железоокисное накипеобразование имеет место и при поверхностном кипении, примем скорость его при этом зависит от недогрева жидкости до кипения. При увеличении недогрева уменьшается скорость накипеобразования. В отсутствие поверхностного кипения процесс образования железоокисных отложений прекращается.
Таблица 2.3 - Влияние меди на скорость образования железоокисных отложений q = 350 кВт/м2 [300Мкал/(м2ч)]; С Fe = 5 мг/кг, РО43- = 100 мг/кг, рН = 10,8
| Концентрация меди, мг/кг | Характеристика отложений | |||
| Количество железа, мг | Скорость отложения железа, мг/(см2 ч) | Количество меди, мг | Скорость отло-жения меди, мг/(см2 ч) | |
| Следы | 3,5 | 0,0188 | 0,02 | 0,0001 |
| 0,05 | 3,2 | 0,172 | 0,12 | 0,0005 |
| 0,5 | 3,7 | 0,0199 | 0,19 | 0,0010 |
| 3,4 | 0,0185 | 0,27 | 0,0014 | |
| 3,6 | 0,0193 | 0,29 | 0,0015 | |
| 3,8 | 0,0200 | 0,32 | 0,0017 |
Основной составляющую железоокисные накипи являются окислы железа, выделяющиеся на поверхности нагрева в форме Fe3О4. Количество окислов железа в подобных отложениях достигает 70 – 90 %. Металлическая медь нередко также присутствует в железоокисных накипях, но содержание ее обычно не превышает 5 – 6 %. Скорость накипеобразования не зависит от валентности железа: двухвалентное железо прикипает так же интенсивно, как и трехвалентное в контуре парогенератора.
Передача тепла сопровождается возникновением на микроучастках наиболее теплонапряженной поверхности нагрева повышение концентрации электронов. Величина созданного при этом потенциалов определяется тепловой нагрузкой. Положительно заряженная часть окислов железа должна оседать в этом случае на отрицательно заряженных частях поверхности нагрева и закрепляться на них. Скорость прикипания частиц зависит как от содержания железа в воде, так и от величины тепловой нагрузки поверхности.
На некоторых электростанциях, работающих при давлении пара 98 · 105 Па, наблюдались случаи образования железофосфатных отложений, в состав которых входят натрий, двухвалентное железо и фосфорная кислота, в количестве отвечающем формуле NaFePO4. Образование накипи такого состава связано со значительной концентрацией железа и фосфатов в котловой воде при недостатке ее щелочности.
Высокое содержание кремниевой кислоты в питьевой и котельной воде в сочетании со значительными местными тепловыми нагрузками поверхности нагрева или ухудшенной циркуляцией вызывает образование алюмосиликатных и железоокисных накипей. Они имеют состав типа:
- натролита (NaО2 ·Al2O3 · 3SiO2 ·2H2O)
- анальцима (NaО2 · Al2O3 · 4SiO2 · 2H2O)
- нозелита (4NaО2 ·3Al2O3 · 6SiO2 ·SO3)
- анилита (NaО2 ·Fe2O3 · 4SiO2).
Образование накипи может быть следствием следующих процессов:
1. Кристаллизации веществ на поверхности нагрева;
2. Прилипания или налипания твердых частиц веществ;
3. Выпадения легкорастворимых солей и различных сложных соединений из концентрированной котловой воды;
4. Образование отложений, состоящих из продуктов коррозии.
Накипь может выделяться из воды при ее нагревании или кипении; возникать вследствие коррозионного воздействия воды или растворенных в ней примесей на металл; выделяться из пара при его перегреве и из воды при испарении.