Твердые катализаторы – это, как правило, высокопористые вещества с развитой внутренне поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью А, температурой зажигания Тзаж , селективностью φkat и рядом других технологических характеристик.
При практическом применении большое значение имеет технологическая характеристика промышленных катализаторов (активность, температура зажигания, производительность, селективность, отравляемость, прочность и др.).
1. Активность катализатора А – мера ускоряющего воздействия по отношению к данной реакции:



Из уравнения Аррениуса:

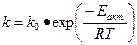




 Из этого уравнения следует, что активность темы выше А, чембольше снижается энергия активации в присутствии катализатора Е акт. (однако следует иметь в виду, что в присутствии катализатора меняется не только энергия активации, но и предэкспоненциальный множитель k0 k0 Kat).
Из этого уравнения следует, что активность темы выше А, чембольше снижается энергия активации в присутствии катализатора Е акт. (однако следует иметь в виду, что в присутствии катализатора меняется не только энергия активации, но и предэкспоненциальный множитель k0 k0 Kat).
Ускоряющее действие катализатора можно наглядно проследить на примере окисления сернистого ангидрида
2SO2 + O2 → 2SO3 + Q
Реакция в отсутствие катализатора протекает крайне медленно (при 420 °С, или 693 К энергия активации составляет приблизительно 420 000 Дж/моль). При проведении этой реакции на ванадиевом катализаторе (V2O5) Eк = 268 000 Дж / моль К, подставив эти величины в уравнение и учитывая, что R = 8,3 Дж / моль К, получаем
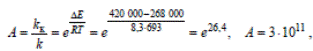
т.е. скорость реакции возрастает в сотни миллиардов раз.
Несмотря на то, что kat имеют высокую цену в стоимости нефтехимической продукции (цена kat составляет 0,001-0,1 %) технологическое и экономическое преимущество kat реализуется не за счет снижения цены kat в структуре себестоимости, а за счет экономии сырья, снижения энергозатрат процесса.
|
|
2. Температура зажигания Т˚заж – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью wr..
Понятие «зажигание» означает, что при возрастании температуры выше предельной, равной Т˚заж, происходит резкое, скачкообразное увеличение скорости реакции. «Зажигание» может иметь место и в некаталитических реакциях.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания Т˚заж, что позволяет снизить энергетический затраты на предварительный нагрев реакционной смеси, упрощается конструкция реактора, становится устойчивее технологический режим.
Особенно важно иметь невысокую температуру зажигания катализатора при проведении обратимых экзотермических реакций (невысокие температуры проведения процесса позволяют сместить равновесии реакции в сторону обр-я продуктов)
3. Селективность. Сложные каталитические реакции могут протекать по нескольким термодинамически возможным направлениям с образованием большого числа различных продуктов. Преобладающее течение реакции зависит от используемого катализатора, причем не всегда ускоряется процесс, термодинамически самый выгодный из нескольких возможных.
Селективностью или избирательностью катализатора φKat. называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
Количественно селективность катализатора можно оценить как селективность процесса – интегральную φ или дифференциальную φ’ .
|
|
Экономия сырья осуществляется ч/з повышение селективности Kat. Современные Kat. должны иметь селективность не < 85%. Чем выше селективность Kat., тем < расход сырья побочные реакции.
Если одновременно протекает несколько параллельных реакций, можно подобрать разные селективные катализаторы для каждой из этих реакций.
Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, области протекания гетерогенного каталитического процесса (кинетической, диффузионной).
Для сложной параллельной реакции протекающей по схеме:
k1E1
 А В
А В
k2E2 С


 и включающей А В и А С, которые характеризуются, соответственно, константами скорости k1 и k2 и энергиями активации Е1 и Е2, селективностью по направлению А В определяется как:
и включающей А В и А С, которые характеризуются, соответственно, константами скорости k1 и k2 и энергиями активации Е1 и Е2, селективностью по направлению А В определяется как:

Из этого уравнения видно, что при некоторой заданной температуре Т путем подбора соответствующего катализатора можно изменять разность E2 − E1 и, таким образом, создавать возможности для получения только или главным образом целевого продукта.
Примером избирательности катализатора может служить реакция окисления NH3 до NO на платиновом катализаторе
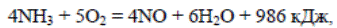
протекающая полностью за десятитысячные доли секунды, т.е. практически мгновенно. Одновременно с указанной реакцией протекают две параллельные реакции при которых образуются N2О и N2

Эти реакции термодинамически более выгодны, поскольку они сопровождаются выделением большого количества тепла, однако практически они не протекают, поскольку в присутствии платинового катализатора их скорость неизмеримо мала.
|
|
Особенно сильно селективность проявляется в сложных органических реакциях. Так, например, этиловый спирт в зависимости от типа катализатора и условий проведения процесса катализа может превращаться в следующие продукты: этилен СН2–СН2, диэтиловый эфир СН3–СН2–О–СН2–СН3, ацетон СН3СОСН3, бутадиен СН2 = СН–СН = СН2, ацетальдегид СН3СНО и другие продукты. Следовательно, применяя соответствующий катализатор, из одного и того же сырья можно получить различные целевые продукты.
4. Пористая и кристаллическая структура катализатора. Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему  ), удельной поверхностью катализатора f (т.е. приходящийся на единицу массы m или объема V).
), удельной поверхностью катализатора f (т.е. приходящийся на единицу массы m или объема V).
При выборе твердого вещества в качестве катализатора важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, весьма небольшая, быстро подвергалась бы отправлению, и катализатор вскоре утрачивал бы активность А. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы, характеризуются большими значениями удельной поверхности (до 10-100 м2/г).
В качестве катализаторов стараются применить природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т.д.) Эти вещества используют в качестве носителей, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью. Например, переход γ-Al2O3 в α-Al2O3 на несколько порядков снижает активность этого вещества как катализатора дегидрирования.
5. Механическая прочность контактной массы должна быть такой, чтобы она не разрушалась под действием собственного веса в аппаратах с неподвижным слоем катализатора и не истиралась в аппаратах с движущимся слоем катализатора.
6. Промотирование и отравление катализаторов. Часто введение очень небольшого количества (долей %) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности ↑А, либо, наоборот, к снижению активности ↓А на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т.п.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами.
Это объясняется теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам, – активные центры. Каталитические яды блокируют активные центры, образуя с ними поверхностные химические соединения. (Хромоксидные катализаторы дегидрирования УВ отравляются водой)
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается, в этом случае требуется замена катализатора. Одно и то же вещество может вызвать и обратимое и необратимое отравления, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
7. Устойчивость к контактным ядам является важнейшим свойством промышленных катализаторов. Для удлинения срока службы катализатора в промышленных условиях в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами.
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (так называемого кокса) покрывающей поверхность катализатора. Для ее удаления цикл катализа сменяют циклом регенерации – катализатор продувают при высокой температуре воздухом для перевода кокса в СО2. Часто процесс оформляют по такой схеме: в одном реакторе идет химическая реакция, а в другом идет регенерация катализатора, заключающаяся в выжиге кокса с поверхности катализатора. В настоящее время в одном и том же реакторе есть зона реакции и зона регенерации.
Существуют каталитические яды, которые вызывают необратимое отравление катализатора и поэтому для некоторых процессов очень важна предварительная очистка сырья.
8. Так как большинство промышленных процессов протекает при достаточно высоких температурах, большое значение имеет стойкость катализаторов к таким температурам и резким их перепадам.