Если привести в соприкосновение два раствора различной концентрации или раствор и растворитель, то движение частиц растворенного вещества станет направленным.
Осмометр
Молекулы растворителя проникают через полупроницаемую мембрану, что сопровождается повышением уровня жидкости во внутреннем сосуде осмометра. При этом создается препятствующее осмосу гидростатическое давление столба жидкости; на некоторой высоте h гидростатическое давление становиться таким, что осмос прекращается – наступает осмотическое равновесие.
Осмотическое давление – это давление численно равное минимальному гидростатическому давлению, которое нужно приложить к жидкости, чтобы осмос прекратился


Комбинируя две последних формулы, получим формулу для расчета молекулярной массы растворенного вещества.
Растворы электролитов
Количественный процесс диссоциации характеризуется степенью диссоциации и константой диссоциации
Степень диссоциации (ионизации) [a] – отношение числа молекул распавшихся на ионы к общему числу молекул.



Константа диссоциации описывает равновесие процессов диссоциации и определяется законом действующих масс
CH3COOH«CH3COO–+H+

Используя a можно записать:
[CH3COO–]=[H+]=a*C0, кисл
[CH3COOH]=C0, к-ты-a* C0, к-ты=(1-a)*C0, к-ты

Если заменить концентрацию через разведение С=1/V
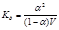 Если a<3%Þ1-a@1
Если a<3%Þ1-a@1
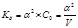

С разведением раствора слабого электролита степень его диссоциации возрастает. Сильные электролиты этому закону не подчиняются. Было установлено, что вычисляемая по этому уравнению константа диссоциации зависит от концентрации раствора; увеличение концентрации ионов в растворе вызывает увеличение интенсивности их взаимодействия между собой и с растворителем.
Отклонение от идеальных растворов учитывают с помощью коэффициента активности γ.
Коэффициент активности (γ) показывает во сколько раз активность раствора или его эффективная концентрация отличается от общей концентрации вещества.
Классическая константа диссоциации записывается с учетом коэффициента активности



Произведение растворимости
В технике часто используют системы, состоящие из труднорастворимого электролита в виде осадка и раствора над ним. В таких системах устанавливается равновесие.
AgCl(тв)®Ag(р-р)++Cl(р-р)–

Активность чистой твердой фазы, при каждой данной температуре является константой
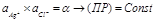
, где (ПР) – произведение растворимостей
Постоянство произведения растворимости не означает, что активность ионов электролита в растворе должна быть неизменной
При добавлении к раствору хлорида серебра нитрата серебра, которые содержат одноименные ионы, увеличивается скорость обратной реакции, и часть ионов серебра выпадает в виде осадка.
AgNO3®Ag++NO3–
При этом соблюдается следующее условие: Произведение концентрации ионов в растворе больше произведения растворимостей