1 рода:
~ металл или неметалл, погруженные в раствор, содержащий его ионы
к ним относятся:
- электроды обратимые относительно катиона(металлы, погруженные в раствор собственных солей)
- электорды обратимые относительно аниона (неметалл, погруженные в раствор собственных солей)
- амальгамные электроды(раствор металла ртути)
амальгамы металла, которые находятся в контакте с растворами с ионами данного металла
- газовые электроды н/р водородный
стандартный пот-л водородного электрода при любой температуре = 0
2 рода:
~ сложные системы, состоящие из металлов, покрытые слоем его труднорастворимого соединения и погружённого в раствор электролита, содержащего тот же анион, что и труднорастворимое соединение
к ним относятся:
– калонейные
– ионоселективные электроды (н/р стеклянные)
для приготовления хлорсеребряного электрода обычно используют одно-молярный раствор хлорида калия
т.к. пот-л таких электродов не зависит от концентрации измеряемых ионов, то он хорошо воспроизводится в различных растворах, поэтому ф-ия данного электрода – служить электродом сравнения.
Для электродов с водородозависимой ф-ией, н/р для водородного, назначение – индикаторный или измерительный электрод.
Для практических целей используют условные вел-ны, характеризующие пот-лы различных электродов относительно пот-ла электрода, выбранного за стандартный. Таким эталоном явл стандартный водородный электрод. Из стандартного водородного электрода и электрода, пот-л к-ого нужно опр составляют гальвонич элемент так, чтобы водородный электрод был левым. Тогда ЭДС такого гальвонич элемента будет = пот-лу исследуемого электрода. 
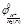 ®0
®0
Если при работе такого гальвонич элемента электрод заряжается отриц по отношению к водородному электроду, то его пот-л будет иметь знак «-» и металл переходит в р-р ввиде ионов. Полож пот-л означает, что ионы металла при работе гальвонич элемента из р-ра переходят на электрод и он заряжается полож относит стандартного.
Располагая металлы в ряд по возраст их стандартн пот-лов получен ряд напряжения металлов.
Классификация эл-хим цепей
Два основных вида:
1) химические
2) концентрационные
1) химические состоят из электродов, пот-лы, определяющие реакции к-х различны
а) простые: в них оба эл-да погружены в р-р одного и того же электролита и в них отсутствует диффузионный пот-л.
Н/р водородный и хлорсеребряный электроды погружены в р-р соляно кислоты (Pt)H2½H+½Ag, AgCl
(Pt)H2½HCl½Ag, AgCl
б) сложные: имеют границу раздела между двумя растворами, в которые погружаются электроды. На границе раздела растворов возникает диффузионный пот-л. Н/р цинковый и медный электроды погружены в растворы своих солей. Zn½Zn2+½½Cu2+½Cu
Zn½ZnCl2½½CuSO4½Cu
ЭДС всех перечисленных элементов определяется как разность пот-лов правого и левого электродов Хим цепи используются при создании хим источников тока
2) концентрационные состоят из электродов с одинаковыми пот-лами определяющими реакциями, которые отличаются друг от друга активностью участвующих в них вещ-в
а) 1 рода: состоят из 2 одинаковых по природе электродов, которые различаются активностью, но погруженных в один и тот же раствор электролита. Н/р концентрационные амальгамные цепи
(Hg)Zn½ZnSO4½Zn(Hg)
(Hg)Zn½Zn2+½Zn(Hg)
a1 > a2
в электродах такого типа, чем больше активность металла в амальгаме тем отрицательнее пт-л.
суммарный процесс вводится к переносу металла из амальгама более концен-ой в менее конц-ую
б) 2 рода: состоят из двух одинаковых электродов, но погруженных в 2 раствора одного и того же электролита с различной активностью ионов. Н/р серебряная концентрационная цепь
Ag½AgNO3½½AgNO3½Ag
чем больше активность ионов, тем больше пот-л
суммарный процесс сводится к переносу ионов из более конц растворов в менее.