Наличие в теле нейрона каналов пяти типов (в аксоне их только два) приводит к более сложным законам генерации нервных импульсов. Если на аксон подается некоторый постоянный стимул,аксон генерирует только одиночный импульс в ответ на начало стимуляции. Тело же клетки генерирует в таком случае целый ряд импульсов, частота которых определяется интенсивностью стимула.
Нейроны способны генерировать нервные импульсы в широком диапазоне частот: от одного или менее до нескольких сотен в секунду. Все нервные импульсы имеют одну и ту же амплитуду, так что информация, которую они несут, представлена числом импульсов, генерируемых в единицу времени: такой способ кодирования известен под названием частотного кодирования. Чем больше величина сигнала, который должен быть передан, тем выше частота разряда.
Когда нервный импульс проходит по всей длине аксона и прибывает к его окончанию, из пресинаптической мембраны высвобождается один из видов медиаторов. Этот медиатор диффундирует к постсинаптической мембране, где индуцирует открывание химически управляемых каналов. Ионы, проходящие через открытые каналы, вызывают изменения потенциала, известные под названием синаптических потенциалов.
Большая часть того, что известно о синаптических механизмах, получена в экспериментах на определенном синапсе: нервно-мышечном соединении, управляющем сокращением мышц лягушки.Аксон мотонейрона лягушки проходит на протяжении нескольких сотен микрон вдоль поверхности мышечной клетки, образуя несколько сотен синаптических контактов на расстояниях порядка микрона друг от друга. В каждой пресинаптической области легко обнаружить характерные синаптические пузырьки.
В синаптическом пузырьке содержится около 10000 молекул медиатора — ацетилхолина. Когда нервный импульс достигает синапса, запускается цепь событий, кульминацией которых являются слияние пузырька с пресинаптической мембраной и происходящее благодаря этому высвобождение ацетилхолина в щель между пресинаптической и постсинаптической мембранами; этот процесс называют экзоцитозом. Слившийся с мембраной пузырек в дальнейшем отделяется от нее и быстро вновь наполняется ацетилхолином, чтобы затем вновь опорожниться.
В последнее время были вскрыты многие детали событий, приводящих к экзоцитозу. Выяснилось, что слияние пузырьков с пресинаптической мембраной, по всей видимости, запускается быстрым, но кратковременным увеличением концентрации кальция в окончании аксона. Прибытие в окончание нервного импульса приводит к открыванию химически управляемых кальциевых каналов и появлению потока кальция внутрь окончания. Однако наблюдающееся вследствие этого увеличение концентрации кальция бывает лишь кратковременным, поскольку в окончании содержится специальный механизм, который быстро устраняет свободный кальций и восстанавливает его концентрацию до нормального, очень низкого уровня. Кратковременный резкий подъем уровня свободного кальция приводит к слиянию заполненных медиатором пузырьков с пресинаптической мембраной, но точный механизм этого важного процесса еще не совсем понятен.
Интересные детали структуры пресинаптической мембраны были выявлены методом криоскалывания, который позволяет разъединить слои двуслойной мембраны и делает внутренние мембранные белки доступными для исследования методом электронной микроскопии. В нервно-мышечном соединении лягушки на ширине каждого синапса тянется двойной ряд крупных мембранных белков. К этим белкам или вблизи них прикрепляются синаптические пузырьки. Только такие пузырьки могут сливаться с мембраной и выделять медиатор; другие пузырьки, по-видимому, остаются в резерве на некотором расстоянии от мембраны. Слияние пузырька с мембраной является случайным процессом, и каждый пузырек ведет себя при этом независимо от других.

Нервно-мышечное соединение лягушки; электронная микрофотография получена Хойзером. Аксон отделяется от мышечной клетки синаптической щелью. Синаптические пузырьки группируются вдоль пресинаптической мембраны; ближе к центру видны два синаптических контакта. Постсинаптическая мембрана мышечной клетки имеет одну особенность, не обнаруживаемую в других синапсах: против каждого контакта мембрана образует складки.

Реплики пресинаптической мембраны нервно-мышечного соединения лягушки после криоскалывания. А. Состояние мембраны через 3 мс после раздражения мышцы. Через мембрану аксона тянется двойной ряд частиц — мембранных белков, которые могут быть либо кальциевыми каналами, либо структурными белками, присоединяющими к себе пузырьки. Б. Состояние мембраны через 5 мс после стимуляции. Стимуляция привела к слиянию синаптических пузырьков с пресинаптической мембраной и образованию углублений.
Менее чем за 100 микросекунд ацетилхолин высвобождается из слившишхся с мембраной пузырьков, пересекает синаптическую щель и связывается с ацетилхолиновым рецептором — внутренним мембранным белком, встроенным в постсинаптическую мембрану. Рецептор одновременно является канальным белком, химически управляемым ацетилхолином. Когда к каналу прикрепляются две молекулы ацетилхолина, они снижают энергетический уровень молекулы белка в конформации, соответствующей открытому состоянию, и тем самым увеличивают вероятность того, что канал будет открыт. Переход канала в открытое состояние является случайным событием; среднее время пребывания в этом состоянии около миллисекунды. Каждый пакет из 10000 ацеталхолиновых молекул приводит к открыванию примерно 2000 каналов.

Медиатор выделяется в щель синаптического контакта между нейронами из пузырьков, которые сливаются с пресинаптической мембраной аксона и раскрываются; этот процесс назван экзоцитозом. На данной электронной микрофотографии нервно-мышечного синапса лягушки пузырьки аксонного окончания запечатлены в момент высвобождения ацетилхолина; микрофотография получена Хойзером.

Синаптические пузырьки группируются вблизи пресинаптической мембраны. На схеме показаны предположительные стадии экзоцитоза. Заполненные пузырьки движутся к синаптической щели, сливаются с мембраной, выделяют содержимое, а затем вновь отделяются от мембраны, восстанавливают свою форму и заполняются медиатором.
За тот короткий период, в течение которого канал остается открытым, через него проходит около 20000 ионов натрия и приблизительно столько же ионов калия. В результате этих ионных потоков трансмембранная разность потенциалов уменьшается почти до нуля. Насколько близко она подходит к нулю, зависит от того, как много каналов было открыто и как долго они оставались открытыми. Ацетилхолин, высвобожденный типичным нервным импульсом, приводит к возникновению постсинаптического потенциала, или изменению напряжения, длящегося всего около пяти миллисекунд. Поскольку постсинаптические потенциалы обусловлены работой каналов, управляемых химически, а не электрически, их параметры сильно отличаются от параметров нервного импульса. Они обычно меньше по амплитуде, имеют большую длительность и могут плавно меняться по величине в зависимости от количества выделенного медиатора и, следовательно, от числа открытых каналов.
Различные типы химически управляемых каналов демонстрируют разную избирательность. Некоторые из них сходны с ацетилхолиновым каналом, пропускающим ионы натрия и калия почти без предпочтения. Другие каналы высоко избирательны. Изменение потенциала, возникающее на данном синапсе, зависит от избирательности открывающихся каналов. Если в клетку входят положительные ионы, происходит изменение потенциала в положительном направлении. Сдвиги потенциала в положительную сторону имеют тенденцию открывать электрически управляемые каналы и способствовать генерации нервных импульсов; в связи с этим они получили название возбуждающих постсинаптических потенциалов. Если положительные ионы (обычно калий) выходят из клетки, происходит изменение потенциала в отрицательном направлении, что способствует закрыванию электрически управляемых каналов. Такие постсинаптические потенциалы противодействуют возникновению нервных импульсов, и поэтому они названы тормозными. И возбуждающие, и тормозные постсинаптические потенциалы обычны для нейронов мозга.

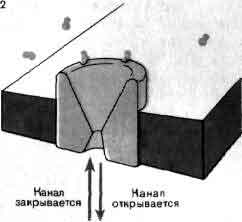

Ацетилхолиновый канал в постсинаптической мембране открывается молекулами ацетилхолина, выделяемыми в синаптическую щель. Рисунок изображает ацетилхолиновый рецептор в нервно-мышечном соединении лягушки. Две молекулы ацетилхолина быстро связываются с закрытым каналом в покое и формируют комплекс из рецептора и ацетилхолина (1, 2). Этот комплекс претерпевает конформационные изменения, в результате которых канал открывается для прохождения ионов натрия и калия (3). Время, необходимое для конформационных изменений комплекса, лимитирует скорость реакции. Канал остается открытым в среднем около 1 мс и затем вновь превращается в рецептор-ацетилхолиновый комплекс. Пока канал открыт, через него проходит около 20000 ионов натрия и равное количество ионов калия. Ацетилхолин быстро отделяется и разрушается ферментом ацетилхолинэстеразой.
Синапсы мозга отличаются от синапсов нервно-мышечного соединения в нескольких аспектах. В то время как в нервно-мышечных соединениях ацетилхолин всегда действует возбуждающе, действие того же самого вещества в мозгу в одних синапсах является возбуждающим, а в других тормозным. И если в нервно-мышечных соединениях медиатором обычно служит именно ацетилхолин, то каналы мозговых синапсов регулируются самыми различными медиаторами. Однако каждое данное синаптическое окончание выделяет только один тип медиатора, и в соответствующей постсинаптической мембране имеются каналы, управляемые этим медиатором. В противоположность активируемым ацетилхолином каналам нервно-мышечного синапса, всегда открывающимся примерно на одну миллисекунду, в некоторых типах мозговых синапсов имеются каналы, открывающиеся на доли миллисекунды, а в некоторых других каналы могут оставаться открытыми сотни миллисекунд. Последнее большое различие состоит в том, что в области нервно-мышечного соединения лягушки аксон образует сотни синаптических контактов с мышечной клеткой, а в мозгу аксоны обычно устанавливают только один-два синаптических контакта с данным нейроном. Как и можно было ожидать, такие различия в функциональных свойствах коррелируют со значительными различиями в структуре.
Как мы видели, интенсивность стимула кодируется частотой импульсов. В синапсе декодирование производится с помощью двух процессов: временной суммации и пространственной суммации. В процессе временной суммации каждый постсинаптический потенциал добавляется к суммарному потенциалу предшественников, вызывая таким образом изменение потенциала, средняя амплитуда которого отражает частоту поступающих импульсов. Другими словами, нейрон, который разряжается с высокой частотой, выделяет из своих синаптических окончаний больше молекул медиатора, чем нейрон, разряжающийся с меньшей частотой. А чем больше молекул медиатора выделяется за данное время, тем больше каналов открывается в постсинаптической мембране и, следовательно, тем выше постсинаптический потенциал. Пространственная суммация — это в некотором смысле эквивалентный процесс, только он отражает интеграцию нервных импульсов, прибывающих от всех нейронов, находящихся в синаптическом контакте с данным нейроном. Итоговое изменение потенциала, получившееся в результате временной и пространственной суммации, кодируется частотой нервных импульсов для передачи в другие клетки, расположенные в нейронной сети «ниже по течению».
Я описал здесь то, что обычно понимают под нормальной передачей информации в нервных сетях, при которой изменения постсинаптического потенциала кодируются частотой нервных импульсов и передаются по аксону другим нервным клеткам. Однако в последние годы было обнаружено, что в некоторых случаях постсинаптический потенциал не трансформируется в нервный импульс. Так, изменение напряжения, связанное с синаптическим потенциалом, может непосредственно вызвать выделение медиатора из соседней зоны без возникновения импульса. Полагают, что такое непосредственное воздействие может играть роль в синаптических контактах между дендритами, а также в некоторых цепях с обратной связью, где один дендрит вступает как пресинаптический в контакт с другим дендритом, а тот в свою очередь, тоже как пресинаптический, вступает в контакт с первым. Такие короткие цепи обратной связи, по-видимому, обычны для мозга, но их роль в переработке информации пока еще не выяснена.
Большинство современных исследований нейрона сосредоточено на мембранных белках, наделяющих двухслойную клеточную мембрану, которая сама по себе лишена каких-нибудь особенностей, специфическими свойствами, определяющими функционирование мозга. Что касается канальных белков, то имеется еще много нерешенных вопросов, касающихся механизма открывания, избирательности и регуляции. В последующие 5—10 лет, возможно, удастся связать физические процессы открывания и избирательность с молекулярной структурой каналов. Основы регуляции каналов меньше всего изучены, но сейчас начинают интенсивно исследоваться. Как теперь становится понятно, в регуляции каналов определенную роль могут играть гормоны и другие вещества. К центральным проблемам синаптического взаимодействия нужно отнести экзоцитоз и другие процессы, связанные с метаболизмом и выделением медиаторов. Можно ожидать, что усиленное внимание будет сконцентрировано на роли поверхностной мембраны в процессе роста и развития нейронов и образования синаптических связей, т.е. на тех удивительных процессах, которые закладывают фундамент интеграции нервной системы.
Э. КЭНДЕЛ
Малые системы нейронов
Такие системы представляют собой элементарные единицы мозговой деятельности. Изучение простых животных, например крупного брюхоногого моллюска аплизии, показывает, что Малые системы нейронов способны к некоторым формам обучения и памяти
По убеждению многих нейробиологов в конце концов будет доказано, что уникальные свойства каждого человека — способность чувствовать, думать, обучаться и помнить — заключены в строго организованных сетях синаптических взаимосвязей между нейронами головного мозга. Поскольку в человеческом мозгу исследовать эти сети трудно, важная задача нейробиологии состояла в том, чтобы создать на животных модели, пригодные для изучения того, как взаимодействующие системы нейронов формируют поведение. Нейронные сети, осуществляющие завершенные поведенческие акты, позволяют исследовать иерархию взаимосвязанных вопросов. В какой мере варьируют свойства разных нейронов? Чем определяется организация взаимосвязей между нейронами? Как разная организация взаимосвязей создает разные формы поведения? Может ли обучение модифицировать взаимосвязанные нейроны, управляющие определенным видом поведения, а если может, то посредством каких механизмов происходит запоминание?
Среди многих функций, осуществляемых благодаря взаимодействию нейронов, самые интересные те, которые связаны с обучением (способностью изменять поведение под влиянием опыта) и с памятью (способностью сохранять эти изменения в течение некоторого времени). Обучение и память — это, пожалуй, наиболее отличительные черты умственной деятельности высших животных, достигающие наивысшей формы у человека. В самом деле, человек является тем, чем он есть, в значительной мере благодаря тому, чему он обучился. Поэтому чтобы понять обучение и изучить эволюцию поведения, теоретически важно определить, на каком филогенетическом уровне нейронной и поведенческой организации можно распознать начальные проявления процессов обучения и памяти, характерных для человеческого поведения. Такое определение важно также для практики. Исследовать клеточные механизмы памяти в мозгу человека или других млекопитающих трудно потому, что у них мозг невероятно сложен. Кроме того, таким исследованиям на мозге человека препятствуют этические соображения. Поэтому для науки важно было бы эффективно исследовать эти процессы в простых системах.

Группа нейронов на микрофотографии дорсальной поверхности абдоминального ганглия морского моллюска аплизии. Справа виден особенно крупный более темный нейрон. На карте абдоминального ганглия аплизии эта клетка идентифицирована как нейрон R2.
Могут возразить, что нельзя успешно изучать память и обучение человека на простых нейронных системах. Организация человеческого мозга представляется столь сложной, что попытка изучить обучение человека в упрощенной форме на простых системах обречена на неудачу. Человек обладает интеллектом, весьма развитой речью и абстрактным мышлением, которых нет у низших животных и которые, возможно, требуют качественно иных типов нейронной организации. Хотя такие возражения существенны, решающим не является вопрос о том, есть ли нечто специфическое в человеческом мозгу. Несомненно, есть. Но вопрос скорее состоит в том, есть ли у человеческого мозга и человеческого поведения что-нибудь общее с мозгом и поведением низших животных. Там, где есть элементы сходства, они могут свидетельствовать об общих принципах организации мозга, которые доступны успешному изучению в простых нервных системах.
Ответ на вопрос о сходстве очевиден. Этологи К. Лоренц (К. Lorenz), H. Тинберген (N. Tinbergen) и К. Фриш (К. von Frisch) показали, что у людей с низшими животными много общих форм поведения, в том числе элементарное восприятие и координация движений. В особенности широко распространена способность к обучению; она развилась у многих беспозвоночных и у всех позвоночных. Сходство некоторых процессов обучения позволяет думать, что нейронные механизмы данного процесса могут обладать общими свойствами на всем протяжении филогенеза. Например, нет, по-видимому, принципиальной разницы в структуре, химизме или функции между нейронами и синапсами у человека, кальмара, улитки и пиявки. Следовательно, полный и тщательный анализ обучения у такого беспозвоночного, вероятно, способен выявить механизмы, имеющие общее значение.
Примитивные беспозвоночные привлекательны для таких исследований тем, что их нервная система содержит от 10000 до 100000 клеток в отличие от многих миллиардов у более сложных животных. Клетки собраны в отдельные группы, называемые ганглиями, и каждый ганглий обычно содержит от 500 до 1500 нейронов. Такое количественное упрощение позволило связать функцию отдельных нейронов непосредственно с поведением. В результате получен ряд важных фактов, которые приводят к новым представлениям о связи между мозгом и поведением.
Первый важный вопрос, который следует рассмотреть исследователям простых нейронных систем, состоит в том, отличны ли друг от друга разные нейроны одной области. Этот вопрос — центральный для понимания того, как поведение осуществляется нервной системой, был до последнего времени предметом обсуждения. Некоторые нейробиологи считали, что по своим свойствам нейроны мозга достаточно сходны, чтобы можно было считать их идентичными элементами, связи между которыми обладают приблизительно одинаковым весом.
Против этого теперь выдвигаются веские возражения, особенно на основании изучения беспозвоночных, показавшего, что многие нейроны доступны индивидуальной идентификации и инвариантны у каждого члена вида. Представление об индивидуальных свойствах нейронов предложено еще в 1912 г. немецким биологом Р. Гольдшмидтом (R. Goldschmidt) на основании исследования нервной системы у примитивного червя, кишечного паразита аскариды. Мозг этого червя состоит из нескольких ганглиев. Изучая эти ганглии, Гольдшмидт обнаружил, что они содержат точно 162 клетки. Число это никогда не варьировало от животного к животному, и каждая клетка всегда занимала свое характерное положение. Несмотря на такие четкие результаты, работа Гольдшмидта осталась практически незамеченной.
Более 50 лет спустя к этой проблеме вернулись независимо друг от друга две группы исследователей в Гарвардской медицинской школе. М. Оцука (М. Otsuka), Э. Кравиц (Е. Kravitz) и Д. Поттер (D. Potter), исследуя омара, и У. Фрезье (W. Frazier), И. Купферман (I. Kupfermann), Р. Вазири (R. Waziri) и Р. Коггсхолл (R. Coggeshall), исследуя крупного морского моллюска аплизию, нашли подобную же, хотя и менее полную инвариантность в более сложных нервных системах этих более развитых беспозвоночных. Сходная инвариантность вскоре была обнаружена у многих беспозвоночных, в том числе у пиявки, рака, саранчи, сверчка и ряда моллюсков. Я ограничусь здесь рассказом об исследованиях аплизии, преимущественно исследованиях отдельного ганглия, а именно абдоминального. Сходные данные получены также на других беспозвоночных.
В абдоминальном ганглии аплизии нейроны варьируют по величине, положению, форме, пигментации, по характеру импульсации и химическим веществам, посредством которых они передают информацию другим клеткам. Такие различия позволяют распознавать и называть индивидуальные клетки (Rl, L1, R151 и т.д.). Некоторые из этих различий проявляются в характере импульсации. Одни клетки обычно «молчат», другие спонтанно активны. Среди активных одни генерируют регулярные потенциалы действия, или нервные импульсы, другие выдают повторные краткие залпы или серии импульсов. Теперь известно, что различия в импульсации объясняются разными типами ионных токов, генерируемых мембраной тела нейронов. Мембрана тела нервной клетки совершенно отлична от мембраны ее длинного отростка, аксона. Когда мембрана аксона активна, она, как правило, создает только приток ионов натрия и отставленный по времени выход ионов калия, тогда как мембрана тела клетки может продуцировать шесть или семь разных ионных токов в различных комбинациях.
1 R, Right — правый; L, Left — левый.— Прим. ред.

Рефлекс втягивания жабры возникает у аплизии в ответ на стимуляцию сифона или мантийного выступа. При этом жабра принимает положение, обозначенное цветной линией.
Пока еще неизвестно, обладает ли большинство клеток в нервной системе млекопитающих такой индивидуальностью. Впрочем, исследования сенсорных систем млекопитающих, описанные Д. Хьюбелом и Т. Визелем в настоящем выпуске, выявили поразительные важные различия между соседними нейронами (см. Д. Хьюбел и Т. Визель «Центральные механизмы зрения»). Работы по изучению развития головного мозга у позвоночных, описанные У. Коуэном, приводят к такому же выводу (см. У. Коуэн «Развитие мозга»),
В связи с тем фактом, что нейроны инвариантны, возникают новые вопросы. Инвариантны ли также синаптические связи между клетками? Всегда ли данная идентифицированная клетка соединена точно с тем же следующим нейроном, а не с другими? Многие физиологи изучали эти вопросы на беспозвоночных и нашли, что действительно клетки всегда образуют одни и те же виды соединений с другими клетками. Инвариантны не только связи, но и «знак», или функциональное выражение, этих связей, т.е. их тормозное или возбудительное действие.
Поэтому в, дальнейшем Фрезье, Дж. Бленкеншип (J. Blankenship), Г. Вахтель (Н. Wachtel) и я пользовались идентифицированными клетками, чтобы выявить правила, определяющие функциональные свойства связей между клетками. Отдельный нейрон обладает множеством веточек и образует множество соединений. Мы задались рядом вопросов: все ли связи нейрона специализированы для торможения или возбуждения, или же его импульсация может производить разное действие в его разных ветвях? Чем определяется возбудительный или тормозный эффект связи? В чем причина того, что связь является возбудительной или тормозной? Определяется ли знак синаптического действия химической структурой медиатора, выделяемого пресинаптическим нейроном, или же определяющим фактором служит природа постсинаптического рецептора? Выделяет ли нейрон на всех своих окончаниях один и тот же медиатор?

Карта абдоминального ганглия Aplysia californica, на которой показано положение идентифицированных нейронов; они обозначены L или R (от Left - левая и Right — правая половины ганглия) и пронумерованы. Эти нейроны являются частями скопления, образованного клетками с одинаковыми свойствами; они, кроме того, помечены буквой, обозначающей скопление (LD), и индексом, указывающим на поведенческую функцию нейрона, например, НЕ для возбудителя сердца (от Heart excitator) и G1 и G2 для двух мотонейронов жабры (от Gill — жабра).



Характер импульсации идентифицированных нейронов в абдоминальном ганглии аплизии. R2 обычно «молчит», R3 выдает регулярную импульсацию, R15 — регулярные пачки импульсов и L10 — нерегулярные пачки. L10 является командной клеткой, управляющей остальными клетками в системе.
Один из путей исследования этих вопросов состоит в том, чтобы проследить за разными связями клетки. Первая же рассмотренная нами клетка дала ясный ответ: по разным своим связям она оказывала разное действие. Она возбуждала одни следующие за ней клетки, тормозила другие и (пожалуй, совершенно неожиданно) образовывала двойственную связь, как возбудительную, так и тормозную, с третьей клеткой. Кроме того, она всегда возбуждала точно одни и те же клетки, всегда тормозила другую определенную группу клеток и всегда имела двойственную связь с третьей группой. Ее синаптическое действие создавалось одним и тем же медиатором ацетилхолином. Будет ли это действие возбудительным или тормозным, зависело от реакции медиатора с разными типами рецепторов на постсинаптических клетках. Рецепторы определяли знак синаптического действия, управляя разными ионными каналами в мембране, в основном натриевыми, для возбуждения и хлорными для торможения. Клетки, к которым приходили связи двойного действия, обладали для одного и того же медиатора рецепторами двух типов: один управлял натриевым каналом, другой — хлорным. Таким образом, функциональное свойство химической синаптической передачи определяется типом рецептора, который находится на данном постсинаптическом участке следующей клетки. [Сходные результаты получила Ж. Кихоу в Эколь Нормаль в Париже, детально проанализировав свойства разных ацетилхолиновых рецепторов.]



Инвариантность связей между клеткой L10 и некоторыми из следующих за ней клеток. А. Опыт, в котором двуствольные микроэлектроды для регистрации и для проведения тока были введены в L10, пресинаптический нейрон, и три следующие за ним клетки: L10 вызывает возбуждение (обозначено белым) в RB, торможение (черным) в LD и возбуждение и торможение в L7. Б. Соответствующие записи импульсации. В. Несколько наложенных записей, на которых виден короткий, но постоянный латентный период между импульсом в пресинаптическом нейроне и ответом двух следующих за ним клеток. Г. Наложения записей, полученных от L10 и L7, показывают, что эффект бывает возбудительным, когда L10 действует первым, как показывают высокие и узкие импульсы, и тормозным, когда он действует вторым, как показывают низкие и широкие импульсы.
Следовательно, как и предположили в свое время Л. Тауц (L. Tauc) и Г. Гершенфельд (Н. Gerschenfeld) из Института Марея в Париже, химический медиатор является лишь разрешающим агентом, а директивным компонентом синаптической передачи служат природа рецептора и ионные каналы, с которыми он взаимодействует. Этот принцип оказался в значительной мере универсальным. Он действует в нейронах позвоночных и беспозвоночных и в нейронах, использующих разные медиаторы: ацетилхолин, гамма-аминомасляную кислоту (ГАМК), серотонин, дофамин и гистамин. (Ему подчиняется также действие на нейроны некоторых пептидных гормонов, о чем пойдет речь ниже.)
То, что в ганглиях беспозвоночных животных были открыты идентифицируемые клетки, которые образуют друг с другом строго определенные связи, привело к составлению «монтажных схем» разных поведенческих нейронных цепей и тем самым позволило точно исследовать причинную связь отдельных нейронов с поведением. Термин «поведение» относится к доступным наблюдению действиям организма, начиная от таких сложных актов, как речь или ходьба, и до таких простых, как движение части тела или изменение ритма сердца. К типам поведения, хотя бы отчасти исследованным у пиявок, раков и брюхоногих моллюсков, относятся питание, разные локомоторные действия и различные реакции избегания и защиты.
Первый факт, полученный в этих исследованиях, состоит в том, что отдельные клетки осуществляют над поведением специфичный и часто поразительно мощный контроль. Это можно проиллюстрировать сравнением нервного контроля работы сердца у аплизии и у человека.
Человеческое сердце бьется спонтанно. Присущий ему ритм модулируется тормозным действием холинергических нейронов (медиатором служит ацетилхолин), аксоны которых идут в составе блуждающего нерва, и возбуждающим действием норадренергических нейронов, аксоны которых образуют ускоряющий нерв. В модуляции участвует несколько тысяч нейронов. У аплизии сердце тоже бьется спонтанно; его ритм модулируется тормозным действием холинергических нейронов и возбуждающим действием серотонинергических нейронов, но в модуляции участвуют всего лишь четыре нейрона! Две клетки возбуждают сердце (по существу, важную роль играет только «главная возбудительная» клетка), и две клетки тормозят его. Три другие клетки вызывают сокращение кровеносных сосудов и тем самым регулируют кровяное давление. Поскольку отдельные клетки неизменно связаны с одними и теми же следующими за ними клетками и могут производить эффекты разного знака, некоторые из них, расположенные в критических точках нервной системы, способны управлять целой последовательностью поведенческих актов. Еще в 1938 г. К. Вирсма (С. Wiersma) из Калифорнийского технологического института в опытах на раках установил важное значение отдельных клеток для поведения и назвал их «командными клетками». Такие нейроны найдены у многих животных. Некоторые из них оказались нейронами двойного действия. Впоследствии Дж. Кестер (J. Koester), И. Мейери (Е. Mayeri) и я, работая на аплизии в Медицинской школе Ньюйоркского университета, установили, что описанный нейрон двойного действия является командной клеткой для нейронной цепи, управляющей кровообращением. Одна эта клетка учащает ритм сердца и увеличивает объем выталкиваемой им крови, возбуждая главную клетку, возбуждающую сердце, и одновременно тормозя клетки, тормозящие сердце, а также клетки, вызывающие сужение крупных кровеносных сосудов. В результате усиленной активности одного этого нейрона сердце бьется быстрее и накачивает больше крови.