Вопрос 1. Функциональные группы
Всё разнообразие явлений живой природы обусловлено спецификой её химического состава. Особенно важную роль играют биоорганические соединения.
Органические вещества – сложные соединения углерода, в которых хотя бы некоторые атомы углерода находятся в частично-восстановленном состоянии.
Цепочки:
1.По длине, размеру:
• от 2 до 
2.По форме:
• линейная
• разветвлённая
• кольцевая
3.По типу связей с соседними углеродами:
• одинарные – С –
•двойные С = С
•тройные
Ковалентная связь (связь с помощью общих электронных пар):
1. Ковалентные полярные – связь между атомами разных неметаллов С  -) ← Н
-) ← Н  +) – смещение электрона слабое
+) – смещение электрона слабое
2. Ковалентные неполярные – связь между атомами одного и того же неметалла (С=С, S – S)
Атомы разных химических элементов отличаются по способности притягивать электроны (электроотрицательность).
В основе любых химических взаимодействий лежит взаимодействие зарядов (взаимодействие электронов и протонов друг с другом).
Чистые углеводороды очень редко используются живыми веществами для обмена веществ.
Классический состав атомов биоорганических соединений: С H O N P S
Свойства конкретной органической молекулы определяются имеющимися у нее группами заряженных атомов – функциональными группами.
NH3+ -аммиак [NH4]+(OH) – -нашатырный спирт.
NH4+ -ион аммония (Донорно-акцепторное взаимодействиe)
Таблица. Функциональные группы.
| Функциональные группы | Название | Общая формула соединения | Их общее название | Особенности |
| -ОН (δ-δ+) | Гидроксильная | R-OH | Спирты | Молекула приобретает 2 слабых электростатических заряда, на поверхности молекулы – слабый положительный заряд |
| -С=O (δ+δ-) | Карбонильная группа | О || R – C – H О || R – C – R | Альдегиды Кетоны | Молекула приобретает 2 слабых электростатическихзаряда, на поверхности молекулы – слабый отрицательный заряд |
| -С=O (δ+δ-) | OH (+) | Карбоксильная группа | R – C=O | OH | Органические кислоты | Связь ОН в карбоксильной группе – ионная, в растворе связь легко диссоциирует. Молекула приобретает сильный отрицательный заряд → здесь Н+ протон |
| -NH2 | Амино-группа | R – N – H | H | Амины | В растворе придает молекуле сильный положительный заряд |
| -S-H (δ-δ+) | Тио группа (мерканто группа) | R-SH | Тиоспирты | В данной группе атом серы находится в нетипичном для себя восстановленном состоянии, поэтому тио-группа способна активно участвовать в окислительно-восстановительных реакциях. Придаёт молекуле 2 слабых электростатических заряда, на поверхности молекулы - слабый положительный заряд. |
| O || O – P – OH | OH | Фосфатная группа (остатки фосфорной кислоты) | R-H2PO4
O(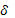 -)
||
R – O( -)
||
R – O(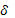 -) – P( -) – P(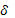 +) – OH(+)
|
OH(+) +) – OH(+)
|
OH(+)
| Органические фосфаты | Связи ОН в фосфатной группе – ионные, легко разрушаются в водной среде. В растворе придает молекуле сильный отрицательный заряд. |
Вывод (количественная закономерность):
1.Чем больше разных функциональных групп содержит молекула, тем сложнее её химические свойства, а значит и выполняемые в организме функции.
2.Чем меньше разных функциональных групп содержит молекула, тем проще её химические свойства, а значит и выполняемые в организме функции.
Вопрос 2. Строение, разнообразие и функции углеводов.
Углеводы - биоорганические соединения, состоящие из многочисленных звеньев H-C-OH, ковалентно соединённых друг с другом в различные цепочки (линейные; кольцевые, то есть циклические). Общая химическая формула Сn (H2O)m.
Все углеводы – гидрофильные вещества (охотно контактируют с водой, многие из них прекрасно в ней растворимы). Хорошо растворимые в воде углеводы обладают приятным сладким вкусом и называются сахарами.
Группы: •моносахариды – 1 линейная или кольцевая цепочка с количеством звеньев от 3 до 7 (глюкоза C6H12O6 – практически у всех живых существ; фруктоза C6H12O6 – в сочных плодах растений; галактоза C6H12O6 – в клетках млечных желёз у млекопитающих) •дисахариды – два кольцевых моносахарида, соединённых друг с другом через атом кислорода: R-OH + OH-R = H2O + R-O-R
Глюкоза, фруктоза и галактоза – изомеры.
Например,
• сахароза (свекловичный и тростниковый сахар) = фруктоза + глюкоза C12H22O11 Практически у всех наземных растений; • лактоза (молочный сахар) = глюкоза + галактоза C12H22O11 В молоке млекопитающих;
• мальтоза(солодовый сахар) = глюкоза + глюкоза С12H22O11 Практически у всех животных и грибов.
Сахароза, лактоза и мальтоза – изомеры.
Полисахариды – сложные длинные полимерные образования (крахмал – в клубнях картофеля; гликоген; целлюлоза – в растениях – клетчатка; хитин – грибы, членистоногие).
Все углеводы устроены очень однотипно, поэтому их химические свойства и выполняемые ими функции достаточно просты.
Функции углеводов:
• Энергетическая - у большинства живых существ в процессах высвобождения энергии используется клеточное дыхание:
C6H12O6 + O2 → CO2↑+ H2O + E(химическая энергия).
1. Химическая энергия (запасается в АТФ):
2. Механическая энергия (гонение крови)
3. Тепловая (для оптимального протекания реакций)
4. Электрическая (функционирование НС – нейроны, бактериальные клетки)
5. Световая
6. Химическая (! – Обмен веществ)
• Запасная – у многих организмов запас питательных веществ представлен преимущественно полисахаридами (у растений – крахмал, у животных и грибов – гликоген).
• Защитная (строительная) – хитин (у грибов) и целлюлоза (у растений) – входят в состав клеточных стенок.
Существуют и вторичные функции.