
Молекула аминокислоты обладает и положительным, и отрицательным зарядом, поэтому
аминокислоты могут принимать участие в химических реакциях друг с другом.
Пептидная связь C=O - N-H
Белки – полипептиды. Пептид – очень короткий белок.
Процесс увеличения продукта может длиться долго. В одной молекуле белка может быть много пептидных связей. Поэтому белки - полипептиды (пептиды).
У всех живых существ (животные, растения, грибы, бактерии) в формировании белков принимает участие один и тот же универсальный набор из двадцати вариантов аминокислот, которые отличаются своими радикалами.
1. Размер
2. Форма
3. Заряды (соответственно, и свойства)
Заряды:
«0» – заряда нет, чистая углеводородная группа.
«..» – слабенький заряд, ОН, карбонильная, тио группы
«+» - радикал, заряженный сильно положительно, в этих радикалах есть аминогруппа
«-» - радикал, заряженный сильно отрицательно, в этих радикалах есть карбоксильная, фосфатная группы.
Среднестатистическая длина белка – 250 аминокислот. Химические свойства такой молекулы очень сложны.
Белки фантастически разнообразны по своему строению, а потому фантастически разнообразны по выполняемым ими функциям.
Функции белков:
1. !Ферментативная = каталитическая (исключительная прерогатива белков) подавляющее большинство необходимых организму реакций либо не идут вообще, либо идут очень медленно. Поэтому есть специфические белки-ферменты. Голофермент = апофермент (белок) + кофермент (витамин – способствуют хорошей работе ферментов).
2. !Рецепторная – в любом организме есть специальные белки для восприятия внешних и внутренних сигналов. Белки-рецепторы.
≈200 лет назад – рецептор – чувствительный орган (анализатор);
≈100 лет назад – рецептор – чувствительная клетка;
≈50 лет назад – рецептор – чувствительный вырост чувствительной клетки;
Сейчас – рецептор – конкретный белок.
3. +Регуляторная – Фермент не всегда может провзаимодействовать с веществом – нужен регулятор.
4. !Транспортная – некоторые белки – направленный транспорт.
Мембранные транспортные белки:
Пассивный транспорт, но избирательный – мембранные каналы;
Активный транспорт – мембранные насосы.
5. !Двигательная – актин, миозин – мышечные белки. Актиноподобные белки есть даже у бактерий.
6. +Строительная – многие белки нужны организму как строительный материал. Кератин – очень важный структурный белок. Входит в состав когтей, ногтей, чешуи и кожи у змей. Коллаген.
7. +Защитная – некоторые белки призваны защищать организм от внутренних опасных процессов или от неблагоприятных внешних воздействий – иммуноглобулины. Защитной функцией гораздо больше обладают растения.
8. +Запасная – Казеин – запасной белок молока. Икра земноводных, в яйце, в семенах бобовых растений.
9. +Энергетическая
Под действием некоторых внешних и внутренних факторов может происходить изменение структуры белка, очень часто оно не затрагивает первичную структуру, но приводит к изменению четвертичной, третичной и вторичной, то есть та же самая молекула укладывается как-то иначе. Этот процесс получил название изменение конформации белка. Изменение конформации влияет на химические свойства молекулы и в итоге на способность выполнять необходимую функцию.
Функции конкретной молекулы белка зависят не только от её аминокислотной последовательности, но и от её конформации в данный момент.
Благодаря своему структурному разнообразию именно белки являются главными функциональными молекулами любого организма. В любом биологическом процессе, будь то полет шмеля, рост крапивы, формирование пупырышков на шляпке мухомора, развитие головастика, пение соловья или вспоминание любимого стихотворения, ключевую, центральную роль играют БЕЛКИ.
Нуклеиновые кислоты
Биосинтез любого белка очень сложный процесс. В частности, необходима информация о том, в какой последовательности должны быть соединены различные аминокислоты. Без нуклеиновых кислот синтез белка принципиально невозможен.
Полимерные биоорганические вещества, мономерами которых являются нуклеотиды.
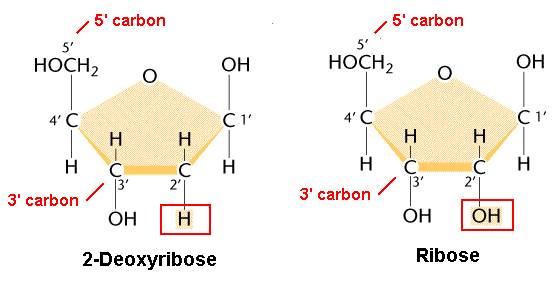
Три компонента нуклеотидов. В центре пятиуглеродный циклический моносахарид (рибоза, десоксирибоза). 1ая ОН расходуется на образование связи с азотистыми основаниями. 5ая ОН – на связь с молекулой фосфорной кислоты.
В составе одной и той же молекулы нуклеиновой кислоты обычно присутствуют нуклеотиды, в которых моносахарид представлен либо только рибозой, либо только дезоксирибозой. В связи с этим выделяют 2 типа нуклеиновых кислот:
• РНК (рибонуклеиновая кислота) • ДНК (дезоксирибонуклеиновая кислота)
Принцип организации ДНК
У всех живых организмов в состав молекулы ДНК входит универсальный набор из 4 вариантов азотистых оснований:
- Аденин
- Тимин
- Цитозин
- Гуанин
Азотистые основания - маленькие плоские циклические молекулы с жесткой формой. Поэтому, в отличие от белков азотистые основания не умеют менять свою форму. Несут на концах небольшие заряды (карбонильная группа (d-); аминогруппа (d+))
Благодаря указанным характеристикам, азотистые основания могут притягиваться друг к другу. Слабые водородные связи.
Комплементарные пары азотистых оснований. Доведение до гармонии, взаимное соответствие.
Две комплементарные цепочки ДНК взаимно притягиваются только с помощью водородных связей – при определенных условиях они легко разрываются.