Кроме широко применяемых техник, описанных выше, существует множество других, гораздо более избирательных в своих проявлениях, методик. Некоторые из них будут и представлены.
Стрессовые техники. Все плесневые грибы способны выносить различные стрессовые показатели из внешней среды, но когда стресс достаточно велик, организмы погибают. Тем не менее, степень допустимого стресса разнится у всех представителей царства, соответственно это качество можно использовать для того, чтобы убивать определенные виды, оставляя интересующий объект исследования нетронутым. Применение такой методики привело к интересному наблюдению: некоторые плесневые грибы не начинают расти покане будут подвержены условиям, которые были бы летальными для других. Примером такой импульса может служить группа плесневых грибов, обитающих в навозе. Представители этой группы начинают рост лишь тогда, когда оказываются подвержены суровой среде пищеварительного тракта животного. Другие же, например, показывают признаки роста лишь после того, как будут подвержены огню или заморозке.
Для наблюдения такого рода эффектов необходим лишь образец почвы, навоза, дерева и т.п., подверженный определенному воздействию, избирательно уничтожающему организмы. Например, можно использовать автоклавирование объекта без давления, вымачивание в спирте, кислоте, щелочи, других химикатах, или поочередное замораживание и таяние в течение нескольких недель. Почти любая сильнодействующая обработка объекта исследования выльется в «очаг сопротивления», который мог и не проявиться в другом случае. После такой жесткой обработки объект может быть исследован с помощью привычных прямых способов, таких как прямой посев, влажная камера и т.д. Доктор Б. Скотт (1968 г.) резюмировал метод изолирования видов Eupenicillium (Аскомицеты) из почвы. Около 2 г почвы добавлялось к 18 мл стерильной воды и нагревалось на водяной бане при температуре 80°C в течение 30 мин. После этого производился посев суспензии с разведениями.
Стерилизация поверхности. Если нам на глаза попался свежий лист, например, на дереве, имеющий омертвевшие точечные участки, можно предположить о том, что это вызвано представителем плесневых грибов. Если поместить этот участок прямо на питательную среду с агаром, то мы получим быстро растущего представителя царства, но никак не возбудителя. Нас интересует организм внутри листа, а не организмы, плотно прилегающие к поверхности. Лучший способ добиться этого - применить отбеливающее средство в течение времени, достаточного для инактивирования организмов на поверхности, но не в толще листа. Несмотря на огромное разнообразие отбеливателей, воздействие 10% раствора хлорной извести или 3% раствора перекиси водорода в течение одного часа работает в большинстве случаев. Методика стерилизации поверхности наиболее популярная при работе с семенами, плодовыми телами высших грибов, древесиной, мертвыми насекомыми.
Избирательные питательные вещества. Данная техника схожа с методом «наживок». Однако в этом случае непосредственно объект исследования помещается к питательным веществам, а не наоборот. Если стоит цель получить чистую культуру плесеней, способных к утилизации целлюлозы, то готовится среда Чапека, содержащая целлюлозу вместо сахарозы. Это лишь один из практически неограниченного числа примеров, которые можно осуществить при исследовании интересующего объекта. Единственным ограничением данной методики служит ограничение - допустимо лишь использование синтетических питательных сред с агаром, нежели натуральных. Причина этому - полная осведомленность о компонентах, которые будут варьироваться в ходе эксперимента. Кроме того, из-за присутствия примесей в агаре высока вероятность получения побочного организма, не усваивающего целевой компонент среды. Такой организм легко идентифицировать даже невооруженным глазом, по редким и разбросанным на среде колониям.
Доктор Баррон в своем труде (1977 г.), посвященном плесневым грибам, ловящим нематод, описал инновационную на тот момент питательную среду. Первоначально среда содержала в себе только нематод в чашке Петри, которых Доктор Баррон кормил высушенным гороховым супом. По достижении момента их многочисленности, он добавлял небольшое количество почвы. В результате те плесневые грибы, что могли ловить нематод с помощью своего мицелия, начинали расти и доминировать во всей чашке Петри. Таким образом нематоды являются избирательными «питательными компонентами» в данном эксперименте.
Другим представителем таких сред, очень часто применяемым при аналитических исследованиях, является среда, приготовленная на сенном настое. Порция сухого сена массой 2.5 г помещается в 1 л воды и кипятится в течение 15-20 мин. После этого отвар фильтруется через марлю, 20 г агара растворяется в нем, и вся смесь стерилизуется. Полученная среда довольно бедна на питательные вещества, поэтому не располагает к росту плесеней, нуждающихся в высокой концентрации углеводов, но способствует росту не охотно спорулирующих плесеней. Аналогично готовится и настой навоза с тем лишь отличием, что вместо 2.5 г сена используется 20 г высушенного конского или коровьего навоза. Отвары же листьев дуба или сосновой хвои будут токсичны для одних плесеней, но не для других.
Избирательные температуры. Плесени, свободно растущие при комнатной температуре, относятся к мезофильным. Большинство представителей царства Грибов являются мезофильными и подавляются или погибают при непривычно высоких и низких температурах. Плесневые грибы, требующие высокие температуры (40°C и выше) называются термофильными, а те, что требуют низких температур (15°C и ниже) - психрофильными.
При необходимости в культивировании интересующего нас представителя необходимо просто инкубировать чашки Петри или влажные камеры при нужной температуре и изолировать появившиеся плесени. Изолирование и все последующие операции, включая перенос, должны проводится при аналогичной температуре. Например, птичьи гнезда служат средой обитания множества видов термофильных плесеней, которые растут при инкубировании при 45-50°C, в то время как кроличий помет и компост хранят в себе психрофильные плесени, инкубируемые при температуре 0-5°C. Термофильные виды являются самыми быстро растущими из всех плесеней, что является несомненным плюсом при исследовании. Несмотря на это, некоторые психрофилы тоже обладают способностью к быстрому росту, доказывая, что температура не исключительный фактор, влияющий на скорость роста.
Учитывая оптимум температур термофильных плесеней и сопоставив его со средней температурой человека, необходимо учитывать этот факт и проявлять крайнюю осторожность при работе с такими грибами.
Осмофилия. Множество вещей, подлежащих хранению, таких как зерно, музейные экспонаты, шкуры, претерпевают разрушение плесенями. Это относится и к вещам, хранимых дома во влажных местах. Оба феномена вызваны плесневыми грибами, способными противостоять чрезвычайно сухим условиям среды. Такие представители называют осмофильными, что означает их преобладание в местах с высоким осмотическим потенциалом.
Рост осмофильных плесеней имеет место на относительно сухих или сладких веществах. К ним можно отнести виды, встречаемые на старых вещах из ткани или кожи, а также виды, растущие на джемах. Такая распространенность делает чрезвычайно простым их изолирование простым открытием чашки Петри на 2-3 ч в подвале или же на кухне. При этом важна питательная среда внутри чашки Петри. Осмофилы слабо растут на обычных питательных средах и производят аномальные споры либо не производят вовсе. Для их изолирования водная активность питательной среды должна быть колоссально занижена. Этого можно добиться повышением концентрации сахарозы в среде Чапека с 20 г на литр воды до 200-500 г на литр; либо повышением массы вносимой в среду Леониана с 6.25 г до 200-500 г. «Подробный состав сред Чапека и Леониана представлен в таблицах 5 и 6 соответственно.
Таблица 5 - Состав среды Чапека
| Наименование ингридиента | Масса, необходимая для 1 л среды (г) |
| Сахароза | |
| NaNO3 | 3.0 |
| K2HPO4 | 1.0 |
| MgSO4*7H2O | 0.5 |
| KCl | 0.5 |
| FeSO4*7H2O | 0.01 |
| Агар | |
| Дистиллированная вода |
Таблица 6 - Состав среды Леониана
| Наименование ингридиента | Масса, необходимая для 1 л среды (г) |
| Мальтоза | 6.25 |
| Солодовый экстракт | 6.25 |
| K2HPO4 | 1.25 |
| Дрожжевой экстракт | 1.0 |
| MgSO4*H2O | 0.625 |
| Пептон | 0.625 |
| Агар | 20,00 |
| Дистиллированная вода | 1000,00 |
Для идентификации осмофильных видов рода множество специалистов придерживается способа выращивания объектов на среде Чапека с 40% содержанием сахарозы, либо на среде с большим количеством глицерина». [11]
Другим же источником осмофильных плесеней являются сухофрукты, хотя и большинство производителей обрабатывает свои продукты нетоксичными фунгицидами. Тем не менее, сухофрукты, приготовленные в домашних условиях могут быть очень богатыми на рост таких плесеней, которые, насколько известно, не являются токсинопродуцирующими.
Множество аскомицетов, базидиомицетов и некоторых других плесневых грибов способно к «катапультированию» своих спор, т.е. к испусканию их с огромной силой. Данная особенность может быть использована для изолирования таких грибов путем подвешивания их над средой с агаром, тем самым позволяя приклеиваться выпущенным спорам.
В случае аскомицетов, возможно прилипание организма к субстрату, на котором он растет. Поэтому существует вероятность загрязнения среды слабо закрепленными частицами, которые упадут с субстрата. В качестве превентивной меры следует перевернуть чашку Петри, чтобы среда с агаром была расположена сверху, а споры выстреливались вверх. Этот способ применим лишь к асцомицетам - базидиомицеты не способны выстреливать споры так сильно.
Возможно комбинирование данного метода с влажной камерой. Чашка Петри устанавливается над влажной камерой (особенно эффективно при работе с навозом). Следует обратить внимание на то, чтобы чашка Петри не соприкасалась со стенками влажной камеры и с самим объектом, помещенным в камеру. Кроме того, следует проводить эту технику с исключением воздушных потоков, которые могут привнести иные споры.
Ускоренный посев культур микроскопических грибов. Когда стоит задача засеять относительно много чашек Петри микроскопическими грибами, стандартные методики могут быть не эффективными с точки зрения затрат времени, а также не всегда дадут ровный радиальный посев. Следующая техника способна предотвратить оба недостатка, а также применима к любым средам, предназначенным для культивирования микроскопических грибов, будь то агар Сабуро или среда Чапека.
Материалы, необходимые для методики включают в себя соломинки для напитков (4 мм в диаметре, 26 см в длину), которые были разрезаны на три равные части для упрощения манипулирования ими; деревянные палочки, круглые в сечении (15 см в длину). По одной деревянной палочке вставляется в уже нарезанную соломинку, после чего все конструкции стерилизуются окисью этилена, а в его отсутствие все производится в асептических условиях.
Перед посевом необходимо создать дыру в центре агара с помощью другой соломинки без деревянной палочки внутри (рисунок 16, а). Стерильное ядро агара, вырезанное соломинкой, останется внутри соломинки, т.к. палец закрывает открытый конец при извлечении соломинки из среды (рисунок 16, б). Данная соломинка может затем быть использована для вырезания еще 5-10 ядер агара, ведь ядра, что уже находятся внутри соломинки, создают вакуум внутри нее. Данные отверстия будут служить лунками для уже засеянного ядра агара.
При использовании устройства для посева (соломинка с деревянной палочкой внутри), рукой берется средняя часть соломинки и сжимается с целью удержания деревянной палочки внутри. Деревянная палочка вытягивается из верхнего конца на 1-2 см, тем самым создавая свободное пространство на конце, взаимодействующем со стоковой культурой на агаре. После проделывания отверстия в стоковой культуре-доноре необходимо покрутить соломинку между пальцами по- и против часовой стрелки, чтобы отрезать плесень от поверхности среды (рисунок 16, в). После данной операции соломину следует наклонить, чтобы разрушить адгезивные силы между ней и агаром. Соломинка извлекается, подносится к среде-рецепиенту и вставляется в центральную лунку (рисунок 16, г).
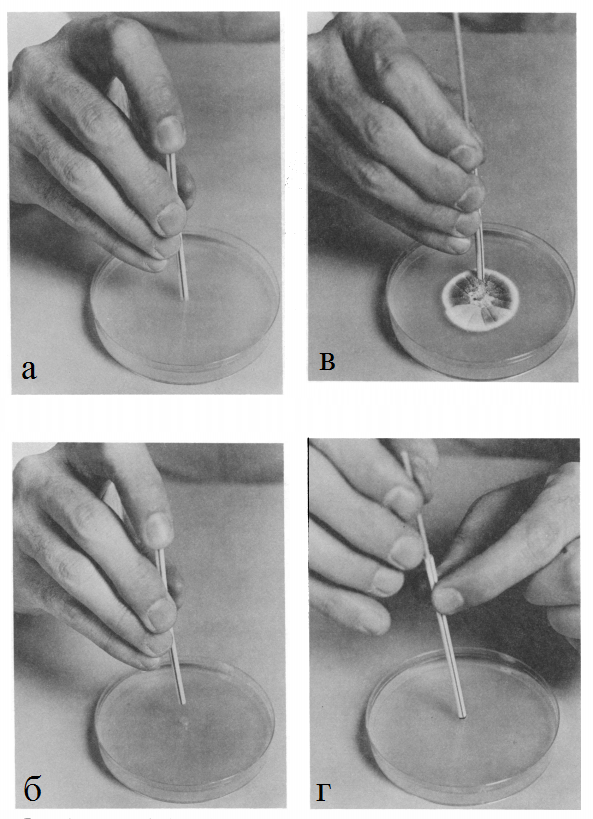
Рис. 16. Пошаговая инструкция к методике ускоренного посева микроскопических грибов
Таким образом, заранее приготовленная среда-рецепиент с необходимой культурой и чашки-рецепиенты с лунками упрощают всю методику посева при минимальных затратах и к тому же создают одинаковые условия для эксперимента в виде ядер одинакового размера.