Практически любой объект исследования, независимо от его происхождения, содержит в себе гетерогенное, а не гомогенное сообщество микроорганизмов, в том числе и грибов. Маловероятно, что даже объект размером 1мм2 будет содержать в себе один единственный вид организмов. Для любого из нижеописанных методов выделения культуры требуется диссекционный стереомикроскоп достаточной кратности. С его помощью могут быть найдены и исследованы спорообразующие структуры для установления вида микроскопических грибов. Методы изолирования могут быть разделены на две большие категории: прямые методы и выборочные методы.
Термин «прямой» применяется к техникам переноса, включающим в себя простой перенос плесени из своей среды обитания в лабораторные условия.
Прямой перенос. Простейший представитель этой методики представлен приготовлением и помещением препарата микроорганизма с субстрата с целью подтверждения наличия микроскопических грибов. Затем микробиологическая петля или игла нагревается в пламени горелки до ярко-красного цвета, остужается, и используется для переноса плесневых спор на чашку Петри с необходимой средой. Для облегчения процесса прикрепления спор к инструменту рекомендуется предварительно захватить этим инструментом мельчайшую часть агарной среды, чтобы споры могли прилипнуть к нему. Кусочек должен быть максимально маленьким, чтобы не терять точность маневрирования при переносе. Второй вариант представляет собой смачивание инструмента небольшим количеством глицерина с той же целью увеличения адгезивной реакции со спорами. После того как перенос был завершен остается ждать пару дней до того, как споры начнут прорастать и образовывать колонии.
«Влажная камера. Прямой перенос микроскопических грибов будет эффективнее, если субстрат будет содержаться во влажных условиях в течение нескольких дней или недель чтобы позволить плесени расти и образовывать споры. Для достижения данных условий необходимо простое приспособление, известное как влажная камера (рисунок 14).
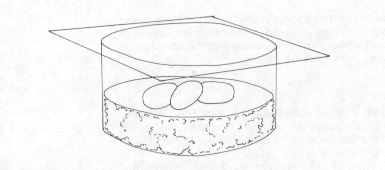
Рис. 14. Влажная камера
Несмотря на разнообразие конструкций влажных камер, все они основаны на помещении материла, который хорошо удерживает влагу, на дно стеклянного контейнера, и на помещении биологического объекта на этот материал. В качестве такого материала чаще всего используются хлопок, бумага, ткань, стерильная почва, песок или торфяной мох. Лучшим из них является торфяной мох, в силу своей способности удерживать влагу на протяжении нескольких недель. При отсутствия сфангума предпочтительнее использовать песок или почву. В случае песка очень важно следить за уровнем влаги, т.к. она испаряется быстрее, чем из почвы или тем более из торфяного моха. Но одновременно важно не переусердствовать и не превратить влагонакопительный материал в грязь. Бумага при некачественном отделении от объекта сама может стать субстратом для роста плесени. При добавлении воды необходимо помнить, что материал и жидкость должны занимать не более четверти всего объема контейнера. После увлажнения материала необходимо поместить один или два слоя фильтровальной бумаги на всю площадь материла, чтобы исследуемый объект не входил в контакт с материалом. Также стеклянный контейнер снабжен не плотно прилегающей крышкой, аналогичным у чашек Петри.
Когда конструкция завершена, а объект готов к переносу, его необходимо слегка увлажнить (если только он уже не достаточно влажный). После помещения объекта на фильтровальную бумагу контейнер помещается в среду с постоянной и необходимой температурой. В течение пары дней будет наблюдаться рост. Несмотря на это, размер некоторых колоний может быть чрезвычайно мал и для установления роста необходимо микроскопирование с увеличением, как минимум, в 15-20 раз и с хорошим освещением. Важно помнить о том, что инструмент, который используется для переноса спор из влажной камеры, не должен соприкасаться с влагоносителем, а только лишь с объектом исследования.
Влажные камеры приспособлены для инкубации различных субстратов. Например, навоза, древесины, листьев, кукурузных стеблей, коры, зерен, фруктов, старых грибов, мертвых насекомых и т.д. Инкубация природных материалов более продуктивна, чем использование тех, что были созданы человеком, но в то же время, старые клочки ткани или кожи могут быть эффективны.
При использовании в качестве субстрата особо маленьких насекомых или зерен имеет смысл использовать в качестве стеклянного контейнера чашку Петри. Внутрь нее помещают несколько слоев фильтровальной бумаги, которая затем смачивается и на нее помещается объект. Не смотря на простоту оборудования такие камеры высыхают довольно быстро и нужно уделять им много внимания. В качестве лучшей альтернативы может служить следующий метод. В литре воды разводится 20 г агара, стерилизуется и заливается в чашку Петри. В виду того, что в агаре практически нет питательных веществ, он будет служить лишь в качестве источника воды». [10]
Прямой посев. В большинстве случаев самым удобным методом будет посев материала сразу на питательную среду с агаром. Эта техника благоприятствует развитию быстро растущих плесеней в угоду другим представителям царства Грибов. Этот простой метод подразделяется на два подметода: помещение объекта исследования на поверхность уже застывшего агара, либо выливание расплавленного, но остывшего агара непосредственно на изучаемый объект. Спустя несколько дней инкубации колонии плесени проявятся и могут быть готовы для переноса в чистую культуру.
Количество материала, используемого при данных способах, зависит от степени обсемененности материала. Эта техника популярна при исследовании почвы. При этом щепотка почвы равномерно распределяется на поверхности застывшего агара. И для посева на поверхности, и для глубинного посева рекомендована среда Мартина с бенгальским розовым. Бенгальский розовый и антибиотик подавят рост микроорганизмов, отличных от грибов и одновременно замедлят рост плесеней, чтобы получить точечные раздельные колонии. Полный состав данной среды представлен в таблице 4.
Таблица 4 - Состав среды Мартина.
| Наименование ингридиента | Масса, вносимая на 1 литр (г) |
| Глюкоза | |
| Пептон | |
| K2HPO4 | 0.5 |
| KH2PO4 | 0.5 |
| MgSO4 - 7H2O | 0.5 |
| Бенгальский розовый | |
| Агар | |
| Дрожжевой экстракт | 0.5 |
| Стрептомицин сульфат |
Посев с разведениями. В этом методе 1 г (сухой вес) объекта исследования разбавляется в пробирке с 9 мл стерильной воды. Если необходимо, объект измельчается до необходимой степени дисперсности. Затем 1 мл полученного раствора помещается в другую пробирку с 9 мл стерильной воды и разбавляется, тем самым получая раствор с 0.01 споровой массы изначального объекта. Процесс повторяется до получения растворов 0.001, 0.0001, и 0.00001 и т.д., если того требует исследование. 1 мл каждого разведения переносится пипеткой на отдельную чашку Петри, и затем расплавленный, остуженный агар заливается сверху. Затем чашку двигают равномерными медленными движениями по форме знака бесконечности для эффективного распределения. Альтернативой этому методу может служить помещение 1 мл на уже застывший агар. В течение нескольких дней возникнут колонии разной плотности засева, в зависимости от степени разведения образца. Для определения колоний в изначальном образце необходимо посчитать количество колоний на чашке Петри, в которой число колоний находится в диапазоне 40-100. Затем полученное число используется в следующей формуле, изображенной на рисунке 15.
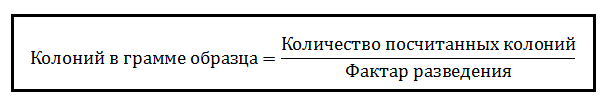
Рис. 15. Формула нахождения числа колоний в 1 г исходного образца.
При использовании этой техники лишь с одной чашкой Петри точность исследования будет низкой. Максимальная точность достигается при одновременном посеве на 10 чашек Петри.
Посев спор, находящихся в воздухе. Споры грибов, переносимые по воздуху, могут служить инфекционными агентами и аллергенами. Отбор проб плесеней с воздушными спорами может проводиться с целью получить результат, пригодный для микроскопирования спор, или с целью микроскопирования колоний. В первом случае мы получаем множество неидентифицируемых спор, в то время как во втором случае получаем лишь те, которые могут образовывать колонии. В большинстве случаев приоритет отдается второму способу.
Самая простая методика культивирования воздушных спор с целью образования колоний включает в себя горизонтальное или вертикальное размещение, содержащих питательную среду с агаром, чашек Петри. На них будут попадать споры, взвешенные в воздухе, и останутся на питательной среде. Для хороших показателей обсеменения образцов достаточно от 30 до 180 мин в случае подготовки образца вне помещения. Если же образец обсеменяется воздухом в здании, то это процедура будет более сложной в силу зависимости от таких факторов, как чистота помещения, тип здания и т.д. Усредненное время для отбора проб внутри здания - 60-120мин.
Независимо от того, проводится отбор проб внутри или снаружи здания, существует вероятность низкого результата. Это связано с тем, что над питательной средой расположен т.н. слой «мертвого воздуха». Любой воздушный поток, несущий в себе споры, будет проходить над массой «мертвого воздуха» и не достигнет поверхности среды. Чтобы решить эту проблему применяется множество устройств, которые объединены принципом действия - всасывание воздуха и продувание его с большой силой на поверхность питательной среды. Пробоотборник Андерсена, один из представителей этой группы, позволяет обсеменять несколько чашек Петри за раз и даже сортирует споры по их размеру или массе. Данное устройство чрезвычайно эффективно, но находит широкое применение лишь в специализированных лабораториях.
«Наживки». Многие плесневые грибы требует особые вещества для питания и специализируются на их переработке, в то время как другие с трудом могут разлагать их или же не иметь такой возможности вовсе. Используя эту особенность можно внести вещество, специфичное для питания определенного вида микроорганизма, и изолировать вид, который будет активно утилизировать это вещество. Примером такого изолирования является Amorphotheca resiniae. Для его изоляции необходимо покрыть деревянные палочки (подойдут спичечные черенки) креозотом и поместить их на образец почвы в чашку Петри на 14-20 дней. Amorphotheca, микроскопический гриб, способный частично разлагать креозот, прорастет из спор в почве и переберется на дерево, образуя на нем многочисленные гифы и конидии. Затем образец A. resiniae переносится на чистую культуру.
«Наживками» могут служить кусочки дерева, мертвые насекомые, ломти моркови, пластик, волосы и т.п. Все они могут быть помещены как в натуральную среду обитания образца, так и во влажную камеру. Например, для изолирования дерматофитов привычно внести волосы на почву во влажной камере и наблюдать за споруляцией.
Самая популярная среда обитания, в которой применяются «наживки» это пресная и морская вода. Очень эффективным является помещение воды из пруда в чашку Петри и несколько кунжутных семян, предварительно нагретых до такой температуры, чтобы они лопнули. В течение 3-4 дней семена будут покрыты оомицетами, хотя и не принадлежащих к царству Грибов, образующих подвижные зооспоры. После полной изоляции и получения чистой культуры образец может быть перенесен на твердую среду, но в ней он может больше не образовать спор, т.к. является водным обитателем.