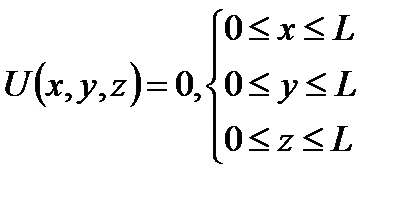
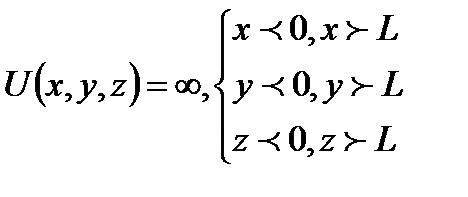
Частица может существовать только внутри потенциальной энергии, поэтому вне ямы волновая функция равна нулю.
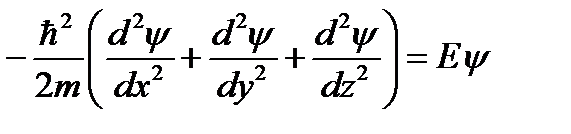
Решение будем искать в виде: 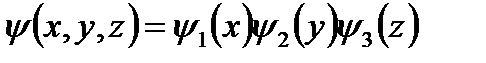
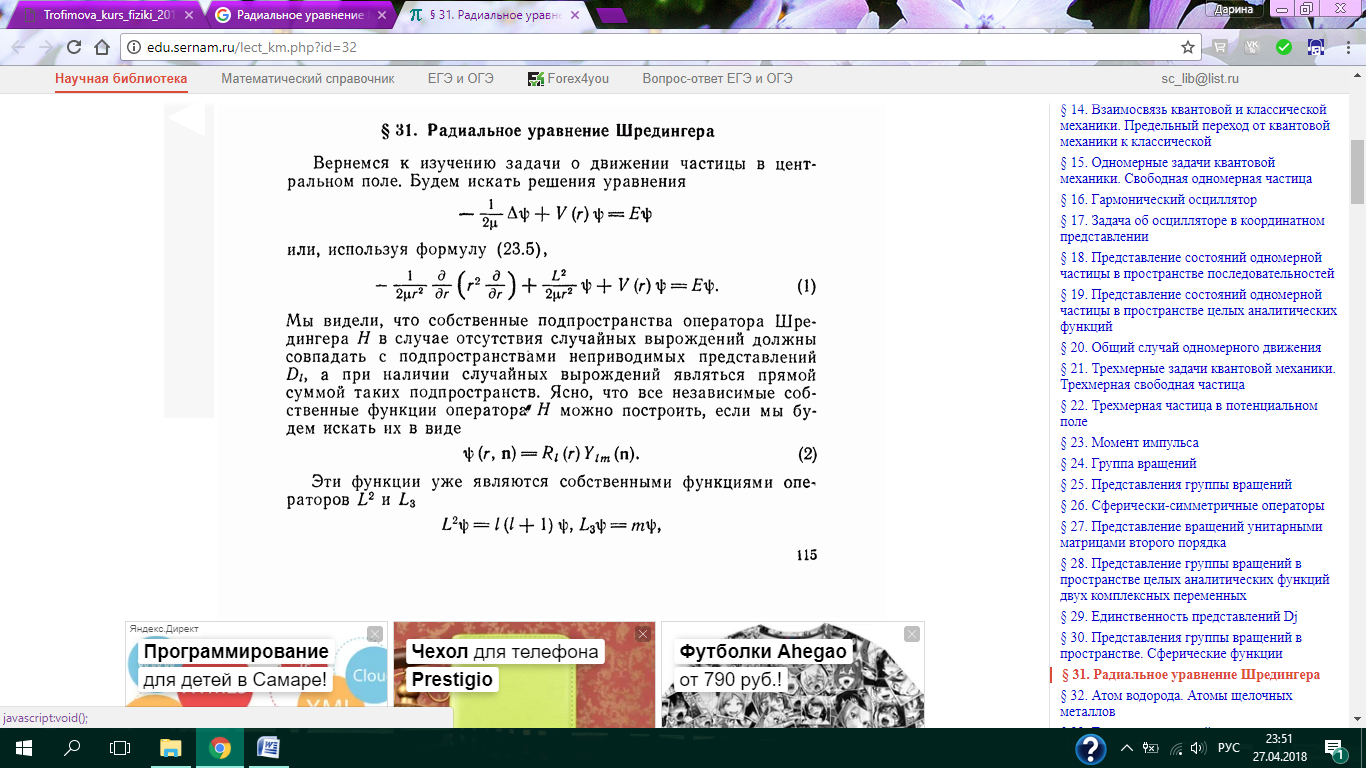
Трёх мерное уравнение Шредингера разбивается на три одномерных уравнения Шредингера.
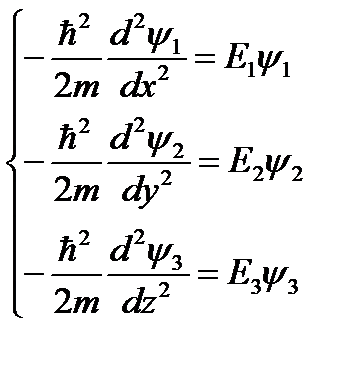
Граничные условия:
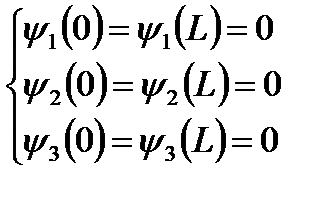
Мы получили три одномерные потенциальные ямы.
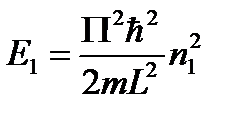
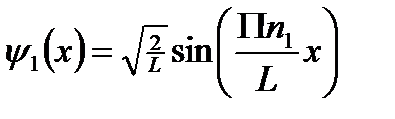
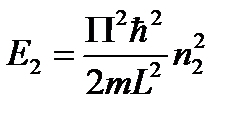
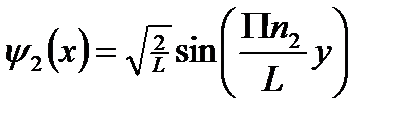
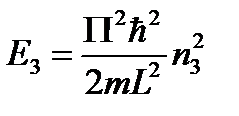
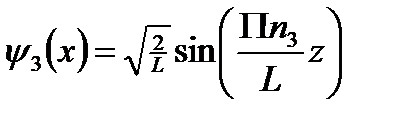
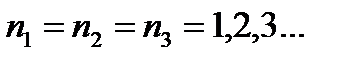
Вырождение энергетических уровней.
Вырождение энергетических уровней -существование двух или более стационарных состояний квантовой системы (атома, молекулы) с одинаковыми значениями энергии. Система, полная энергия которой определяется заданием оператора Я (гамильтониана), может иметь т стационарных состояний, для которых уравнение Шредингера Hφi = Eφi определяет соответствующие волновые функции φi (i = 1, 2,..., т) и одно значение энергии Е, одинаковое для всех т состояний. Энергетический уровень с энергией Е при m ≠ 1 называется вырожденным, число т различных независимых волновых функций - кратностью вырождения уровня. О состояниях с волновыми функциями φiговорят как о состояниях, вырожденных по энергии, или вырожденных состояниях. Если одному значению энергии отвечает одно состояние, т.е. m=1, уровень наз. невырожденным.
Кратность вырождения – число состояний с одинаковой энергией.
В атоме водорода энергия электрона не зависит от квантовых чисел ml, l, ms. Поэтому, состояние, у которого главные квантовые числа одинаковы, а остальные квантовые числа отличаются, называется вырожденным.
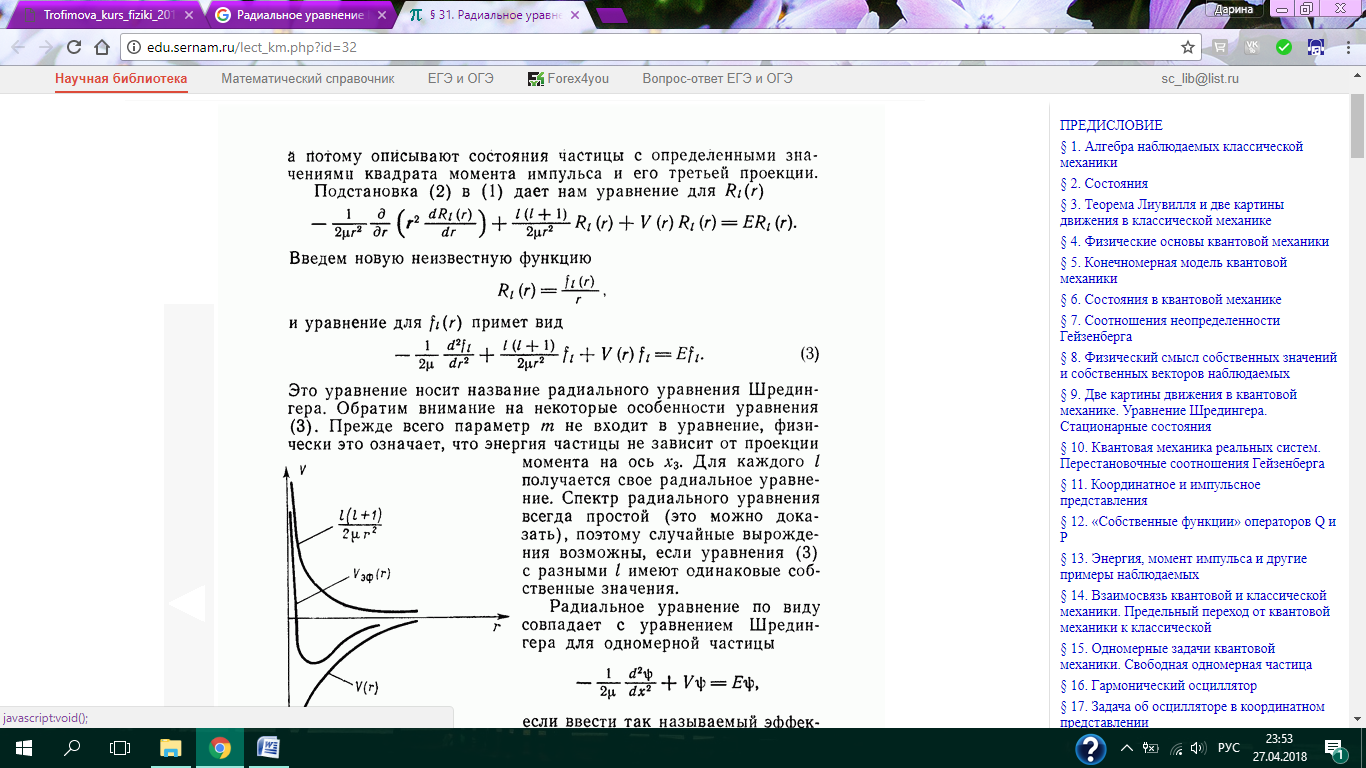
Туннельный эффект. Линейный гармонический осциллятор.
Туннельный эффект.
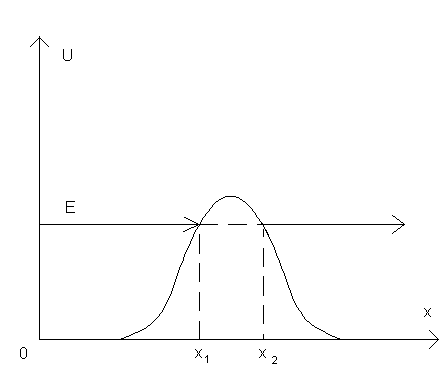
Рассмотрим потенциальный барьер.
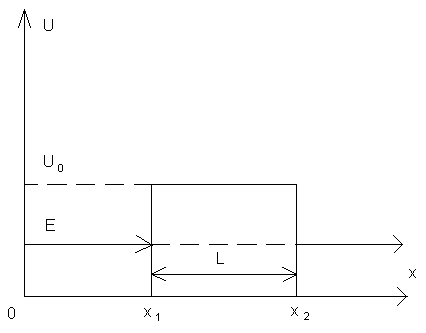
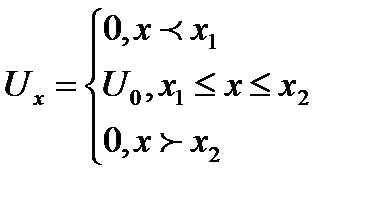
Частица может пройти сквозь потенциальный барьер даже если 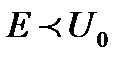 .
.
Коэффициент прохождения:
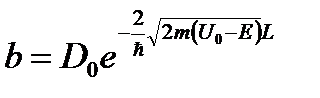 , при
, при 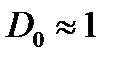
Рассмотрим потенциальный барьер произвольной формы.
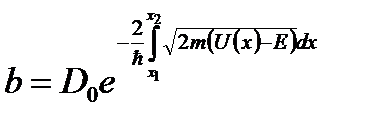 , при
, при 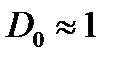
Туннельный эффект может играть существенную роль, если прозрачность барьера не слишком мала. Это возможно, когда линейные размеры барьера соизмеримы с размерами атома.
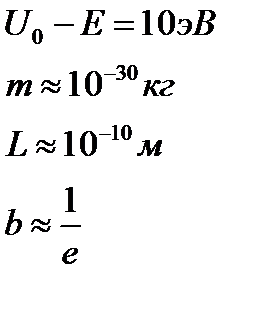
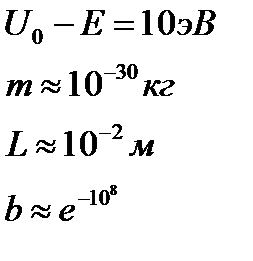
Прозрачность уменьшается, если увеличивается масса частицы и высота потенциального барьера.
Гармонический осциллятор
Рассмотрим одномерную систему, у которой потенциальная энергия пропорциональна квадрату координаты (например, атом в узле кристаллической решётки).
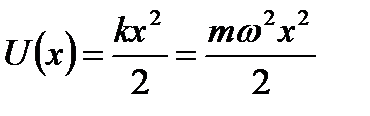
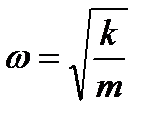
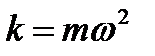
Запишем одномерное уравнение Шредингера.
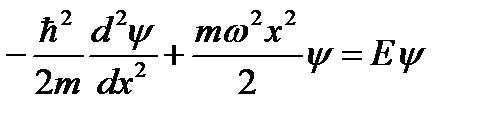
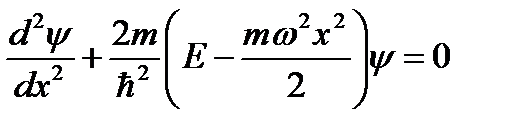
Решение этого уравнения будем искать в виде степенного ряда с неопределёнными коэффициентами.
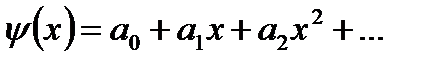
Этот ряд подставим в дифференциальное уравнение и приравняем коэффициенты при одинаковых степенях х. Оказывается, что решение существует только при строго определённых значениях энергии.
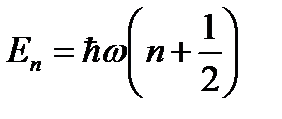
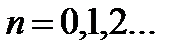
Состояние с наименьшей энергией, когда (n = 0)
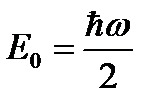
Волновая функция, соответствующая этому состоянию описывает вакуумное состояние. В вакуумном состоянии осциллятор не находится в покое, а совершает небольшие нулевые колебания.
Опыты Резерфорда. Постулаты Бора. Боровская модель атома водорода. Вывод выражения радиуса орбиты электрона, его скорости, кинетической, потенциальной и полной энергии.
Резерфорд исследовал рассеивание α – частиц тонкой золотой фольгой. Опыт показал, что большинство частиц проходит через фольгу, почти не отклоняясь от начального направления, но имелись отдельные частицы, отклонившиеся на большие углы 135о~140о~150о.
Резерфорд предположил, что весь положительный заряд атома сосредоточен в его ядре. Ядро – область малого, по сравнению с атомом, размера. Рассеивание - частиц на ядре маловероятно, поэтому большинство частиц испытывают незначительное отклонение. Однако некоторые частицы проходят вблизи ядра и испытывают большое отклонение.
Ядерная модель атома.
В ядре, размер которого порядка 10-15 м сосредоточена практически вся масса атома. Ядро обладает положительным зарядом. Вокруг ядра в области размером порядка 10-8 м движутся электроны. Электроны заряжены отрицательно. Суммарный заряд электронов по модулю равен заряду ядра. Суммарная масса электронов мала по сравнению с массой ядра.
Ядерная модель Резерфорда похожа на солнечную систему (ядро – солнце, электроны - планеты), поэтому эту модель также называют планетарной.
Планетарная модель атома противоречит классической электродинамике. Если электроны двигаются по круговой орбите, то они должны непрерывно излучать электромагнитные волны. Излучая, электрон теряет энергию и падает на ядро. Однако опыт показывает, что атом устойчивая система.
Чтобы согласовать теорию и опыт Бор предложил постулаты.
Постулаты Бора:
1. электрон в атоме водорода равномерно вращается вокруг ядра по круговой орбите под действием силы Кулона в соответствии с законами Ньютона.
2. из всех возможных орбит разрешёнными являются только те, для которых момент импульса электрона равен целому числу, умноженному на приведённую постоянную Планка.
3. при движении электрона по разрешённой орбите атом не излучает.
4. при переходе электрона с одной разрешённой орбиты на другую атом излучает или поглощает фотон с частотой 
Постулаты Бора справедливы для водорода и водородоподобных атомов.
Водородоподобные атомы – атомы, у которых только один электрон (Н z=1, Не* z=2, Li** z=3; z – порядковый номер).
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение  (208.1), где Е0 — электрическая постоянная; mc и v — масса и скорость электрона на орбите радиусом г., предложенное Резерфордом, и уравнение
(208.1), где Е0 — электрическая постоянная; mc и v — масса и скорость электрона на орбите радиусом г., предложенное Резерфордом, и уравнение
 (210.1) получим выражение для радиуса п-и стационарной орбиты:
(210.1) получим выражение для радиуса п-и стационарной орбиты:  (212.1) где п= 1,2,3,.... Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
(212.1) где п= 1,2,3,.... Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z = 1) радиус первой орбиты электрона при п = 1, называемый первым воровским радиусом (а), равен  что соответствует расчетам на основании кинетической теории газов.
что соответствует расчетам на основании кинетической теории газов.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (и потенциальной энергии в электростатическом поле ядра 

([учли, что  см. (208.1)]. Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
см. (208.1)]. Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:  , где знак «--» означает, что электрон находится в связанном состоянии
, где знак «--» означает, что электрон находится в связанном состоянии
Опыт Франка-Герца.

Изучая методом задерживающего потенциала столкновения электронов с атомами газов (1913), Д.Франк и Г. Герц экспериментально доказали дискретность значений энергии атомов. Принципиальная схема их установки приведена на рис. 295. Вакуумная трубка, заполненная парами ртути (давление приблизительно равно 13 Па), со- держала катод (К), две сетки (С1 и С2) и анод (А). Электроны, эмиттируемые катодом, ускорялись разностью потенциалов, приложенной между катодом и сеткой С1. Между сеткой С2 и анодом приложен небольшой (примерно 0,5 В) задерживающий потенциал. Электроны, ускоренные в области 7, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома.
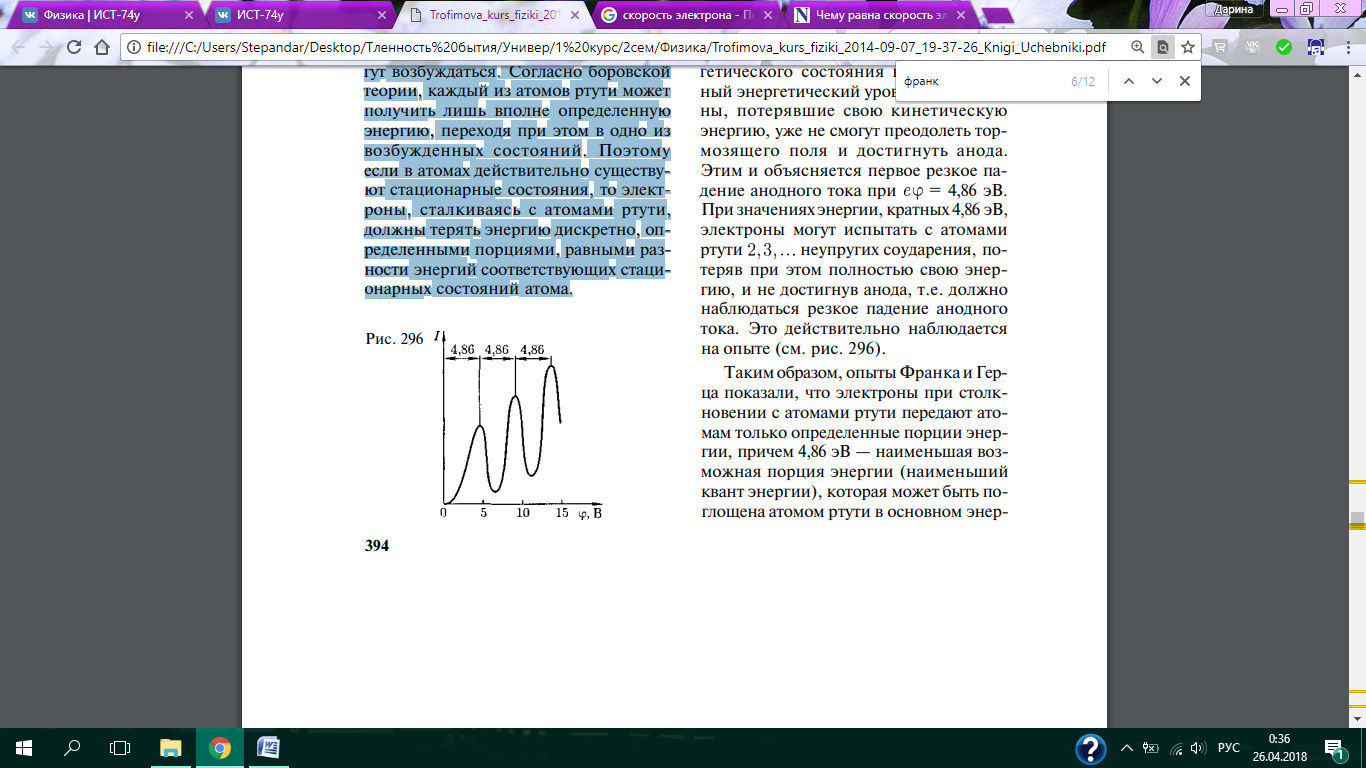 Из опыта следует (рис. 296), что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при 2-4,86 и 3-4,86 В. Ближайшим к основному, невозбужденному, состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения.
Из опыта следует (рис. 296), что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при 2-4,86 и 3-4,86 В. Ближайшим к основному, невозбужденному, состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения.
При  энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящего поля и достигнуть анода. Этим и объясняется первое резкое падение анодного тока при
энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящего поля и достигнуть анода. Этим и объясняется первое резкое падение анодного тока при  При значениях энергии, кратных 4,86 эВ, электроны могут испытать с атомами ртути 2,3,... неупругих соударения, потеряв при этом полностью свою энергию, и не достигнув анода, т.е. должно наблюдаться резкое падение анодного тока. Это действительно наблюдается на опыте (см. рис. 296). Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ — наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку. Атомы ртути, получившие при соударении с электронами энергию АЕ, переходят в возбужденное состояние и должны возвратиться в основное, излучая при этом, согласно второму постулату Бора [см. (210.2)], световой квант с частотой ν = Δ E / h. По известному значению АЕ = 4,86 эВ можно вычислить длину волны излучения: λ = hс / Δ E ≈ 255 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с X≈255 нм. Опыт действительно обнаруживает одну ультрафиолетовую линию с X≈254 нм. Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора. Эти опыты имели огромное значение в развитии атомной физики.
При значениях энергии, кратных 4,86 эВ, электроны могут испытать с атомами ртути 2,3,... неупругих соударения, потеряв при этом полностью свою энергию, и не достигнув анода, т.е. должно наблюдаться резкое падение анодного тока. Это действительно наблюдается на опыте (см. рис. 296). Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ — наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку. Атомы ртути, получившие при соударении с электронами энергию АЕ, переходят в возбужденное состояние и должны возвратиться в основное, излучая при этом, согласно второму постулату Бора [см. (210.2)], световой квант с частотой ν = Δ E / h. По известному значению АЕ = 4,86 эВ можно вычислить длину волны излучения: λ = hс / Δ E ≈ 255 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с X≈255 нм. Опыт действительно обнаруживает одну ультрафиолетовую линию с X≈254 нм. Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора. Эти опыты имели огромное значение в развитии атомной физики.
Квантово-механическая теория атома водорода. Уравнение Шредингера для атомов Н. Квантование энергии, момента импульса. Главное квантовое число. Орбитальное квантовое число. Простое квантование момента импульса. Магнитное квантовое число. Опыт Штерна-Герлаха. Спин. Спиновое квантовое число.
Используя уравнение Шредингера — основное уравнение динамики в нерелятивистской квантовой механике, в принципе, можно рассмотреть задачу о кристалле, например, найти возможные значения его энергии, а также соответствующие энергетические состояния. Однако как в классической, так и в квантовой механике отсутствуют методы точного решения динамической задачи для системы многих частиц. Поэтому эта задача решается приближенно сведением задачи многих частиц к одноэлектронной задаче об одном электроне, движущемся в заданном внешнем поле. Подобный путь приводит к зонной теории твердого тела. В основе зонной теории лежит так называемое адиабатическое приближение. Квантово-механическая система разделяется на тяжелые и легкие частицы — ядра и электроны. Поскольку массы и скорости этих частиц значительно различаются, можно считать, что движение электронов происходит в поле неподвижных ядер, а медленно движущиеся ядра находятся в усредненном поле всех электронов. Принимая, что ядра в узлах кристаллической решетки неподвижны, движение электрона рассматривается в постоянном периодическом поле ядер. Далее используется приближение самосогласованного поля. Взаимодействие данного электрона со всеми другими электронами заменяется действием на него стационарного электрического поля, обладающего периодичностью кристаллической решетки. Это поле создается усредненным в пространстве зарядом всех других электронов и всех ядер. Таким образом, в рамках зонной теории многоэлектронная задача сводится к задаче о движении одного электрона во внешнем периодическом поле — усредненном и согласованном поле всех ядер и электронов.
Уравнение Шредингера для атома водорода в декартовых координатах:
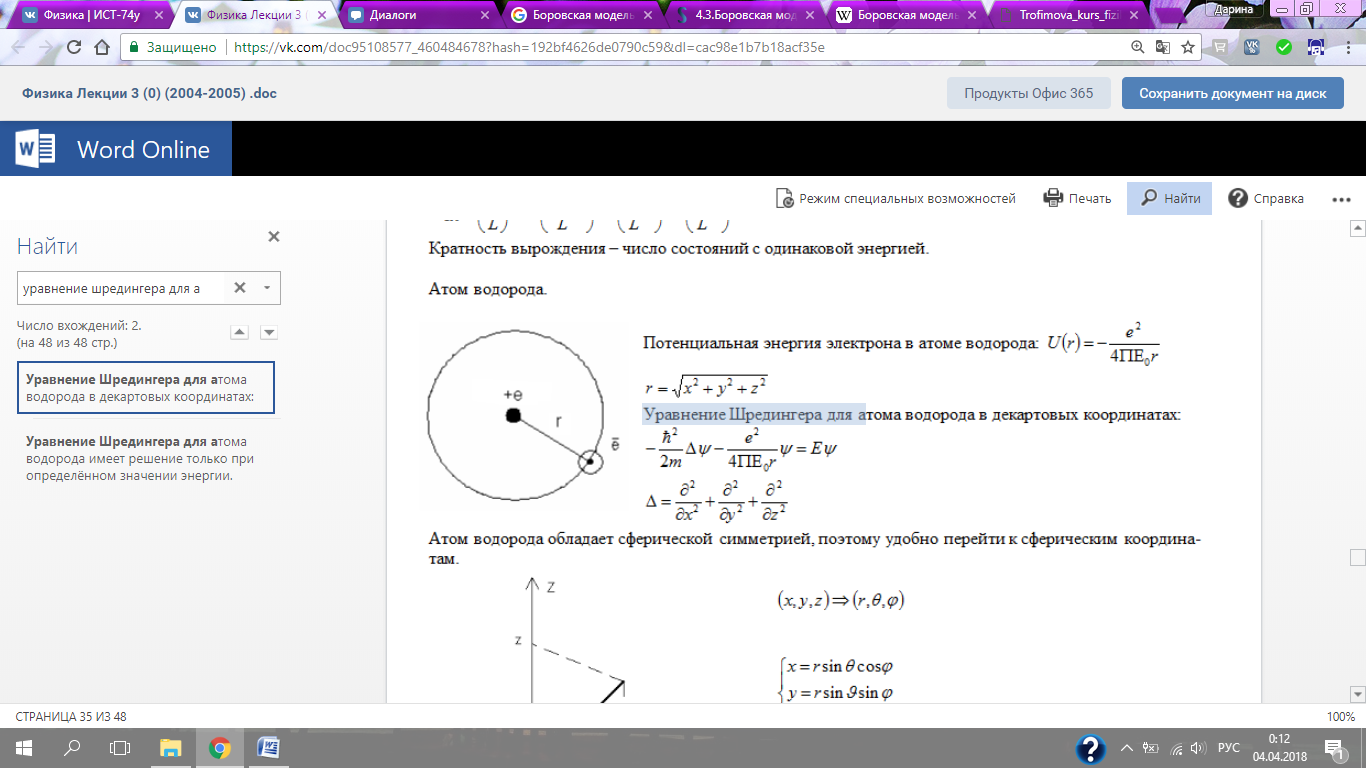
Атом водорода обладает сферической симметрией, поэтому удобно перейти к сферическим координатам.
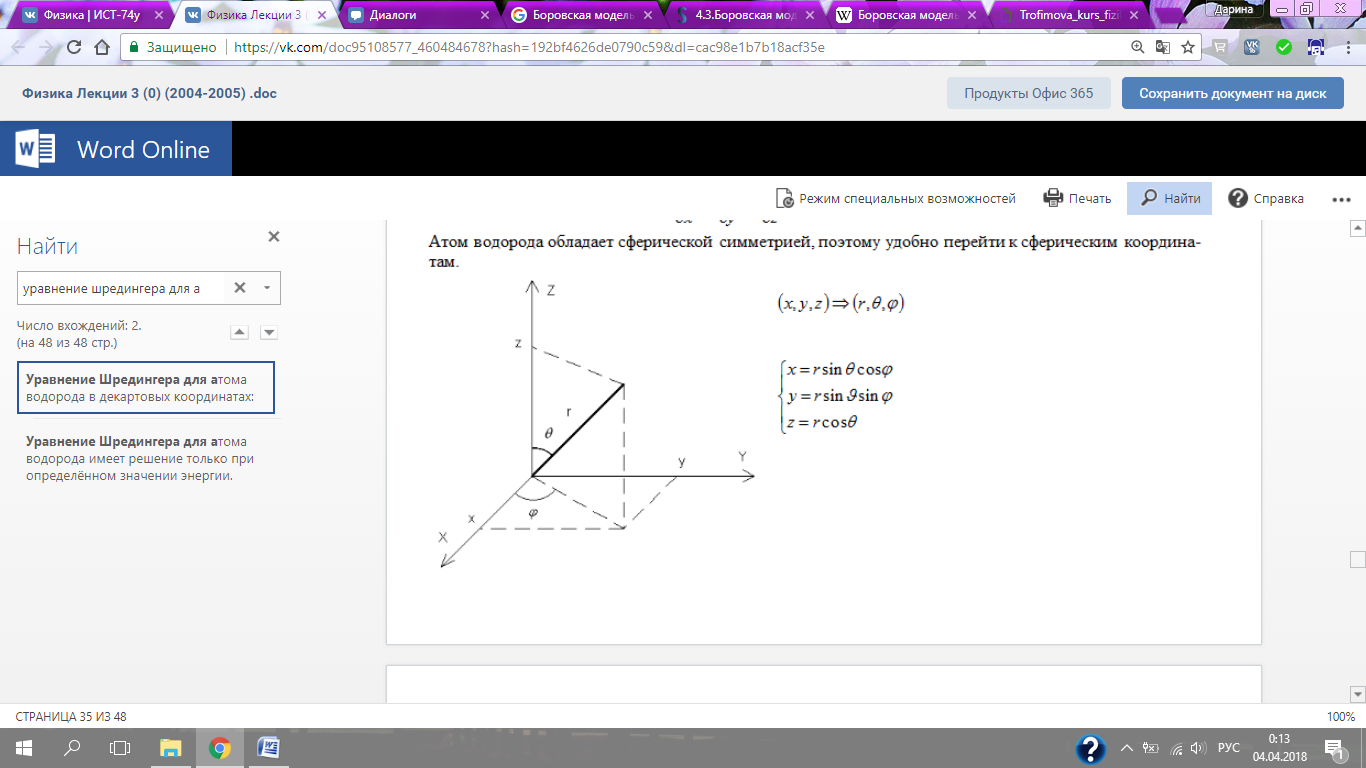
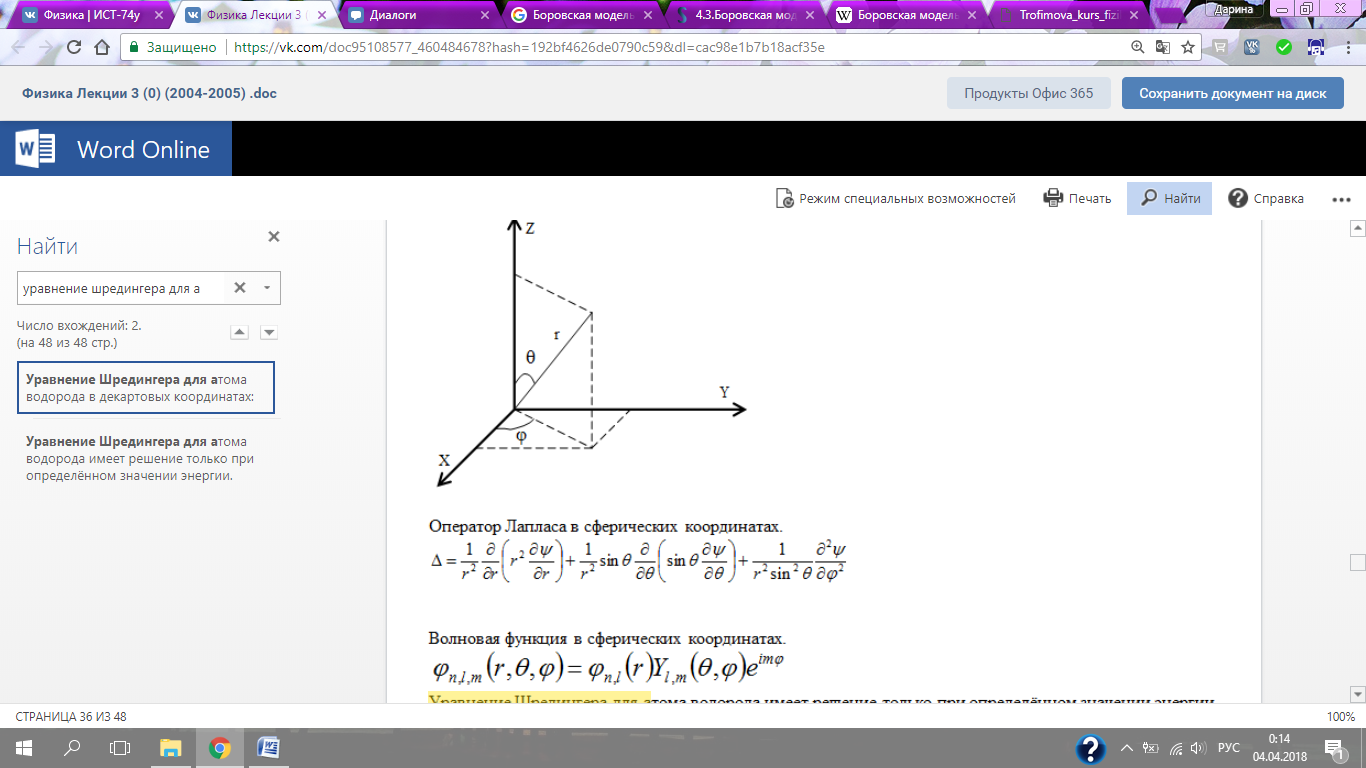
Оператор Лапласа в сферических координатах.

Волновая функция в сферических координатах.

Уравнение Шредингера для атома водорода имеет решение только при определённом значении энергии.
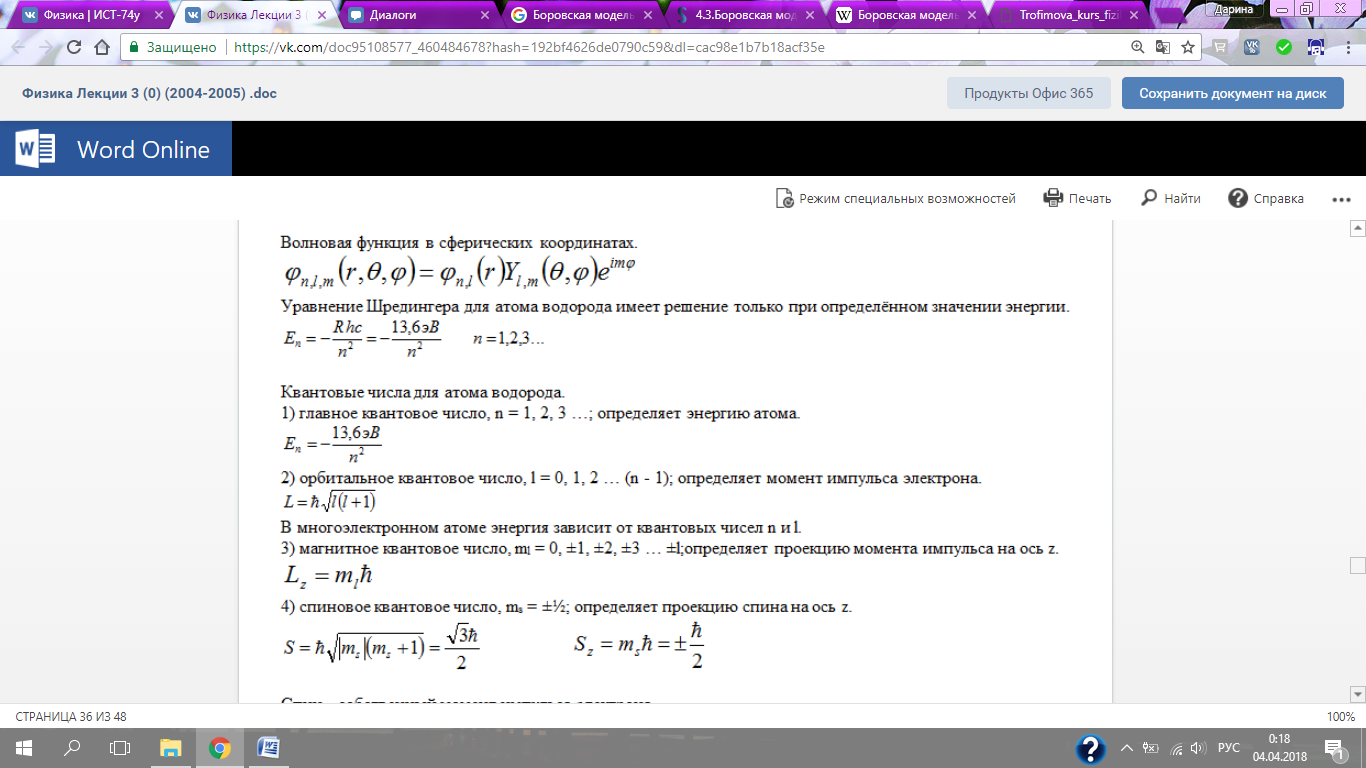
Квантовые числа для атома водорода.
1) главное квантовое числ о, n = 1, 2, 3 …; определяет энергию атома.
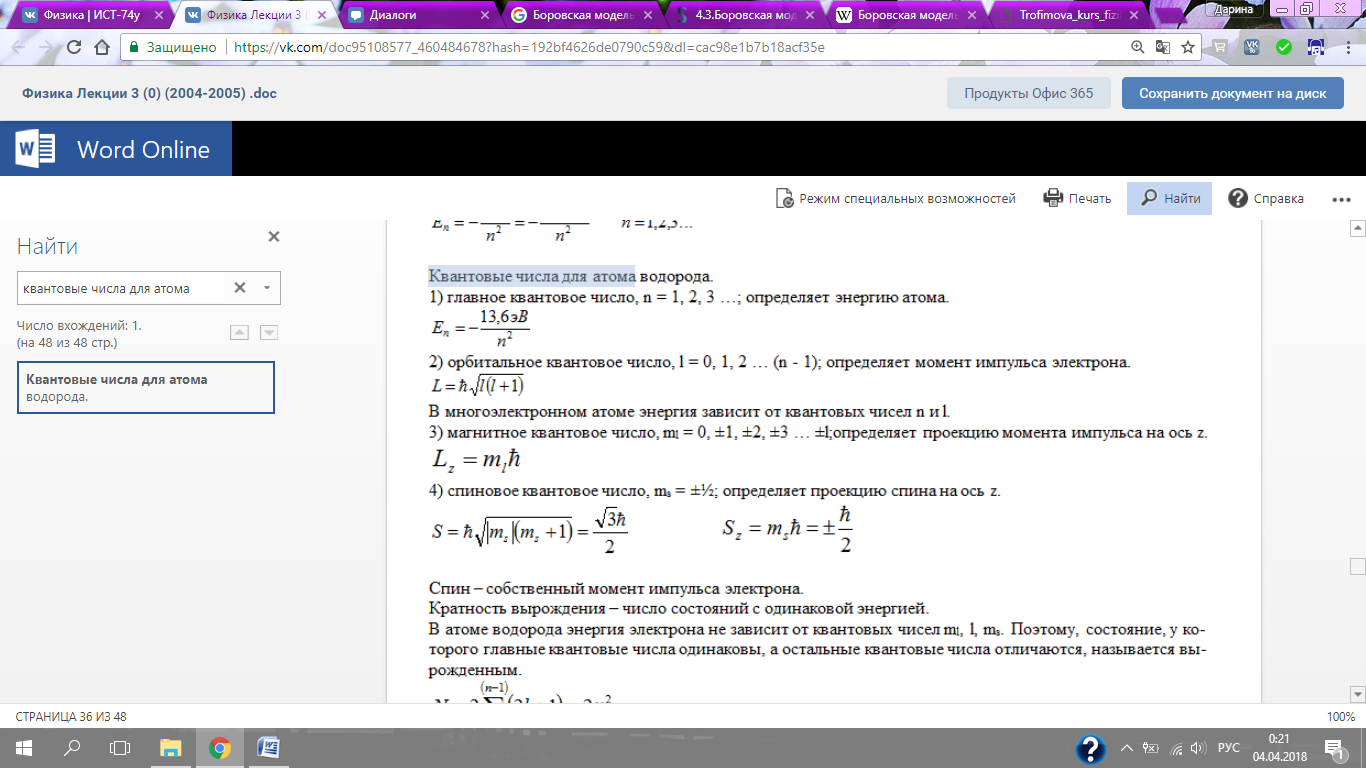
2) орбитальное квантовое число, l = 0, 1, 2 … (n - 1); определяет момент импульса электрона.

В многоэлектронном атоме энергия зависит от квантовых чисел n и l.
3) магнитное квантовое число, ml = 0, ±1, ±2, ±3 … ±l; определяет проекцию момента импульса на ось z.

4) спиновое квантовое число, ms = ±½; определяет проекцию спина на ось z.
О.Штерн и В.Герлах, проводя прямые измерения магнитных моментов, обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю. Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту, поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т.е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные липни атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Спин – собственный момент импульса электрона.
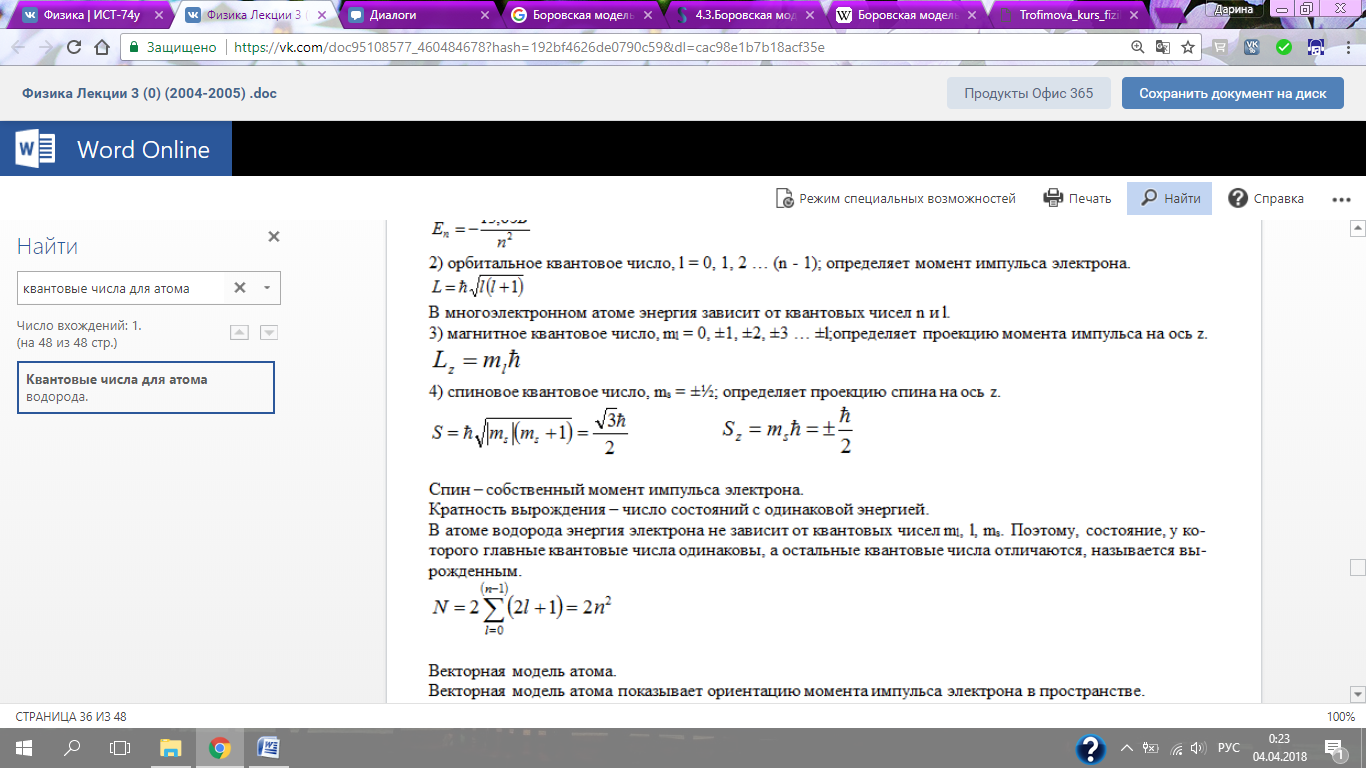
Кратность вырождения – число состояний с одинаковой энергией.
В атоме водорода энергия электрона не зависит от квантовых чисел ml, l, ms. Поэтому, состояние, у которого главные квантовые числа одинаковы, а остальные квантовые числа отличаются, называется вырожденным.


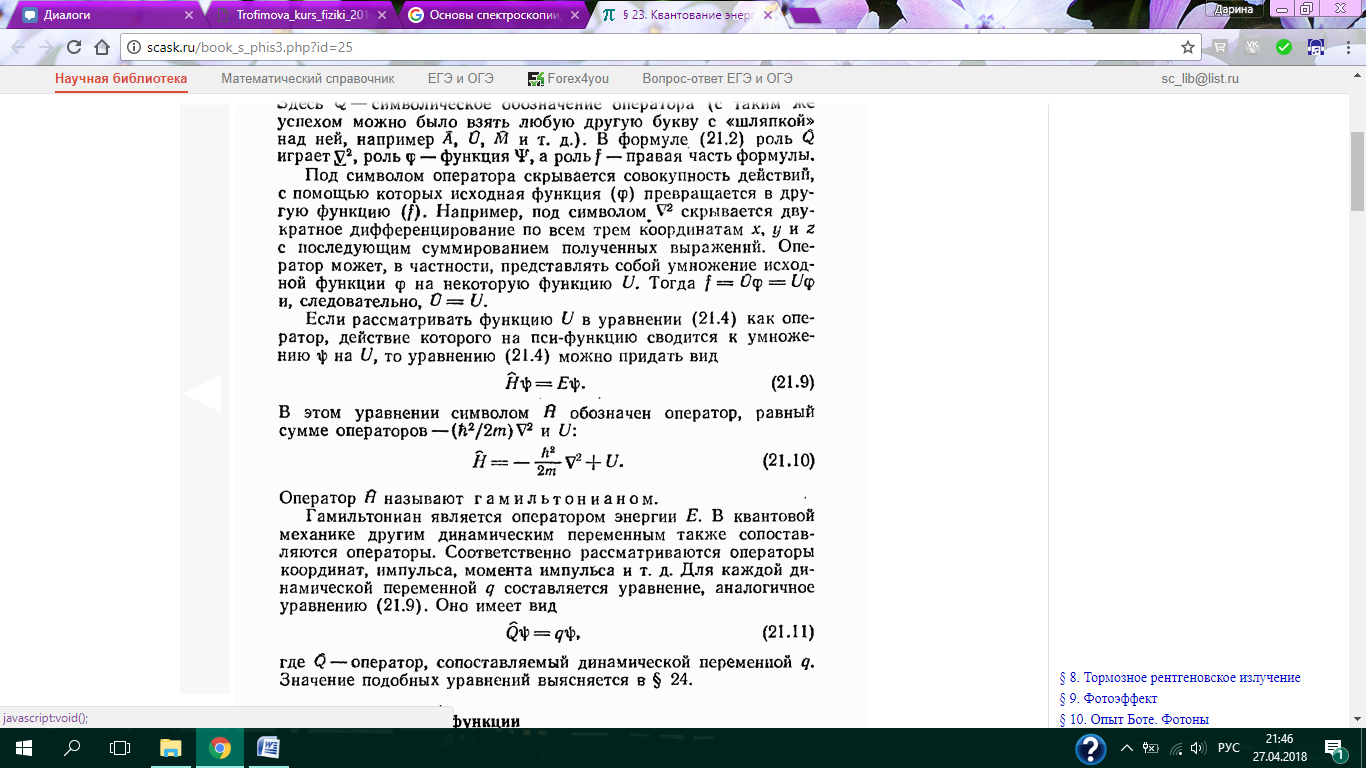
Уравнение 21.9, которое встречается в тексте выше:
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые по формуле
 где l — орбитальное квантовое число, которое при заданном п принимает значения
где l — орбитальное квантовое число, которое при заданном п принимает значения  т.е. всего п значений, и определяет момент импульса электрона в атоме. Из решения уравнений Шредингера следует также, что вектор Li момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направле-ние z внешнего магнитного поля принимает квантованные значения, кратные h:
т.е. всего п значений, и определяет момент импульса электрона в атоме. Из решения уравнений Шредингера следует также, что вектор Li момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направле-ние z внешнего магнитного поля принимает квантованные значения, кратные h:  где mi ~ магнитное квантовое число, которое при заданном l может принимать значения mi = 0,±1,±2,...,±1, (223.7) т.е. всего 2l + 1 значений. Таким образом, магнитное квантовое число mi, определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 21 + 1 (два эль плюс один) ориентации.
где mi ~ магнитное квантовое число, которое при заданном l может принимать значения mi = 0,±1,±2,...,±1, (223.7) т.е. всего 2l + 1 значений. Таким образом, магнитное квантовое число mi, определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 21 + 1 (два эль плюс один) ориентации.
Радиальное уравнение Шредингера 1S-состояния атома Н. Энергия электрона. Волновая функция основного состояния атома водорода. Энергия электрона и наиболее вероятное расстояние электрона до ядра в 1S-состоянии.
Энергия электрона (см.вопрос 60)
Квантовые числа и их значения являются следствием решений уравнений Шредингера и условий однозначности, непрерывности и конечности, налагаемых па волновую функцию  . Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Наиболее вероятное расстояние электрона от ядра точно совпадает с радиусом первой боровской орбиты. увеличивается, так что орбиталь становится более размытой.
Так, если вспомнить водородоподобные атомы, то для орбитали Is наиболее вероятное расстояние электрона от ядра равно а0 / Z, где а0 – боровский радиус (0 529 A), Z - заряд ядра, так что для атома углерода, если подобная оценка годится, это расстояние будет - 0 09 А, а для атомов с большими величинами Z - и того меньше. Эти орбитали с наиболее низкими каноническими орбитальными энергиями для более высоких по энергии орбиталей играют роль своего рода оболочки, экранирующей ядро атома. Низшие по энергии, сильно локализованные орбитали называются обычно остовными орбиталя-ми, а более высокие - валентными. Название валентные связано с тем, что именно эти атомные орбитали служат основой построения молекулярных орбиталей, дают в них главный вклад, тогда как остовные орбитали при образовании молекулы из атомов в существенной степени сохраняют свой атомоподобный характер.