В качестве исходного вещества для установки титра KMnO4 чаще всего употребляют щавелевую кислоту.
Установка нормальности раствора KMnO4 по химически чистой щавелевой кислоте основана на реакций:
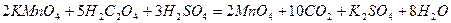


Отмерьте пипеткой 10мл раствора щавелевой кислоты и прибавив 6мл  , нагрейте жидкость до 75-800С. Полученный раствор оттитруйте раствором KMnO4, раствор поместить в бюретку, и все отчеты делайте по верхнему краю мениска. При этом первые 1-2мл. раствора KMnO4 приливают очень медленно по каплям, добавляя каждую из них после обесцвечивания предыдущей и сильно перемешивая раствор. По мере накопления в растворе продуктов реакции обесцвечивания KMnO4 будет происходить значительно быстрее. Титрование раствором KMnO4 производится до получения не исчезающей в течение 1-2 минуты бледно-розовой окраски раствора, обусловленной наличием и избыточной капли окислителя. Если получившиеся розовая окраска раствора исчезает после продолжительного стояния, то на него не следует обращать внимание. Титрование повторяют 2-3 раза. От полученных данных возьмите среднее.
, нагрейте жидкость до 75-800С. Полученный раствор оттитруйте раствором KMnO4, раствор поместить в бюретку, и все отчеты делайте по верхнему краю мениска. При этом первые 1-2мл. раствора KMnO4 приливают очень медленно по каплям, добавляя каждую из них после обесцвечивания предыдущей и сильно перемешивая раствор. По мере накопления в растворе продуктов реакции обесцвечивания KMnO4 будет происходить значительно быстрее. Титрование раствором KMnO4 производится до получения не исчезающей в течение 1-2 минуты бледно-розовой окраски раствора, обусловленной наличием и избыточной капли окислителя. Если получившиеся розовая окраска раствора исчезает после продолжительного стояния, то на него не следует обращать внимание. Титрование повторяют 2-3 раза. От полученных данных возьмите среднее.
Контрольные вопросы для самопроверки
1. Методы окислительно- восстановительного титрования и способы его проведения.
2. Почему перманганат калия можно титровать без индикатора? В какой среде можно проводить перманганатометрическое титрование?
3. Рассчитайте значение потенциала в точке эквивалентности при
перманганатометрическом титровании нитрит-ионов.
4. Сущность перманганатометрии.
5. Назовите плюсы и минусы данного метода.
Лабораторная работа
| Тема: | Определение железа в растворе Соли Мора | ||
| Цель работы: | определить содержание железа в растворе соли Мора. В результате выполнения работы студенты должны уметь: - проводить титрование; - писать уравнение реакции определения железа. должны знать: - сущность метода определения содержания железа в соли Мора. | ||
| Приборы, материалы и инструмент | штатив, бюретка, раствор перманганата калия, индикатор, соль Мора, колба, серная кислота, воронка. | ||
| Порядок выполнения лабораторной работы | 1. Произвести опыт и рассчитать содержание железа. 2. Ответить на контрольные вопросы. 3. Подготовить отчет и приготовиться к защите лабораторной работы. | ||
Теоретическая часть
Перманганатометрия – метод окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.
Перманганатометрию используют в следующих целях:
1 Определение восстановителей.
2 Определение окислителей.
3 Определение веществ, не обладающих окислительно-восстановительными свойствами, проводят косвенным способом, например титрованием по замещению.
4 Определение органических соединений.
Определение железа состоит в том, что соль железа титруют раствором  . Происходящая при этом реакция:
. Происходящая при этом реакция:
