Определение свободной серной кислоты основано на реакций:
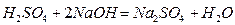
Около 10г. кристаллического сульфата аммония, взвешенного с погрешностью не более 0,001г, помещают в стакан вместительностью 100-150 см3, опускают туда же магний и приливают 50см3 воды. Содержимое стакана перемешивают электромагнитной мешалкой до полного растворения сульфата аммония. Затем электроды рН метра опускают в жидкость так, чтобы шарик стеклянного электрода был полностью погружен в раствор и титрируют анализируемую пробу сульфата аммония 0,01н раствором гидроокиси Naдо рН 5,65. По достижений этого значения рН титрование прекращают и через 1 минуту проверяют значение рН раствора. Отсчитывают объем раствора гидроокиси Na, израсходованный на титрование пробы до рН 5,65.
Расчет: Массовую долю свободной серной кислоты (х) в процентах вычисляют по формуле:

v- объем точно 0,01н раствора гидроокиси Na, израсходованный на титрование, мл
0,00049-массе серной кислоты, соответствующая 1мл 0,01н растворе гидроокиси Na, г
m- масса навески сульфата аммония.
Контрольные вопросы для самопроверки
1. Дайте характеристику потенциометрии.
2. Виды потенциометрии.
3. Почему в мерную колбу сначала наливают дистиллированную воду, а затем количественно переносят серную кислоту?
4. Какие индикаторы, кроме метилового оранжевого, можно использовать при титровании серной кислоты щелочью? Обоснуйте свой выбор.
Лабораторная работа
| Тема: | Определение щелочности поглотительного раствора | ||
| Цель работы: | определить щелочность поглотительного раствора. В результате выполнения работы студенты должны уметь: - производить расчет массовой доли бикарбонатов, карбонатов и общей щелочности. должны знать: - сущность поглотительного титрования; - правила работы на рН – метре. | ||
| Приборы, материалы и инструмент | поглотительный раствор, химический стакан, рН-метр, дистиллированная вода, раствор соляной кислоты. | ||
| Порядок выполнения лабораторной работы | 1. Провести измерение. 2. Рассчитать массовую долю бикарбонатов, карбонатов и общую щелочность. 3. Ответить на контрольные вопросы. 4. Подготовить отчет и приготовиться к защите лабораторной работы. | ||
Теоретическая часть
Сущность метода заключается в поглотительном титрований до определенного значения рН. Общую щелочность находят расчетным путем, как сумму карбонатной и бикарбонатной.
Порядок выполнения работы
Отбирают 5мл. поглотительного раствора, помещают в стакан для титрования, добавляют 40-50мл воды, погружают стеклянный и хлорсеребряный электроды, включают мешалку и измеряют рН раствора. Если рН<12-12,5, то прибавляют 0,5н раствора HCl до рН=11,3, а затем до рН=8,2
Расчет: Массовую долю бикарбонатов х, карбонатов х1, общую щелочность х2 находят по формуле:
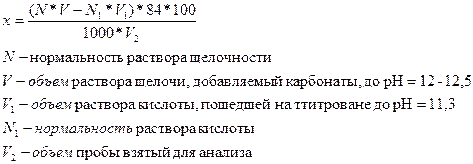

Общая щелочность рассчитывается по формуле:

Контрольные вопросы для самопроверки
1. Устройство и принцип работы рН-метра.
2. Определение карбонатов и бикарбонатов.
Лабораторная работа
| Тема: | Определение концентраций ионов Na в поглотительном растворе вакуум – карбонатной сероочистки (для С=12*36г/л) | ||
| Цель работы: | определение концентраций ионов Na в поглотительном растворе. В результате выполнения работы студенты должны уметь: - проводить измерения разности потенциалов в зависимости от концентраций раствора. должны знать: - сущность потенциометрии; - виды потенциометрии. | ||
| Приборы, материалы и инструмент | и ономер ЭВ-74, электрод сравнения, хлорсеребряный ЭВЛ-IМ, электрод индикаторный, обратимый к ионам Na ЭСЛ-5I-07, мешалка магнитная, стакан на 10мл, колба мерная на 200мл, синтетическая смесь с известным содержанием ионов Na, близкая по составу производственному поглотительному раствору. | ||
| Порядок выполнения лабораторной работы | 1. Приготовление растворов для построения графика. 2. Измерения разности потенциалов в зависимости от концентраций раствора. 3. Проведение анализа. 4. Обработка результатов. 5. Ответить на контрольные вопросы. 6. Подготовить отчет и приготовиться к защите лабораторной работы. | ||
Теоретическая часть
Потенциометрия – метод анализа, основанный на зависимости равновесного электродного потенциала Е от термодинамической активности а компонентов электрохимической реакции: aА + bВ +... + nе mМ + рP + Эта зависимость описывается уравнением Нернста.
При потенциометрических измерениях составляют гальванический элемент с индикаторным электродом, потенциал которого зависит от активности хотя бы одного из компонентов электрохимической реакции, и электродом сравнения и измеряют электродвижущую силу (эдс) этого элемента
В потенциометрии используют гальванические элементы без переноса, когда оба электрода помещают в один и тот же исследуемый раствор, и с переносом, когда электроды находятся в разных растворах, имеющих между собой электролитический контакт. Метод основан на применений прямого потенциометрического измерения ЭДС цепи, состоящих из 2-х электродов (сравнения и индикаторного), опущенных в анализируемый раствор. Концентрацию ионов Na находят по градировочного графику.
Потенциометрические методы анализа широко используют для автоматизации контроля технологических процессов в химической, нефтехимической, пищевой и других отраслях промышленности, в медицине, биологии, геологии, а также при контроле загрязнений окружающей среды.