Для разработки эффективных методов лечения наследственных и приобретенных заболеваний человека, а также для полного понимания их этиологии требуется моделирование соответствующих симптомов на лабораторных животных. В этом случае проблема заключается в направленном введении мутаций в гены организма животных, инактивация которых приводит к развитию патологических процессов. Разработка эффективных методов получения трансгенных животных позволила исследователям вплотную подойти к решению данного вопроса.
Основой для решения послужили две работы, выполненные М. Хупером и М. Куэном с соавторами и опубликованные в 1987 г. Авторам удалось разработать общий подход к избирательной инактивации генов в организме животных. Мишенью для инактивации стал ген гипоксантин-гуанозин-фосфорибозилтрансферазы (ГГФРТ), нефункциональное состояние которого у человека приводит к развитию заболевания Леша–Нихана. Мышей, дефектных по гену ГГФРТ, получали из эмбриональных стволовых клеток линии ES, инактивируя ген с помощью спонтанных мутаций или интегрируя в него геном ретровирусов (разновидность инсерционного мутагенеза). Клетки с инактивированным геном ГГФРТ удобно отделять от клеток дикого типа на селективной питательной среде в присутствии 6-тиогуанина. Позднее было показано, что инактивация гена ГГФРТ может быть достигнута путем гомологичной рекомбинации гена дикого типа с мутантным геном или его частью, которые вводят в клетки ES с помощью электропорации или микроинъекций в составе линеаризованных векторных плазмид. Основная проблема, возникающая при инактивации гена-мишени с помощью гомологичной рекомбинации, заключается в низкой частоте (~10-6) рекомбинационных событий, приводящих к правильной интеграции экзогенной последовательности нуклеотидов в инактивируемый ген. Эта проблема в настоящее время решается путем отбора требуемых мутантных клеток из общей популяции клеток, в которых интеграция инактивирующего вектора в хромосомы произошла случайным образом.
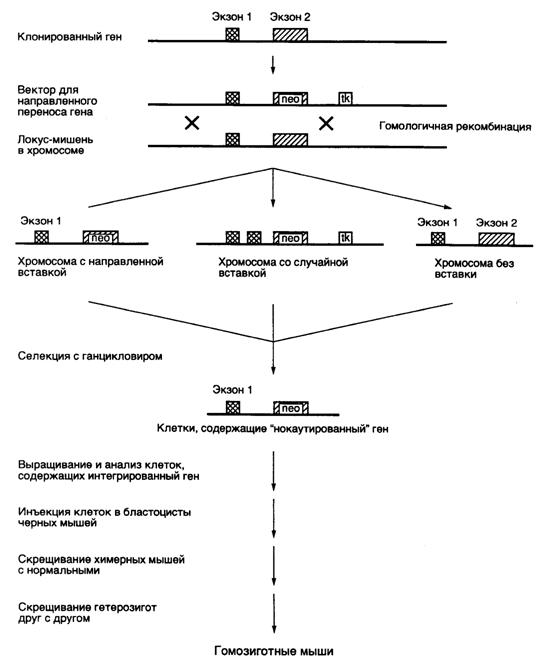
Рис. II.29. Схема адресной доставки генов в геном эмбриональных стволовых клеток с использованием гомологичной рекомбинации ("генный нокаут")
Показано положение гена устойчивости к неомицину (neo), интегрированного в экзон 2 инактивируемого гена, который используется для позитивного отбора, а также гена тимидинкиназы вируса простого герпеса (tk), используемого для негативной селекции клеток в присутствии ганцикловира
Чтобы создать селективные условия отбора, в последовательности нуклеотидов рекомбинантной ДНК, гомологичные последовательностям инактивируемого гена, вводят доминантный селектируемый маркер в виде гена устойчивости к антибиотикам (например neo), который экспрессируется только в случае правильной интеграции в ген-мишень под контроль его регуляторных элементов. Другая, более эффективная система отбора основана на одновременном проведении негативной и позитивной селекции клеток, у которых произошла правильная интеграция инактивирующего вектора. В этой системе помимо доминантного селектируемого маркера neo инактивирующий вектор содержит другой маркерный ген, экспрессия которого приводит к гибели клеток ES на селективной среде. Маркерным геном часто является ген тимидинкиназы вируса простого герпеса (HSV-tk), принцип действия которого был рассмотрен выше. Ген HSV-tk вводится в инактивирующий вектор таким образом, что он удаляется в результате гомологичной рекомбинации и сохраняется в хромосоме в случае неспецифической интеграции рекомбинантной ДНК, что приводит к цитотоксическому эффекту. Обобщенная схема направленного введения мутаций в гены животных in vivo, которые приводят к их инактивации во всех клетках трансгенного организма (" генный нокаут "), представлена на рис. II.29.
Разработка универсальных методов направленной инактивации любого требуемого гена во всех клетках организма трансгенных животных позволила за короткое время создать модели таких наследственных заболеваний человека, как b-талассемия, мышечная дистрофия Дюшенна, серповидно-клеточная анемия, муковисцидоз, болезнь Леша–Нихана и целого ряда других распространенных синдромов. Создание этих методов открыло также возможности генотерапии наследственных заболеваний путем замещения в клетках зародышевой линии мутантных аллелей на нормальные. Результаты, полученные в этой области, будут обсуждаться в разделе 10.5.
Следует подчеркнуть, что инактивация генов-мишеней у лабораторных животных – не единственный способ моделирования наследственных и особенно приобретенных заболеваний человека, поскольку причиной многих заболеваний является не отсутствие функционирования, а сверхэкспрессия определенных генов. Например, высокий уровень экспрессии трансгена аполипопротеина AII сопровождается развитием острого атеросклероза у трансгенных мышей. Только исчерпывающее знание этиологии заболевания допускает его адекватное моделирование, и, наоборот, лишь создание адекватных моделей может убедить исследователя в том, что он правильно понимает его природу.
Трансгенные растения
Способность к вегетативному размножению отличает организм растений от организма высших животных, что заметно облегчает осуществление трансгеноза. Многие клетки растений, например клетки зародыша на ранних стадиях его развития, покоящиеся клетки меристем кончиков побегов и корней, а также сосудистых тканей камбия, находятся в недетерминированном состоянии и, попадая под влияние внешних воздействий, могут дифференцироваться с образованием клеток любых типов, а также давать начало новым растениям. В частности, перенос в питательную среду таких недетерминированных клеток может приводить к их полной дедифференцировке и формированию в культуре недифференцированной ткани каллуса. Такие клетки могут стабилизироваться в жидких суспензионных культурах и расти неограниченно долго. Из недифференцированных тканей многих видов растений можно легко регенерировать целые растения.
Процесс получения трансгенных растений в этом случае начинается с введения требуемых генов в недифференцированные клетки таким образом, чтобы они интегрировались в хромосомы. Введение чужеродных генов в клетки растений облегчается, если их клеточные стенки удаляют с помощью гидролитических ферментов - пектиназы и(или) целлюлазы, что приводит к образованию протопластов. Чужеродные гены, находящиеся в составе векторных плазмид, вводят в протопласты одним из стандартных способов с использованием эндоцитоза, стимулированного полиэтиленгликолем, электропорации, микроинъекций или бомбардировки микрочастицами, нагруженными векторной ДНК. После этого протопласты в течение нескольких дней культивируют на питательной среде для восстановления клеточных стенок и образующиеся клетки-трансфектанты используют для регенерации целых растений.
Основным направлением применения трансгеноза для генетической модификации культурных растений является повышение их устойчивости к неблагоприятным воздействиям окружающей среды, в частности вирусам и гербицидам. Один из таких подходов, в котором антисмысловые РНК были направлены на подавление экспрессии жизненно важных генов вирусов, уже был рассмотрен в разделе 9.1.2.
Другой метод защиты растений от вирусов с помощью трансгенов, предложенный В. Шибальским в 1988 г., успешно используется в настоящее время. Сущность метода заключается во введении в геном растений транс- действующих доминантных летальных генов или, по терминологии Шибальского, " анти-генов ", которые кодируют измененные мутациями белки вирусов, существенные для их воспроизводства, и путем конкурентного замещения соответствующих белков вируса дикого типа прерывают его размножение. В частности, с использованием такого подхода удалось получить очень высокую устойчивость растений к вирусу Х картофеля (PVX). В этом случае в ген репликазы PVX с помощью направленного мутагенеза вводили мутации, сопровождающиеся заменой аминокислот в консервативном участке полипептидной цепи репликазы, ассоциированном с ее каталитическим сайтом. Для экспрессии мутантного трансгена в растениях табака были характерны внутриклеточное накопление инактивированной репликазы и появление высокой устойчивости растений к заражению вирусом PVX.
Еще один современный подход к получению трансгенных растений, устойчивых к вирусам, основан на введении в них трансгенов, экспрессирующих в клетках моноклональные антитела, направленные против вирусных белков. В одной из работ с использованием такого метода создали эффективную систему защиты растений от вируса морщинистой мозаики артишока (AMCV). Для этого сначала получили панель моноклональных антител к вирусу AMCV и отобрали гибридомы, продуцирующие антитела, которые взаимодействуют с консервативными участками белка оболочки вируса. Клетки гибридомы использовали для конструирования библиотеки кДНК, из которой выделили последовательности нуклеотидов, кодирующие полноразмерные тяжелые и легкие цепи иммуноглобулинов G класса 2b. С помощью ПЦР и универсальных праймеров амплифицировали вариабельные участки этих последовательностей (VH и VL), которые далее клонировали в экспрессирующем векторе E. coli, что сопровождалось образованием полипептидов VH и VL, соединенных линкерным пептидом (антитела scFV). После отбора клонов, продуцирующих высокоаффинные антитела к вирусному антигену (scFV), объединенные таким образом гены VH-VL помещали в экспрессирующий вектор и использовали для получения трансгенных растений табака Nicotiana bentamiana. Трансгенные растения содержали в своих клетках до 0,1% антител от суммарного белка и оказались устойчивыми к AMCV-инфекции, но не к вирусу мозаики цветной капусты (CMV), что указывало на специфический характер их резистентности.
В заключение следует упомянуть о работе, в которой трансгенные растения сорго, устойчивые к гербицидам, получали бомбардировкой незрелых эмбрионов на стадии зиготы микрочастицами золота (диаметр частиц – 1,5–3,0 мкм). В таком случае микрочастицы погружали в раствор экспрессирующего вектора, высушивали и "выстреливали" в клетки-мишени, добиваясь при этом высоких результатов трансфекции.