Совершенно очевидно, что сочетание электролиза с полупроницаемыми мембранами должно было привлечь внимание исследователей. Заставить двигаться ионы через сплошные мембраны под действием электрического поля, а не градиента концентрации – это значит резко интенсифицировать процесс диализа. В 30-е годы ХХ века появились первые аппараты, однако промышленного применения процесс не нашел.
В следующие 10 лет были получены первые синтетические ионообменные материалы на основе пластмасс. Например, обработкой серной кислотой нейтральных полимеров получают сульфированные полимеры с привитой активной группой – SO3‾ H+, которая в воде диссоциирует на ионы. При наличии в воде любого катиона происходит ионообменная реакция, в результате чего катион металла оказывается довольно прочно связанным с полимером. Таким образом, воду можно очистить от ионов – катионы на сульфогруппах, анионы – на аммониевых группах NH4+OH‾.
Для регенерации ионитов используют концентрированные растворы кислоты и щелочи, проводя обратные обменные реакции. Чтобы достичь полноты регенерации, приходится пропускать через слой ионита существенно больше стехиометрического количества регенерирующего вещества, образуются опасные промышленные отходы. Однако процесс ионного обмена до сих пор является основным при обессоливании воды.
Если же модифицированный, теперь уже ионообменный полимер измельчить до частиц 2-5 мкм, затем смешать порошок с расплавом любого нейтрального полимера, например, полиэтилена, сформовать из этой вязкотекучей жидкости пленки и остудить их, то мы получим так называемые гетерогенные ионообменные мембраны. Их изготавливают катионообменные и анионообменные.
В 1940 году была опубликована статья известного физико-химика Мейера с описанием процесса обессоливания растворов с использованием постоянного электрического поля и ионообменных мембран. Процесс уже получил название электродиализа (ЭД). На рисунке 2.23 показана принципиальная схема электродиализного процесса в многокамерном аппарате.
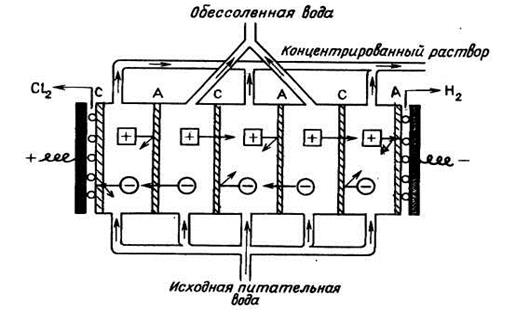
Рисунок 2.23. Электродиализный процесс обессоливания
Между катодом и анодом помещается большое количество катионо- и анионообменных мембран в чередующемся порядке. В межмембранные каналы подается исходный раствор. Под действием электрического потенциала катионы стремятся к катоду, анионы – к аноду. Когда на пути катиона встречается анионообменная мембрана, она его дальше не пропускает. То же случается с анионом на катионообменной мембране. Половина камер превращается в камеры концентрирования, половина – в камеры обессоливания. На катоде в результате электролиза воды выделяется водород, на аноде – кислород по следующим реакциям:
2 Н2О + 2е‾ → Н2 + 2ОН‾
Н2О → ½ О2 + 2Н+ + 2е‾ (2.20)
С тех пор электродиализ получил очень широкое развитие как процесс обессоливания, опреснения морской воды без затрат реагентов на регенерацию ионитов, а также получения концентратов солей, чистых щелочей и кислот. До сих пор процесс ЭД является конкурентом обратного осмоса, хотя каждый из них может занять определенную нишу.
Из уравнений 2.20 видно, что на катоде выделяется газообразный водород и формируется щелочная среда. Материал катода при этом практически не изнашивается и его можно изготовить из обычной углеродистой стали. Анод же подвергается сильному окислению, так как на нем в кислой среде генерируется кислород. Поэтому материал анода – благородные металлы, обычно платина, иногда – платинированный титан.
В ЭД удельная производительность мембраны обусловлена переносом ионов через мембрану, который, в свою очередь, формирует электрический ток.
Плотность электрического тока (т.е. приходящегося на единицу площади мембраны) записывается выражением:
I = G ∙ Z ∙ F (2.21)
где G – удельная производительность мембраны;
Z – заряд иона;
F – число Фарадея (показывает количество электричества, способное
перенести 1 г-экв ионов к электроду, F = 96500 амп/с).
С точки зрения законов электричества, ток связан с электрическим потенциалом по закону Ома:
Е = I ∙ R (2.22)
В нашем аппарате общее электросопротивление составляется из суммы четырех сопротивлений:
R = RAM + RKИ + RKM + RKK (2.23)
где RAM – cопротивление анионообменной мембраны;
RKM – сопротивление катионообменной мембраны;
RКИ - сопротивление камеры исходного раствора;
RКК – сопротивление камеры концентрирования.
Из уравнений 2.21 и 2.22 можно получить выражение для G:
G = z ∙ F ∙ E/R (2.24)
Отсюда следует, что чем более концентрированный раствор подается на разделение, тем меньше величина RКИ, тем меньше общее электросопротивление R, тем выше будет удельная производительность мембран. Это и определяет ту нишу, в которой может эффективно применяться ЭД, - переработка концентрированных растворов. Вспомним, что обратный осмос имеет естественный предел концентрации исходного раствора – граница полной гидратации ГПГ.