1. Бюретку ополаскивают, а затем заполняют раствором соляной кислоты до нулевой черты.
2. Пипетку (объем пипетки=10 мл) с раствором буры переносят в коническую колбу для титрования, добавляют 1-2 капли метилового оранжевого и титруют при перемешивании по каплям из бюретки соляной кислотой до изменения окраски индикатора из желтой в оранжево-розовую.
В точки эквивалентности рН раствора будет меньше 7, так как образуется слабая борная кислота, поэтому при титровании следует использовать индикатор, меняющий свою окраску при рН<7(метиловый оранжевый, метиловый красный), но нельзя применять фенолфталеин (рН>7).
Чтобы правильно установить момент изменения окраски индикатора, рядом с титруемым раствором помещают контрольный раствор, называемый «свидетелем».
Для его приготовления берут в такую же колбу 10 мл воды и прибавляют 1 каплю метилоранжа и из бюретки одну каплю раствора соляной кислоты, чтобы окраска индикатора изменилась из желтого в оранжево-розовый цвет.
Титрование раствора буры продолжают до тех пор, пока от одной капли соляной кислоты титруемый раствор примет оранжево-розовый цвет, как у «свидетеля».
Результаты титрования заносят в журнал:
V Na2B4O7·10 H2O, мл V HCl, мл индикатор
10мл --- метиловый
10 мл --- оранжевый
10 мл ---
-----------------------------
Vсреднее, мл
3.Вычисляют молярную концентрацию эквивалента (нормальную концентрацию) соляной кислоты по формуле:
 , моль/л
, моль/л
Титр соляной кислоты вычисляют по формуле:
Все вычисления должны быть сделаны с точностью до четырех значащих цифр.
Контрольная задача.
Определение содержания соды Na2CO3 в растворе.
Реактивы: стандартизированный раствор соляной кислоты, индикатор метиловый оранжевый, анализируемый раствор соды (Na2CO3).
Вследствие гидролиза раствора соды имеет щелочную реакцию и может быть оттитрован соляной кислотой.
Na2CO3 +Н2О↔NaOH+NaHCO3
CO32-+ Н2О↔ OH-+HCO3-
Уравнение, лежащее в основе титриметрического определения:
Na2CO3 +2НС1→2NaCl+CO2↑+Н2О
Выбор индикатора
При титровании соды соляной кислотой в точке эквивалентности образуется соль и слабая угольная кислота, рН <7.Следовательно в качестве индикатора надо использовать метилоранж (рН=4).
Если титровать карбонат натрия раствором соляной кислоты в присутствии фенолфталеина (рН=9), то малиновая окраска раствора исчезнет, когда будет оттитрована лишь половина карбоната натрия.(рН NaHCO3=8,4).
Na2CO3 +НС1→ NaCl + NaHCO3
Молярная масса эквивалента соды в присутствии фенолфталеина равен молярной массе:
М(э) Na2CO3 =М (Na2CO3) =106,00 г.
При титровании соды соляной кислотой с метилоранжевым происходит реакция:
Na2CO3 + NaCl + NaHCO3
NaHCO3 + НС1→NaCl+CO2↑+Н2О
Na2CO3 +2НС1→2NaCl+CO2↑+Н2О
Молярная масса эквивалента Na2CO3 в присутствии метилового оранжевого будет равен половине молярной массе:
Ход определения
1. Доводят объем полученной задачи (р-р Na2CO3) до 100 мл водой, перемешивают.
2. Отбирают аликвотную часть раствора пипеткой (10. 0 мл) и переносят в колбу для титрования. Добавляют одну каплю метилового оранжевого.
3. Заполняют бюретку стандартизованным раствором НС1.
4. Раствор соды в колбе титруют при перемешивании по каплям из бюретки раствором соляной кислоты до изменения окраски индикатора из желтой в оранжево-розовую. Титрование проводят в присутствии «свидетеля». Титрование повторяют 3 раза, результаты записывают в журнал.
V Na2CO3, мл V HCl, мл индикатор
10мл --- метиловый
10 мл --- оранжевый
10 мл ---
-----------------------------
Vсреднее, мл.
5. вычисление граммового содержания соды в растворе:
1 способ:
Молярная концентрация эквивалента раствора соды:

Вычисление граммового содержания соды в растворе:
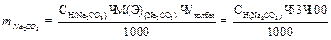 (г)
(г)
2 способ:
Расчет титра НС1 по Na2CO3 (сколько граммов Na2CO3 соответствует 1 мл раствора НС1 с данной нормальностью):
 (г/см3)
(г/см3)
Вычисление граммового содержания соды в растворе 100 мл:
 (г)
(г)
Вопросы к разделу
1. Что называется точкой эквивалентности?
2. В каких случаях точка эквивалентности лежит при рН>7, pH=7 и pH<7?
3. В чем заключается сущность ионно-хроматографической теории индикаторов?
4. Что представляют собой хромофоры и ауксохромы?
5. Что такое области перехода окраски рН-индикатора?
6. Что такое показатель титрования?
7. Назовите показатели титрования метилоранжа и фенолфталеина.
8. Как подбирается рН-индикатор?
9. Рассчитать и построить кривую титрования 0,02 н раствора NaOH 0,02 н HCl (не учитывая изменения объема) и подобрать индикатор.
10. Рассчитать начало и конец скачка при титровании 0,01 н раствора NH4OH 0,01 н раствором HCl и подобрать индикатор. Может ли в данном случае в качестве индикатора применяться фенолфталеин?
11. Можно ли приготовить раствор кислоты точно заданной концентрации по навеске кислоты?
12. Почему не следует брать много индикатора при титровании?
13. Почему необходимо предварительно опаласкивать пипетку и бюретку тем раствором, которым их будут заполнять?
14. Что такое метод замещения и метод обратного титрования?
15. Можно ли фосфорную кислоту титровать как трехосновную?