ОПРЕДЕЛЕНИЕ СЕРЫВ РАСТВОРИМЫХ СУЛЬФАТАХ
(НАПРИМЕР, В СМЕСИ NaCI + Na2S04)
Определение серы в веществах, содержащих растворимые сульфаты, основано на осаждении кристаллического осадка BaS04:
S042-+Ba2+=BaS04
Осадок выделяют из нагретого слабокислого раствора. Прокаливают осадок при температуре около 800 °С (газовая горелка). Гравиметрической формой является BaS04. Гравиметрический фактор для расчета массы S042- равен FSO4 =0,4116, массы серы—FS=0,1374.
Реагенты
Соляная кислота, НС1, 2 М раствор.
Хлорид бария, BaCl2-2H20, 5%-ный раствор.
Нитрат серебра, AgNO3, 1%-ный раствор.
Азотная кислота, HNO3, 2 М раствор.
Выполнение определения. Взвешивают на аналитических весах точную навеску (0,3 — 0,4 г) анализируемого вещества, переносят навеску в стакан вместимостью 300 — 400 мл, в который помещена стеклянная палочка, растворяют вещество в воде и разбавляют полученный раствор примерно до 150—200 мл, прибавляют к раствору 2 — 3 мл 2 М НС1, нагревают раствор почти до кипения и приливают к нему по каплям из бюретки раствор хлорида бария. Количество осадителя рассчитывают, принимая навеску за чистый сульфат натрия + 10% избытка. Во время прибавления осадителя раствор перемешивают палочкой. Дают осадку собраться на дне стакана и проверяют полноту осаждения, прибавив несколько капель осадителя. Если полнота осаждения не достигнута, прибавляют еще несколько миллилитров раствора хлорида бария. Не вынимая стеклянную палочку, закрывают стакан часовым стеклом и оставляют стоять не менее 12 ч. Созревание осадка можно ускорить, если перед осаждением добавить в исследуемый раствор 2—3 мл 1%-ного раствора пикриновой кислоты. В этом случае раствор с осадком достаточно оставить перед фильтрованием на 1 — 2 ч в теплом месте (например, на водяной бане).
Осадок фильтруют на фильтр «синяя лента», сливая сначала на фильтр прозрачную жидкость и собирая фильтрат в чистый стакан. Первые порции фильтрата полезно проверить на полноту осаждения. Когда большая часть прозрачной жидкости пройдет сквозь фильтр, а осадок почти весь останется в стакане, где проводили осаждение, выливают фильтрат и ставят под воронку пустой стакан. Затем промывают осадок в стакане холодной дистиллированной водой декантацией 2 — 3 раза и переносят осадок на фильтр небольшими порциями холодной дистиллированной воды из промывалки. Частицы осадка, приставшие к стенкам стакана, снимают палочкой с резиновым наконечником. Когда весь осадок будет перенесен на фильтр, его на фильтре промывают 3 — 4 раза водой. Последние промывные воды проверяют на полноту промывания раствором AgNO3 в среде 2 М HN03 (допустима лишь слабая опалесценция). Затем воронку с фильтром помещают на несколько минут в сушильный шкаф, подсушивают фильтр с осадком и, согнув края фильтра к центру, помещают слегка влажный фильтр с осадком в доведенный до постоянной массы фарфоровый тигель (тигель прокаливают на полном пламени газовой горелки). Вставляют тигель в треугольник и, держа его высоко над маленьким пламенем горелки, досушивают фильтр и обугливают его. Когда обугливание закончится, увеличивают пламя горелки, опускают треугольник с тиглем, дают выгореть углю, после чего прокаливают осадок на полном пламени горелки 1,0 — 15 мин. По охлаждении в эксикаторе тигель с осадком взвешивают. Повторяют 10-минутные прокаливания до достижения постоянной массы (0,2 мг). Рассчитывают содержание сульфат-ионов или серы в образце в процентах.
Форма записи и вычисление результатов анализа
А. Форма записей в журнале.
Форму записи экспериментальных данных покажем на примере определения содержания бария в BaCl2·2H2O.
Работа № 1. Определение содержания бария в кристаллогидрате BaCl2•2H2O
Бюкс № 1
1. Взятие навески:
масса бюкса с веществом (BaCl2•2H2O) — 13,4105 г
масса пустого бюкса — 12,9023 г
навеска BaCl2•2H2O - — 0,5082 г
2. Растворение навески BaCl2 2H2O.
Объем растворители (воды) при растворении навески хлорида бария (кристаллогидрат) — 100 -мл
3. Вычисление объема осадителя (H2S04) и его растворение. Объем осадителя (теоретический), необходимый для осаждения ионов бария, при навеске ВаСl2 •ЗН2О — 2,08 мл 2 н. H2S04
Объем осадителя, взятый для приготовления раствора — 2,08-1,5=3,12 мл > 3,1 мл.
Объем приготовленного (разбавленного) раствора серной кислоты — 40 мл.
4) Реакция, протекающая при осаждении:
BaCl2•2H20+H2S04 = ВаS04+2НС1+2Н2О
5) Созревание осадка — в течение недели.
6) Фильтрование и промывание осадка.
Объем промывной жидкости.
Промывание осадка декантацией (3 раза) — 30 мл.
Промывание осадка на фильтре (3 раза) — 30 мл.
7) Высушивание и прокаливание осадка Тигель №3
масса тигля с.веществом (BaS04) — 14,0145 г
масса пустого тигля — 13,5299 г
масса осадка (сульфата бария) — 0,4846 г.
Б. Вычисление результатов анализа.
Содержание искомого компонента находят в граммах или процентах.
I) Расчеты массы определяемого компонента. Массу искомого компонента (mBa) в граммах вычисляют по формуле:
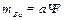
где а — масса весовой формы (например, BaS04 при определении содержания бария), г;
F — фактор гравиметрического анализа (аналитический множитель). Аналитический множитель представляет собой отношение:

где M1— молекулярная масса искомого компонента;
M2— молекулярная масса гравиметрической формы;
т и п— коэффициенты.
Например, нужно вычислить содержание бария в BaCl2•2H20 по массе сульфата бария, полученного в результате анализа. Составим схему анализа:

Вычисляем аналитический множитель:

При нахождении аналитического множителе формула искомого компонента (вещества) записывается, в числителе, а формула весовой формы — в знаменателе. Так, при пересчете Fe2О3 на Fe304 аналитический множитель вычисляется так:

2) вычисление процентного содержания определяемого компонента
При расчете процентного содержания: (у) искомого компонента используют формулу:
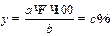
где а—масса гравиметрической формы, г;
b — навеска вещества, взятого для анализа, г;
F — аналитический множитель.
Вычислим процентное содержание бария в образце хлорида бария (BaCl2•2H20), если навеска последнего составляет 0,5082 г, а масса -весовой формы (BaSO4) равна 0,4846 г:

Чтобы судить о точности анализа, находят процентное содержание (истинное) бария в BaCl2•2H20 (в кристаллогидрате):
244,3 г BaCl2•2H20 содержат 137,40г. Ва.
100,0 г BaCl2•2H20 содержат х г Ва.
Отсюда:

Расхождение полученных значений (в первом и во втором случаях) объясняется ощибкой анализа.