Налить в пробирку раствор гидроксида кальция. Пропустить диоксид углерода из аппарата Киппа (рис.4), полностью погрузив конец отводной трубки в пробирку с раствором гидроксида кальция. Наблюдать вначале образование осадка средней соли, а затем его растворение вследствие образования кислой соли. К полученному раствору гидрокарбоната кальция прилить раствор гидроксида кальция.
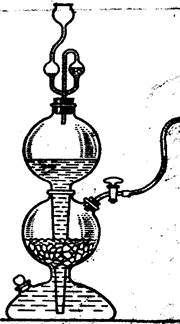
- Объяснить принцип работы аппарата Киппа;
- составить молекулярное и ионное уравнение реакции, протекающей в аппарате Киппа:
CaCO3↓ + HCl →
(краткое ионное уравнение)
- какие свойства проявляет выделяющийся диоксид углерода при взаимодействии с гидроксидом кальция, к какому типу относится эта реакция;
- составить молекулярное и ионное уравнение реакции
Ca(OH)2 + CO2 → ……..... + ….…
осадок
-
(краткое ионное уравнение)
-
- Рис. 4. Аппарат Киппа
-
- составить молекулярное и ионное уравнение реакции, протекающей между
осадком карбоната кальция и избытком диоксида углерода:
CaCO3↓ + H2O + CO2 →
(краткое ионное уравнение)
- указать, какая из полученных солей относится к классу «средних» и какая - к классу «кислых солей»;
- сравнить растворимость «средних» и «кислых» солей;
- сформулировать условие протекания ионно-обменной реакции:
Ионные реакции с образованием комплексных соединений.
Опыт 4. Получение и свойства гидроксида цинка
В три пробирки внести по 2 капли раствора сульфата цинка и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида цинка добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия, в третью пробирку – избыток раствора аммиака.
- Охарактеризовать внешний вид осадка гидроксида цинка;
- составить уравнение реакции образования гидроксида цинка в молекулярной и ионной форме
ZnSO4 + NaOH →
недост.
(краткое ионное уравнение)
- отметить растворение осадка гидроксида цинка в избытке раствора соляной кислоты; избытке раствора гидроксида натрия;
- составить уравнения реакций взаимодействия гидроксида цинка с соляной кислотой в молекулярной и ионной форме:
Zn(OH)2 + HCl →
(краткое ионное уравнение)
- составить молекулярное и ионное уравнение реакции взаимодействия гидроксида цинка с избытком гидроксида натрия, учитывая, что образуется тетрагидроксоцинкат натрия
Zn(OH)2 + 2NaOH(изб.) → Na2[Zn(OH)4]
(краткое ионное уравнение)
- ответить, какие кислотно-основные свойства проявляет гидроксид цинка;
- объяснить растворение гидроксида цинка в избытке аммиака;
- составить молекулярное и ионное уравнение реакции, учитывая, что происходит образование гидроксида тетрааминцинка
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
(краткое ионное уравнение)
Вывод:
Составление уравнений ионно-обменных реакций:
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №4
На тему: «Произведение растворимости. Образование и растворение осадков»
Выполнил
студент группы__________ ______________ Фамилия И.О.
(Подпись, дата)
Принял
доцент кафедры ОАХ ______________
(Подпись, дата)
Цель работы:
- изучить закономерности образования и растворения осадков плохо растворимых сильных электролитов
Краткая теория
Насыщенный раствор – это …..
Произведение растворимости (ПР) характеризует …
ПР зависит от….
ПР не зависит от….
Составить выражение для ПР осадков
а) FeS б) PbI2
в) Ag2S г) Ca3(PO4)2
Сравнить растворимость осадков PbCl2 и PbI2,
если ПР(PbCl2) = 1,56 10-5 ПР(PbI2) = 1,1 10-9
Сравнить растворимость осадков FeS и CuS,
если ПР(FeS) = 5 10-18 ПР(CuS) = 7,9 10-27
Осадки плохо растворимых сильных электролитов растворяются в ……………………….растворах
Ненасыщенный раствор – это…..
Условие растворения осадка плохо растворимого сильного электролита:
а) б)
в) г)
Осадки плохо растворимых сильных электролитов кристаллизуются из ……………………….растворов
Перенасыщенный раствор – это…..
Условие образования осадка плохо растворимого сильного электролита:
а) б)
в) г)
Опыт 1. Произведение растворимости и образование осадков галогенидов свинца (II)
В две пробирки налить по 3 капли 0,005 М раствора нитрата свинца (II). В одну из них прибавить такой же объём 0,05 М раствора хлорида калия, а в другую – такой же объем 0,05 М раствора иодида калия.
- Отметить, образуется осадок…… и не образуется осадок….
- составить уравнение диссоциации нитрата свинца (II) и рассчитать концентрацию ионов Pb2+ в исходном 0,005 М растворе соли Pb(NO3)2:
Pb(NO3)2 → …;
0,005 моль/л
[Pb2+]o=?
- составить уравнение диссоциации хлорида (иодида) калия и рассчитать концентрацию хлорид (иодид) – ионов в исходном 0,05 М растворе соли:
KCl → KI → …;
0,05 моль/л 0,05 моль/л
[Cl-]o = [I-]o =
- рассчитать концентрации ионов Pb2+ и хлорид (иодид) - ионов после смешивания равных объемов исходных растворов:
[Pb2+]см.= [Cl-]см. = [I-]см. =
- рассчитать произведение концентраций  для осадка PbCl2 и сравнить его с произведением растворимости:
для осадка PbCl2 и сравнить его с произведением растворимости:
ПК(PbCl2) = [Pb2+] [Cl-]2 = ПP(PbCl2) = 1,56 10-5
- ответить, является раствор после смешивания нитрата свинца (II) и хлорида калия ненасыщенным или перенасыщенным;
- рассчитать произведение концентраций  для осадка PbI2 и сравнить его с произведением растворимости:
для осадка PbI2 и сравнить его с произведением растворимости:
ПК(PbI2) = [Pb2+] [I-]2 = ПP(PbI2) = 1,1 10-9
- ответить, является раствор после смешивания нитрата свинца (II) и иодида калия ненасыщенным или перенасыщенным;
- сформулировать условие образования осадка.