Использование биоинформатики поиска, несколько генов Канди-даты, кодирующих ферменты, которые, вероятно, участвующие в биосинтезе амилопектина были идентифицированы-Fied (Коппины и др., 2005). Эти мнимые ферменты могут быть сгруппированы в два класса:
1. Ферменты, которые участвуют в синтезе амилопектина, такие как амилопектина синтазы, branch-
ING ферментов, пирофосфорилазы УДФ-глюкоза, изоамилазы, непрямой деветвящего фермента, α-1, 4-glucanotransferase и glycogenin
2. Ферменты для деградации амилопектина, как αамилазы, dikinase или белок R1, phosphory-Lase и αглюкозидазы. На основании наличия этих ферментов, метаболические пути и ферменты, участвующие в синтезе амилопектина в T. гондиях, вероятно, аналогичны тем, которые синтез крахмала в одноклеточный зеленых водорослях Chlamydomonas reinhardtii (рис 8.2).
Удивительно, но все эти гены присутствуют в геноме Toxoplasma как уникальный экземпляр, предполагая, что избыточные гены не являются необходимыми для синтеза подлинного кристаллического амилопектина в этом простейшим паразитом (Болл и Морелл, 2003;. Coppin и др, 2005), Это является нарушением действующего догма, что наводит на мысль, что избыточность генов требуется для построения кристаллического крахмала в растениях. Даже в простейших одноклеточный picophytoplanktonic зеленых водорослей, Ostreococcus Тельца, есть множество

| ОБМЕН УГЛЕВОДОВ |
| ми | ми | ||
| резус | |||
| бром | |||
| бром | DG | ||
| AG | M | ||
| AG | N | ||
| N | |||
| CWBr | |||
| PV | |||
A В С
Т. гондий Киста брадизоитный тахизоит
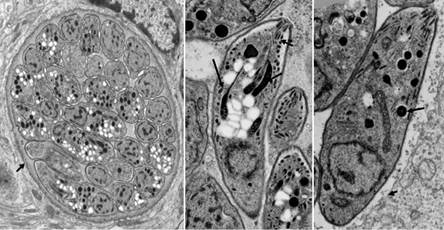
РИСУНОК 8.1 Передача электронных микрофотографии bradyzoites (Br) в пределах кисты ткани (панель A). Обратите внимание на наличие кистозной стенки (CW) и многочисленные амилопектина гранул (АГ) в цитоплазме Brady-zoites. Панели В и С показывают более высокое увеличение ультраструктурных морфологии брадизоитного и тахи- zoite, который испытывает недостаток амилопектина гранул. Rh, rhoptry; Д. Г., плотные гранулы; Mi, micronemes и М, митохондрии; N, ядро; CW, киста стены; PV, паразитофорная вакуоль.
генов и избыточности изоферментов, участвующих в синтезе крахмала (Рал и др., 2004).
Только пирофосфорилазы UDP-глюкозы и UDP-глюкозы с использованием амилопектина синтазы найдены в Т. гондий. Сравнительный геномный анализ с участием одноклеточных красных водорослей
Cyanidioschyzon merolae (Matsuzaki и др., 2004),
одноклеточные зеленые водоросли Chlamydomonas rein-
hardtii, Дрожжи Saccharomyces дрожжи, и бактерия кишечной палочки показало, что оба С. merolae и T. гондий содержат UDP-глюкозы с использованием гликогена (крахмал) синтазы-подобные последовательности и glycogenins. Эти ферменты являются специфическими для пути на основе эукариот UDP-глюкозы. Кроме того, протокол UDP-глюкоза с использованием синтазов гликогена была обнаружена в сыром экстракте из T.gondii, в то время как только АДФ-глюкоза зависит активность присутствует в Chlamydomonas лизатов (Коппины и др., 2005). Т. гондий также содержит косвенный деветвящий фермент, бифункциональный фермент, который несет какα-1,4-glucanotransferase и amylo-1,6-глюкозидазы деятельность в грибов и животных (рис. 8.2)
Тем не менее, наиболее характерно символизируя амилопектина путь биосинтеза в T.gondii, является наличие генов, которые растительного происхождения. Среди генов, которые отличают растительный крахмал метаболизм от животного, грибковых и бактериальных путей гликоген являются изоамилазы и R1 (глюкан вода dikinase активность) -подобных последовательностей в Т. гондий. Это говорит о том, что оба гидролизат растительного и животного, как амилопектин биосинтетических путей, необходимых для синтеза кристаллического амилопектина в паразита (рис 8.2).