Подавляющее большинство исследований, в которых методы белковой инженерии используют для замен отдельных аминокислотных остатков в полипептидных цепях белков, заканчиваются получением мутантных производных, у которых отсутствует, резко ослаблена или остается неизменной исходная ферментативная активность. В таких опытах обычно локализуют отдельные остатки аминокислот, участвующих в формировании активных центров ферментов. Однако в ряде случаев методами направленного мутагенеза удается целенаправленно и кардинально изменять свойства белков. В опытах такого рода можно повысить термостабильность исследуемых белков, усилить их устойчивость по отношению к окислению, протеолизу и другим неблагоприятным воздействиям, а также изменить у исходных ферментов субстратную специфичность.
Серия работ была проведена на субтилизине – протеолитическом ферменте бактерий рода Bacillus. В активном центре субтилизина B. lentus в положении 222 находится метионин. Окисление Met-222 сопровождается образованием соответствующего сульфоксида и полностью инактивирует фермент. Методом направленного мутагенеза произвели замену Met-222®Cys и остатки цистеина модифицировали тиоалкилирующим агентом. Это делало фермент высокоустойчивым к окислению и сопровождалось лишь незначительной потерей его активности. Новые свойства модифицированного субтилизина расширяют возможности его применения в биотехнологии. Путем замены отдельных аминокислотных остатков субтилизина в других работах удавалось изменять его субстратную специфичность, повышать удельную активность, изменять оптимум pH и увеличивать устойчивость по отношению к щелочи.
Эти работы иллюстрируют возможности данного направления исследований в белковой инженерии, направленных на создание высокотехнологичных ферментов, способных длительное время функционировать в жестких условиях ферментации на промышленных установках. На еще одно направление развития исследований в белковой инженерии указывают работы по направленному изменению субстратной специфичности ферментов путем замены отдельных аминокислотных остатков в их полипептидных цепях. Например, замена Met-73 у ингибитора субтилизина Streptomyces lividans на Lys или Arg приводила к появлению у него способности ингибировать трипсин. При этом у мутантного ингибитора с заменой Met-73®Lys появлялась также способность ингибировать лизилэндопептидазу, а ингибитор с заменой Met-73 на Tyr или Trp подавлял активность a-трипсиногена. Исследования продемонстрировали функциональную значимость остатка Met-73 в так называемом PI-сайте участка полипептидной цепи, контактирующего с ингибируемыми ферментами, и позволили создать модель такого белок-белкового взаимодействия. Кроме того, эти работы являются основой для конструирования новых ингибиторов сериновых протеиназ, а также более глубокого изучения механизма их ингибирующего действия.
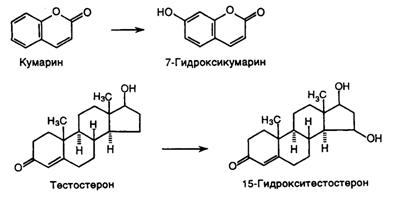
Такой же подход с целенаправленными заменами отдельных аминокислотных остатков был использован для изменения субстратной специфичности трипсина. В этом случае предварительный теоретический анализ структурных особенностей активного центра трипсина и особенно его субстрат-связывающего участка позволил предсказать аминокислотные остатки, существенные для взаимодействия субстрата с ферментом и обеспечивающие специфичность его действия. Проведенная на основании такого анализа замена Gly-226 на Ala резко (в 100 раз) уменьшила способность мутантного трипсина гидролизовать субстраты, содержащие Arg, и в значительно меньшей степени повлияла на его активность в отношении лизиновых субстратов. Обратную, хотя и менее ярко выраженную, картину наблюдали при замене Gly-216 ® Ala. Проведенная группой И. Сигала замена Ser-70 в активном центре b-лактамазы на Cys также изменяла ее субстратную специфичность. Константа связывания субстрата – пенициллина – мутантным ферментом оставалась неизменной, тогда как скорость его расщепления уменьшалась в 50–100 раз. В то же время мутантная b-лактамаза была более активна, чем фермент дикого типа по отношению к цефалоспоринам – аналогам пенициллина, так называемым антибиотикам третьего поколения. Возможность изменения субстратной специфичности путем замены отдельных аминокислот была продемонстрирована недавно и для цитохромов группы P-450. Мышиные цитохромы P-45015a и P-450coh экспрессируются в клетках печени самок и почек самцов соответственно. Первый из них катализирует 15a-гидроксилирование D4-3-кетостероидов типа тестостерона, тогда как второй – гидроксилирование кумарина в положении 7. Несмотря на свою разную субстратную специфичность оба фермента различаются лишь по 11 (из 494) аминокислотным остаткам. Осуществляя последовательные замены этих 11 аминокислот, установили, что замена единственной аминокислоты Phe-209®Leu в полипептидной цепи цитохрома P-450coh приводит к появлению у него способности гидроксилировать стероиды, т.е. активности цитохрома P-45015a, и к потере способности использовать кумарин в качестве субстрата.
Эти далеко не исчерпывающие примеры демонстрируют возможности одного из двух основных подходов к созданию методами белковой инженерии белков с новыми каталитическими активностями. Такой подход заключается в изменении существующих активных центров ферментов путем замен отдельных аминокислотных остатков, которые участвуют в формировании активных центров. Принципиально другой подход к получению ферментов новой специфичности заключается в модификации методами белковой инженерии биологических рецепторов путем введения каталитических функциональных групп в центры связывания лигандов-субстратов. Такой подход был, в частности, реализован при конструировании методом направленного мутагенеза каталитических антител – абзимов.
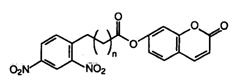
Была поставлена задача методами белковой инженерии на основе иммуноглобулинов, специфически взаимодействующих с динитрофенильными группами антигенов, получить абзимы, гидролизующие эфиры динитрофенола следующей структуры:
Исходя из того, что имидазол действует в качестве нуклеофильного катализатора при гидролизе карбоксиэфиров в водных растворах, предполагали, что введение остатка гистидина в центр связывания динитрофенильных лигандов иммуноглобулина может придать ему способность осуществлять гидролиз сложных эфиров динитрофенола. В качестве исходного белка при конструировании абзима использовали VL- и VH-фрагменты тяжелой и легкой цепей иммуноглобулина, специфически взаимодействующего с динитрофенильными группами антигенов. VL- и VH-фрагменты представляют собой вариабельные области иммуноглобулина, которые взаимодействуют с антигеном. Фрагмент ДНК, кодирующий VL-область легкой цепи, синтезировали in vitro и экспрессировали в клетках E. coli. При этом в процессе синтеза кодон, кодирующий Tyr-34, был изменен на кодон His, так как было известно, что именно Tyr-34 контактирует с молекулами динитрофенола в комплексах антиген–антитело. Очищенный рекомбинантный VL-фрагмент объединяли с VH-фрагментом тяжелой цепи природного иммуноглобулина, взаимодействующего с динитрофенолом, что приводило к образованию так называемого Fv-фрагмента.
Оказалось, что такой мутантный Fv-фрагмент способен катализировать гидролиз кумаринового эфира 5-(2,4-динитрофенил)аминопентаноевой кислоты (см. выше структурную формулу, n=4) в 90 000 раз более эффективно, чем 4-метилимидазол, и начальная скорость гидролиза была в 45 раз выше, чем у Fv-фрагмента дикого типа. При этом мутантный Fv-фрагмент был неактивен в отношении аминопропаноевого (n=2) и аминогексаноевого (n=5) аналогов субстрата. Таким образом, с помощью замены единственной аминокислоты в антигенсвязывающем центре иммуноглобулина удалось создать на его основе высокоспецифичный гидролитический фермент, а сам процесс его конструирования был основан на знании молекулярных механизмов катализа и взаимодействия антигенов с антителами.
В настоящее время реализованы оба подхода к созданию искусственных ферментов с новыми субстратными специфичностями, основанные на изменении отдельных аминокислотных остатков в субстрат- или лигандсвязывающих центрах ферментов или рецепторов. По мере углубления знаний о механизмах действия ферментов и закономерностей реализации потенций первичной структуры полипептидных цепей в их пространственной структуре появится возможность конструирования абсолютно новых белков с заданной ферментативной активностью. С этого момента значительно расширится поле деятельности белковой инженерии, которая вместе с генной инженерией сможет решать задачи, связанные с целенаправленным изменением уже известных и созданием новых метаболических путей в клетках живых организмов.