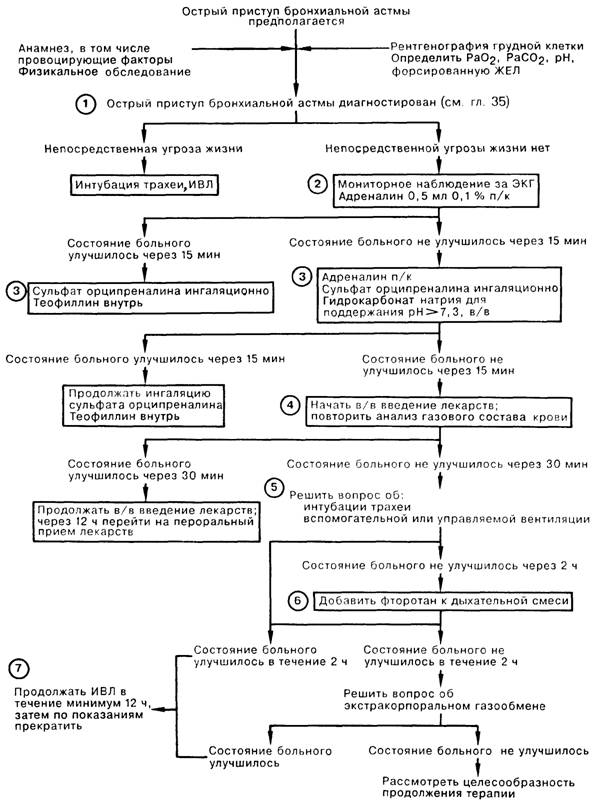
1. Смертность среди больных, госпитализированных с приступом бронхиальной астмы, составляет примерно 1,3%. Важное значение имеет тщательная дифференциальная диагностика; обнаружение хрипов на выдохе и бронхоспазма столь явно указывает на «бронхиальную астму», что альтернативные варианты, например эмболия легочной артерии или аспирация, часто просто не рассматриваются. Состояние больного может быстро стать угрожающим; признаками ухудшения являются втянутые межреберные промежутки, резкое снижение либо полное прекращение поступления воздуха в дыхательные пути, и угнетение сознания больного вплоть до комы. В этой ситуации следует немедленно начать вспомогательную вентиляцию легких с помощью лицевой маски с последующей интубацией трахеи и проведением ИВЛ во вспомогательном или управляемом режиме.
2. В число первоочередных мероприятий входят: определение форсированной жизненной емкости легких (ФЖЕЛ) и объем форсированного выдоха за первую секунду (ОФВ1,0), хотя в некоторых случаях определение этих показателей следует отложить до начала лекарственной терапии. Адекватная гидратация нередко способствует разжижению мокроты, поэтому необходимо наладить в/в инфузию жидкости. У больных с приступом бронхиальной астмы нередко отмечается гиповолемия, а гипотензия является главным осложнением. В то же время введение жидкости требует осторожности из-за опасности отека легких, возникновению которого может способствовать повышение отрицательного внутригрудного давления из-за нарушения вентиляции. Адреналин в дозе 0,5 мл (1:1000) вводят п/к. Для определения уровней РаО2, РаСО2, рН, электролитов сыворотки крови и, по возможности, концентрации эуфиллина, необходимо получить пробу артериальной крови. Больной должен дышать увлажненным кислородом (РiO2 = 0,3), так как у этих больных почти всегда имеется гипоксемия, которая часто усугубляется в ходе лечения. Больным с приступом бронхиальной астмы проводят непрерывное мониторнос наблюдение за ЭКГ и делают рентгенографию грудной клетки. Антибиотики назначают лишь при установленном инфекционном заболевании легких. Критериями улучшения являются самочувствие больного, данные физикального обследования и, более объективно, динамика ФЖЕЛ.
|
|
3. Для ингаляционного введения обычно используют селективный бета-2-адреномиметик, например сульфат орципрсналина (до 10 мг на курс), хотя клинические исследования показали, что он почти не имеет преимуществ по сравнению с неселективными препаратами, например изадрином. Коррекцию метаболического ацидоза осуществляют осторожным введением гидрокарбоната натрия. Увеличение рН более 7,3 повышает эффективность лекарственных препаратов, но в то же время затрудняет оценку адекватности вентиляции.
4. Начальную дозу вводимого внутривенно эуфиллина (6 мг/кг в течение 20 мин) следует уменьшить, если больной ранее уже принимал содержащие теофиллин препараты. Затем начинают непрерывную инфузию по 0,5 мг/кг/ч; эту дозу снижают до 0,2 мг/кг/ч у больных с сердечной недостаточностью, заболеваниями печени или пневмонией и увеличивают до 0,7 мг/кг/ч для курильщиков. Оптимальная концентрация теофиллина в сыворотке крови составляет 15-20 мкг/мл. Одним из многих используемых при бронхиальной астме глюкокортикоидных препаратов является гидрокортизон, который назначают в начальной дозе 7 мг/кг, а в дальнейшем вводят по 7 мг/кг каждые 8 ч.
|
|
5. Отсутствие эффекта от проводимой терапии может быть следствием пневмоторакса, обнаружить который можно на рентгенограмме грудной клетки. Следует оценить эффект от применения вводимых ингаляционно холино-литиков, например атропина (5—8 мг). Показаниями к эндотрахсальной интубации являются снижение уровня сознания, РаСО2 > 60 мм рт. ст., упорный метаболический ацидоз, а также ослабление или исчезновение дыхательных шумов при аускультации. После интубации необходимый седативный эффект может быть достигнут введением наркотических препаратов и сибазона.
6. Фторотан является мощным ингаляционным средством для наркоза, способствующим расслаблению гладкой мускулатуры дыхательных путей. Экстракорпоральная мембранная оксигенация крови позволяет реализовать действие лекарственных препаратов, также может быть проведен лаваж бронхиального дерева. Проведение экстракорпоральной оксигенации не влияет на смертность.
7. ИВЛ может быть прекращена, если больной в сознании, контактен и может самостоятельно дышать в течение 45 мин, обеспечивая уровень РаСО2 менее 50 мм рт. ст. и ФЖЕЛ свыше 10 мл/кг.
Глава 39
ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
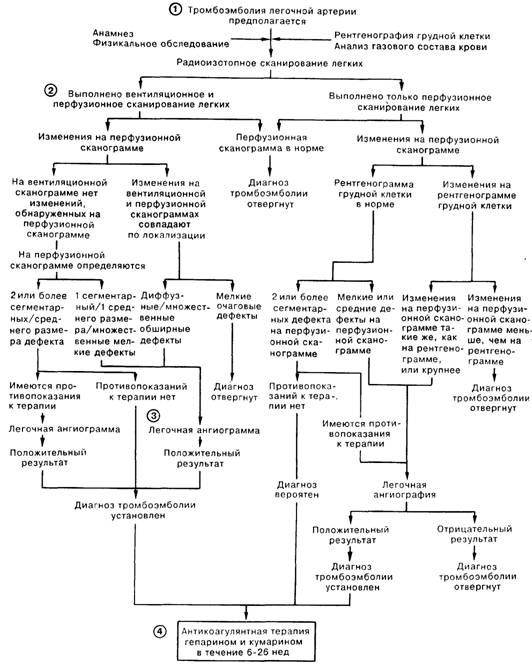
1. Тромбоэмболия легочной артерии (ТЭЛА) является наиболее частой причиной критического состояния у госпитализируемых больных. В то же время ее диагностика остается сложной и полной противоречий. В значительном числе пропущенных случаев ТЭЛА этот диагноз, вероятно, просто не рассматривался. Строго логичный и последовательный подход к диагностике позволяет, с одной стороны, не пропустить эмболию, а с другой — избежать неправильного диагноза.
|
|
2. К методикам, помогающим в диагностике ТЭЛА, относятся рентгенография грудной клетки, перфузионное радиоизотопное сканирование, вентиляционное радиоизотопное сканирование и легочная ангиография. Для визуализации используют также компьютерную томографию, цифровую ангиографию и метод ядерного магнитного резонанса, но ни один из последних методов не стал широко распространенным в клинической практике.
3. Окончательный диагноз ТЭЛА требует проведения легочной артериографии, однако так как это исследование в небольшом, но достоверно установленном проценте случаев приводит к осложнениям и летальному исходу, в первую очередь следует использовать другие доступные диагностические методы. Опытный врач должен заподозрить ТЭЛА у больного с атипичной клинической картиной, а затем выбрать больных, у которых диагноз может быть поставлен или отвергнут без проведения легочной ангиографии (т.е. в тех случаях, когда степень вероятности диагноза ТЭЛА меньше той, что может дать ангиографическое исследование). Мы считаем, что каждому больному с подозрением на ТЭЛА следует выполнить рентгенографию грудной клетки, а также перфузионное и вентиляционное радиоизотопное сканирование. С помощью этих 3 методов исследования диагноз может быть отвергнут примерно у 70% больных и установлен примерно у 10% больных. У оставшихся 20—25% больных результаты перфузионного и вентиляционного сканирования неубедительны и вероятность наличия эмболии легочной артерии колеблется от 15 до 85%. Отсутствие дополнительной информации может привести, с одной стороны, к осложнениям далеко не безопасных лечебных процедур, а с другой — к повторной эмболии, если лечение не будет проведено нуждающемуся в этом больному. Этой группе больных показано выполнение легочной ангиографии. Время от времени исследователи предлагали варианты диагностики ТЭЛА, не включающие высокоинформативную ангиографию на том основании, что лечебная тактика при легочной эмболии схожа с таковой при тромбозе глубоких вен (ТГВ). Например, если у больного диагностирован бессимптомный ТГВ, это означает, что диагноз тромбоэмболии легочной артерии можно принимать и в значительно менее убедительной клинической ситуации. Наш опыт говорит против подобного подхода. ТГВ удается достоверно выявить лишь у примерно 50% больных с ТЭЛА, а значит, правомерность этого критерия неудовлетворительна. Кроме того, ведение больных с рецидивирующей симптоматикой ТЭЛА в отсутствие четко установленного диагноза представляет собой чрезвычайно сложную задачу.
4. Стандартная схема лечения неосложненной ТЭЛА включает в себя антикоагулянтную терапию гепарином с последующим приемом препаратов кумаринового ряда (кумарин) от 6 нед до б мес. Более длительный прием антикоагулянтов рекомендован больным с предрасполагающими к повторной эмболии факторами либо при рецидивирующей ТЭЛА. Эффективность тромболитической терапии остается противоречивой и чаще всего она используется у больных с тяжелыми гемодинамическими нарушениями. «Зонтики» и другие препятствующие эмболии устройства, устанавливаемые в нижней полой вене, обычно применяют у больных, которым противопоказаны антикоагулянты, либо у больных с повторными эпизодами эмболии на фоне адекватной противосвертывающей терапии.
Глава 40
ПНЕВМОНИЯ
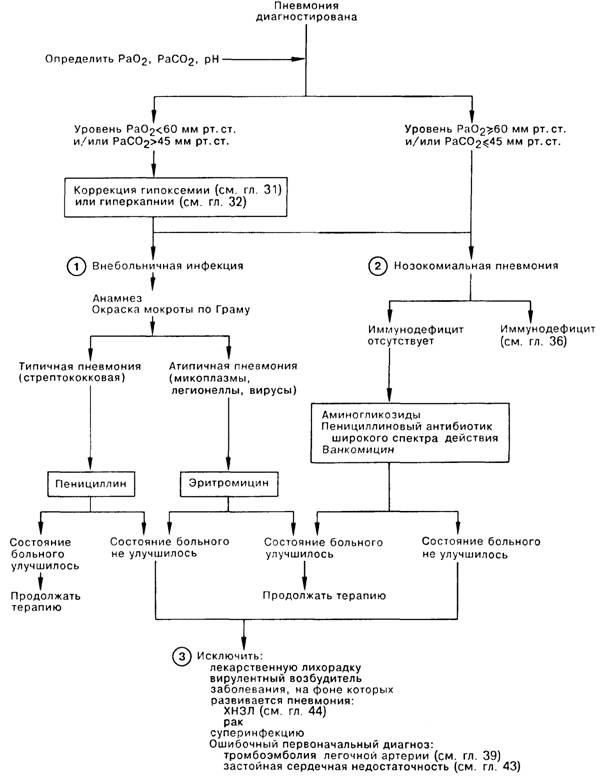
1. Этиология пневмонии прямо связана с анамнезом больногO2 следует учитывать место, где началось заболевание — в больнице или дома, факторы окружающей среды, наличие сопутствующего заболевания. Основными возбудителями внеоспитальной пневмонии являются пневмококки, микоплазмы, легионеллы и вирусы. Характерными признаками типичной долевой пневмококковой пневмонии являются острое начало, лихорадка с ознобом, продуктивный кашель с гнойной мокротой, в которой при окрашивании по Граму обнаруживаются возбудители и полиморфноядерные лейкоциты; характерные для данного диагноза результаты физикального обследования; а также соответствующее границам доли легкого затемнение с обширным плевральным выпотом на рентгенограмме грудной клетки. При атипичной пневмонии (мигрирующей пневмонии), напротив, наблюдаются медленное начало, отсутствие гнойной мокроты, а также рентгенографические признаки неоднородного и/или диффузного инфильтрата в отсутствие или с небольшим плевральным выпотом. Типичную пневмонию лечат пенициллином. В острой стадии атипичной пневмонии до получения результатов посева мокроты обычно эмпирически назначают эритромицин.
2. Госпитализированные больные могут вдохнуть или аспирировать микроорганизмы, заселяющие их верхние дыхательныел пути. Возникающая впоследствии нозокомиальная пневмония может быть вызвана как аэробными грамотрицательными микроорганизмами и/или стафилококками, так и анаэробными возбудителями. Поэтому этим больным следует назначать антибиотики, спектр действия которых распространяется и на анаэробные, и на аэробные микроорганизмы: например, аминогликозиды и пенициллин широкого спектра действия (ticarcillin), а в случае пневмококковой пневмонии nafcillin и vancomycin. Инструментальные манипуляции также могут быть причиной нозокомиальной инфекции (например, пневмония, вызванная кишечной палочкой, после катетеризации мочевого пузыря у больного с инфекцией Е. coli мочевых путей). Учитывая меняющийся спектр возбудителей и тяжесть протекающей пневмонии, врач должен быть в курсе анамнестических особенностей заболевания данного пациента, а также результатов диагностических исследований. Несмотря на доступность новой диагностической техники (например, защищенный катетер для бронхоскопии), важное значение придается тщательному сбору анамнеза и получению пробы мокроты (при необходимости следует вызвать кашель) без эпителиальных клеток, но содержащей лейкоциты.
3. Пневмония, рефракторная к терапии, считается осложненной. В числе причин неэффективности проводимой терапии можно назвать: нарушение больным назначений приема лекарств, лихорадочное состояние в ответ на прием лекарственного препарата; наличие особо вирулентного возбудителя (некротизирующая пневмония, вызванная пневмококком 3-го типа); сопутствующие заболевания (хроническое обструктивное заболевание легких, эндобронхиальный рак, приводящий к механической обструкции дыхательных путей, микоплазменная пневмония у больного с серповидноклеточной анемией; больной с иммунодефицитом); суперинфекция (поствирусная пневмококковая пневмония). Другой причиной неудовлетворительного эффекта от терапии может быть ошибочный первоначальный диагноз: во-первых, заболевание может быть неинфекционным (застойная сердечная недостаточность, системный васкулит, ТЭЛА), во-вторых, возбудитель может быть неправильно идентифицирован. Следует повторно расспросить больного о его дальних поездках, возможных контактах с животными, знакомыми и родственниками с симптомами вирусного заболевания или туберкулеза. У этих больных в прошлом могла иметь место незамеченная аспирация (эпилептический припадок, кома, алкоголизм). Возбудителями подобной небольничной аспирационной пневмонии обычно являются анаэробные бактерии. Лечение послеаспирационного абсцесса легких может потребовать высоких (до 10 млн ЕД/сут) доз пенициллина в течение более 3 мес. В тяжелых случаях следует назначать также clindamycin, так как в 10—15% случаев аспирационная пневмония вызывается пенициллинустойчивым Bacteroides fragilis.
Глава 41
ПЛЕВРАЛЬНЫЙ ВЫПОТ
1. Подозрение на плевральный выпот возникает в том случае, если больной жалуется на боль, характер которой указывает на поражение париетальной плевры, либо при иррадиации боли в плечо. Другими распространенными симптомами, обычно связанными с большим количеством выпота, являются кашель и диспноэ. Иногда бессимптомный выпот обнаруживают на рентгенограмме грудной клетки, сделанной совсем по другому поводу. К типичным признакам плеврального выпота относятся увеличение размеров пораженной половины грудной клетки, выбухание межреберных промежутков, притупление перкуторного звука, а также ослабление голосового дрожания и дыхательных шумов над зоной выпота. Шум трения плевры указывает на ее воспаление.
2. Рентгенограмма грудной клетки в прямой проекции, выполненная больному, находящемуся в положении стоя, чаще всего позволяет обнаружить выпот. У больных в тяжелом состоянии получение подобного снимка может оказаться невозможным, а рентгенограмма в прямой проекции в положении лежа на спине может не выявить имеющийся выпот. В этой ситуации рекомендуется сделать двусторонние снимки в боковой проекции в положении лежа, которые позволяют выявить свободный плевральный выпот в количестве от 5 мл, а также определить состояние окружающей паренхимы легких. При невозможности выполнить снимки в положении лежа можно провести ультразвуковое исследование, которое также позволяет обнаружить плевральную жидкость.
3. Случайная перфорация катетером стенки правого предсердия, верхней или нижней полой вены может привести к появлению жидкости в плевральной полости вследствие попадания туда крови или вводимых инфузионно растворов. Следует обязательно проверить положение катетера путем отсасывания жидкости по катетеру и тщательного изучения рентгеновских снимков грудной клетки.
4. Двусторонний выпот при застойной сердечной недостаточности(ЗСН), нефрите, циррозе не требует проведения торакоцентеза при улучшении состояния больного; следует продолжать динамическое наблюдение и терапию основного заболевания. В остальных случаях обычно приходится выполнять торакоцентез. При одностороннем выпоте торакоцентез производят для уточнения диагноза или при ухудшении состояния больного.
5. Экссудат определяется на основании по крайней мере 2 из следующих критериев: отношение количества белка в плевральной жидкости к сывороточному белку должно быть более 1/2; отношение количества лактатдегидрогеназы (ЛДГ) в плевральной жидкости к количеству ЛДГ сыворотки крови должно быть более 3/5, уровень ЛДГ в плевральной жидкости должен составлять более 2/3 от верхней границы определяемой в данной лаборатории нормы для сывороточной ЛДГ. Транссудат удовлетворяет либо только одному из этих критериев, либо вообще ни одному. Причин для появления транссудата не так уж много, среди них нужно назвать застойную сердечную недостаточность, нефроз, гломерулонефрит, цирроз, микседему и саркоидоз. Напротив, экссудативный плеврит возникает при значительно большем количестве заболеваний (неопластические процессы, инфекция, коллагенозы, травматические повреждения). Поэтому исследование экссудата требует выполнения следующих диагностических мероприятий: цитологическое и бактериологическое исследования плевральной жидкости, определение содержания глюкозы, амилазы, а также поиск характерных для красной волчанки LE-клеток в плевральной жидкости. В том случае, если в ходе анализа плевральной жидкости получена недостаточная информация, иногда требуется проведение биопсии плевры, при этом основное внимание должно быть обращено на возможность опухолевого, туберкулезного или грибкового поражения. Показанием к открытой биопсии плевры являются отрицательные результаты прочих методов исследования, а также состояние больного, оправдывающее эту инвазивную диагностическую процедуру.
6. Установление дренажной трубки при эмпиеме (бактериальный экссудативный плеврит) способствует проведению скарификации для исключения опухолевой причины экссудата, а при гемотораксе позволяет контролировать объем кровопотери. Дренирование плевральной полости может быть также показано в ситуации, когда значительный объем выпота серьезно затрудняет нормальный газообмен либо механически стесняет дыхательные движения легких.

Глава 42
ОСТРЫЙ ОТЕК ЛЕГКИХ ПРИ НИЗКОМ ДАВЛЕНИИ В ЛЕГОЧНОЙ АРТЕРИИ
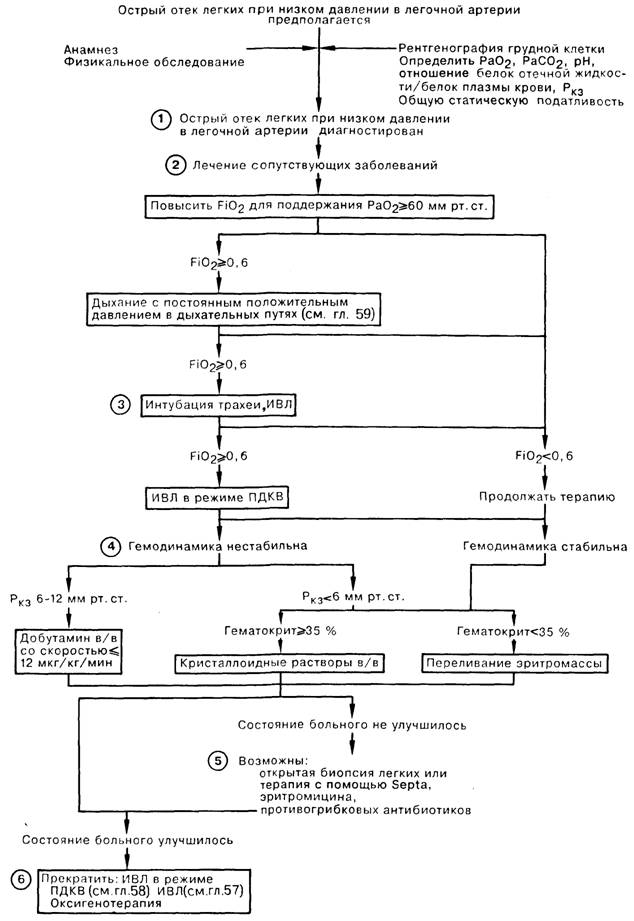
1. Признаками отека легких при низком давлении в легочной артерии (ОЛНД) (респираторный дистресс-синдром у взрослых, РДСВ) являются диффузные легочные инфильтраты на рентгенограмме грудной клетки, значительная рефракторная к низким концентрациям вдыхаемого кислорода гипоксия, а также снижение легочной и общей статической податливости. Кроме того, для этого синдрома характерны нормальные или пониженные цифры легочного капиллярного давления заклинивания (Ркз) и значение отношения белок в отечной жидкости/белок плазмы крови более 0,75. Эти диагностические критерии позволяют выявить ОЛНД при многих заболеваниях, в том числе при первичной легочной инфекции. Иногда Ркз составляет 17-22 мм рт, ст., что не исключает возможности диагностики отека легких с первично повышенной проницаемостью альвеолярных мембран, но указывает на необходимость коррекции терапии в связи с перегрузкой объемом либо сопутствующей левожелудочковой недостаточностью.
2. Среди состояний, которые наиболее часто осложняю тся развитием РДСВ, следует назвать сепсис, аспирацию желудочного содержимого, многократную гемотрансфузию и длительную гипотснзию. РДСВ у больных с сепсисом характеризуется чрезвычайно высокой смертностью, достигающей 85-90%. К другим причинам РДСВ относятся: тяжелый острый панкреатит, жировая эмболия, неполное утопление, прием лекарственных препаратов (например, героин, ацстилсалициловая кислота), а также синдром диссеминированного внутрисосудистою свертывания (ДВС). От момента появления клинических симптомов РДСВ до начала острой дыхательной недостаточности проходит обычно менее 24 ч, но этот период может составлять и 2-3 сут.
3. Первая помощь больным с ОЛНД заключается в обеспечении адекватной оксигенации артериальной крови и стабилизации гемодинамики больного. При лечении некоторых пациентов удается обойтись без интубации трахеи, но в большинстве случаев значительный положительный эффект может быть достигнут при проведении ИВЛ с высоким дыхательным объемом и положительным давлением в конце выдоха (ПДКВ) с целью увеличения среднего давления в дыхательных путях и обеспечения раздувания ателектазированных и заполненных жидкостью альвеол, а также улучшения газообмена. Оптимальный уровень ПДКВ зависит от конечной цели терапии. Обычно ПДКВ используют для повышения оксигенации и снижения фракции кислорода в дыхательной смеси до 0,5—0,6. ПДКВ следует поддерживать на минимально возможном уровне во избежание баротравмы и снижения сердечного выброса, что наблюдается при высоких значениях этого давления. Большое внимание уделяется мониторингу таких показателей адекватности перфузии органов, как объем мочеотделения, уровень сознания больного, рН крови, определяемый методом термодилюции сердечный выброс.
4. Гипотензия у больного с давлением заклинивания менее 6 мм рт. ст. служит показанием для увеличения объема внутрисосудистой жидкости путем переливания эритромассы, в том случае если гематокрит не превышает 35%; при других состояниях рекомендуется инфузия кристаллоидных (но не коллоидных) растворов. При гипотензии у больного сРкз составляющим 6- 12 мм рт. ст., можно начать капельное введение вазопрессоров для поддержания адекватного сердечного выброса и оксигенации тканей, не допуская в то же время подъема давления в левом предсердии до уровня, который мог бы вызвать отек легких.
5. Острый ОЛНД может встречаться при. наличии высокого риска развития первичной легочной инфекции, а именно у больных с иммунодефицитом. Поэтому врач, наблюдающий больного с РДСВ, должен учитывать вероятность сопутствующей поддающейся терапии инфекции легких. Необходимость применения кортикостероидов остается под вопросом, за исключением случаев ОЛНД вследствие жировой эмболии. В настоящее время проводятся проспективные исследования по изучению эффективности антиоксидантов и ингибиторов простагландинов в терапии ОЛНД.
6. Прекращение ИВЛ и ПДКВ у больных с ОЛНД должно быть постепенным. Показанием для прекращения ИВЛ служит отсутствие выраженного инфекционного процесса в легких, адекватная оксигенация артериальной крови при FiO2 < 0,5, общая статическая податливость > 25 мл/см Н2О; в качестве первого шага, ступснчато, по 3-5 см вод. ст., снижают ПДКВ.
Глава 43
ОСТРЫЙ ОТЕК ЛЕГКИХ ПРИ ВЫСОКОМ ДАВЛЕНИИ В ЛЕГОЧНОЙ АРТЕРИИ
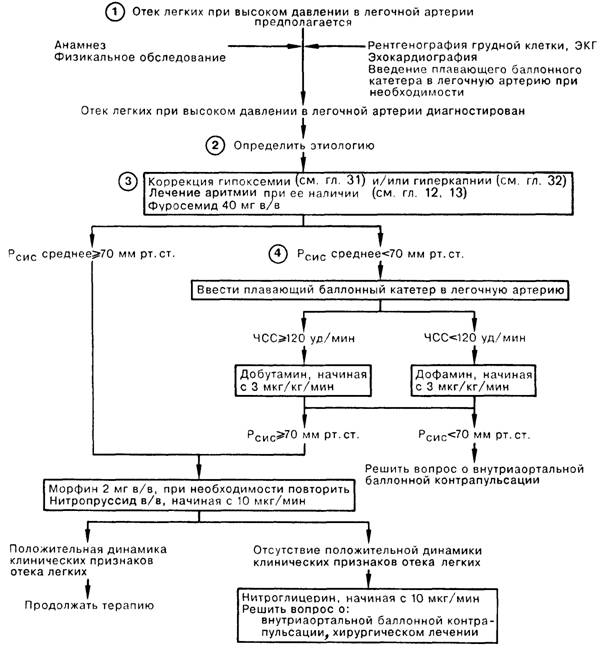
1. Диагноз острого отека легких на фоне повышенного легочного венозного давления может быть установлен на основе данных анамнеза и физикального обследования. В анамнезе иногда можно обнаружить факторы, способствовавшие острому отеку легких (например, жалобы на боль в груди, которая может быть отнесена на счет острой ишемии миокарда и дисфункции левого желудочка, или указания на недавно начавшуюся аритмию). Диагностическую концепцию, возникшую на основании клинических признаков отека легких, обычно подтверждает рентгенография грудной клетки, на которой можно обнаружить признаки отека легких и кардиомегалию. Иногда данные клинического обследования не позволяют сделать однозначного вывода; в этом случае для установления диагноза отека легких с повышенным давлением в легочной артерии необходимо провести измерение капиллярного давления заклинивания в ЛА.
2. Этиология острого отека легких с высоким давлением в ЛА зависит от лежащего в его основе заболевания сердца. Провоцировать отек легких могут заболевания, непосредственно отражающиеся на функции миокарда (ишемическая болезнь сердца, кардиомиопатии, миокардит), врожденные или приобретенные пороки сердца (например, стеноз устья аорты или недостаточность аортального клапана, стеноз или недостаточность митрального клапана), аритмии сердца, выраженная анемия.
3. Коррекция гипоксемии проводится увеличением фракции кислорода в дыхательной смеси. При значительно выраженной дыхательной недостаточности может возникнуть необходимость интубации трахеи и проведения ИВЛ перемежающимся положительным давлением. Лечение аритмии в каждом конкретном случае заключается в медикаментозной терапии, кардиоверсии либо эндокардиальной стимуляции. Снижения давления в легочной артерии в первую очередь можно добиться введением диуретиков. Вводимый в/в фуросемид оказывает немедленный эффект благодаря дилатации вен еще до проявления его диуретического действия. Снижение преднагрузки также способствует уменьшению потребности миокарда в кислороде; морфин вводят в дозе 2 мг в/в, если значение среднего системного давления равно или более 70 мм рт. ст. При удовлетворительном уровне среднего системного давления снижения преднагрузки можно добиться в/в инфузией нитропруссида. Если лечение по такой схеме не приведет к улучшению состояния больного, следует начать в/в инфузию нитроглицерина; при неэффективности и этого препарата нужно рассмотреть возможность проведения внутриаортальной баллонной контрапульсации. При наличии показаний следует рассмотреть необходимость хирургического лечения, например аортокоронарного шунтирования.
4. Если среднее системное давление сохраняется на уровне менее 70 мм рт.ст., особенно у больного с низким сердечным выбросом, улучшить функциональное состояние миокарда можно в/в введением добутамина (при ЧСС > 120 уд/мин) либо в/в введением дофамина (при ЧСС < 120 уд/мин). Показанием к применению контрапульсации является невозможность поднять среднее системное давление до уровня более 70 мм рт. ст. одной лишь медикаментозной терапией. Добившись повышения среднего системного давления более 70 мм рт.ст., следует начать в/в введение морфина или нитропруссида.
Глава 44
ДЕКОМПЕНСАЦИЯ ДЫХАНИЯ У БОЛЬНЫХ С ХРОНИЧЕСКИМИ ОБСТРУКТИВНЫМИ ЗАБОЛЕВАНИЯМИ ЛЕГКИХ
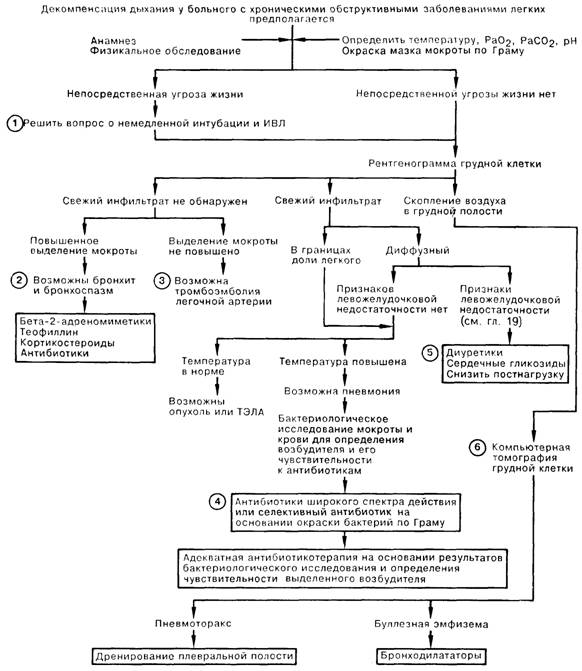
1. У больных с хроническими неспецифическими заболеваниями легких (ХНЗЛ) декомпенсация дыхания может наступить внезапно или нарастать постепенно. Больному, состояние которого ухудшается без надежды на скорую положительную динамику в результате одной лишь медикаментозной терапии, следует немедленно провести интубацию трахеи и начать ИВЛ до выяснения причин данной декомпенсации.
2. Наиболее частой причиной острой дыхательной недостаточности у больных с ХНЗЛ является обострение хронического бронхита с прогрессирующим бронхоспазмом. Несмотря на то что большинство бронхитов вызваны вирусами и эффективность антибиотиков не подтверждена, многие врачи эмпирически назначают тетрациклин или ампициллин в дозе 500 мг через каждые 6 ч. Даже в отсутствие свистящего дыхания потенциально поддающаяся коррекции обструкция дыхательных путей требует лечения ингаляционными формами бета-2-адреномиметических препаратов [сульфат орципреналина (Астмопент) по 10 мг в виде аэрозоля каждые 30-60 мин], в/в введения теофиллина (эуфиллин в насыщающей дозе 5 мг/кг, впоследствии по 0,5 мг/кг каждый час для достижения сывороточной концентрации теофиллина 10—20 мкг/мл), а также в/в введения кортикостероидов (метилпреднизолон по 125 мг каждые 6 ч).
3. Изменения в легких, обнаруживаемые при перфузионном и вентиляционном сканировании у больных сХНЗЛ, часто не зависят от наличия или отсутствия тромбоэмболии легочной артерии. Для окончательного диагноза необходимо проведение легочной ангиографии, кроме случаев, когда обнаружены сегментарные и субсегментарныс дефекты на перфузионных сканнограммах без аналогичных по локализации изменений на вентиляционных.
4. Внебольничные пневмонии у больных с ХНЗЛ обычно вызываются пневмококками или Н. influcnzac, и для их лечения, как правило, достаточно в/в введения ампициллина или цефамандола по 1 г каждые 6ч. В то же время тяжелым больным, в особенности в случае госпитальной пневмонии, антибактериальная терапия до получения результатов бактериологического исследования должна назначаться исходя из результатов окраски мазка мокроты по Граму либо эмпирически и включать антибиотики, эффективные в отношении золотистого стафилококка и грамотрицательных возбудителей. Антибактериальная терапия широкого спектра действия в вышеописанной ситуации может включать в/в введение нафциллина по 1 г каждые 4 ч и тобрамицина по 1,5 мг/кг каждые 8 ч.
5. Определенные сложности могут возникнуть при дифференциальной диагностике первично правожелудочковой и первично левожелудочковой сердечной недостаточности, особенно при наличии заболевания сердца у больного с ХНЗЛ. Лечебные мероприятия по поводу недостаточности левого желудочка оправданы при наличии клинических и рентгенологических признаков отека легких. В числе инструментальных методов исследования, используемых для количественной оценки сердечной и легочной функций, следует назвать определение давления заполнения левого желудочка с помощью катетеризации легочной артерии, радиоизотопное сканирование для определения лево- и правожелудочкового выброса, а также выполняемые у постели больного исследования функции дыхания.
6. Компьютерная томография может быть полезна для того, чтобы отличить буллезную эмфизему от пневмоторакса, но чаще всего необходимости в ее проведении не возникает.
Глава 45
ПОРАЖЕНИЯ ДИАФРАГМЫ
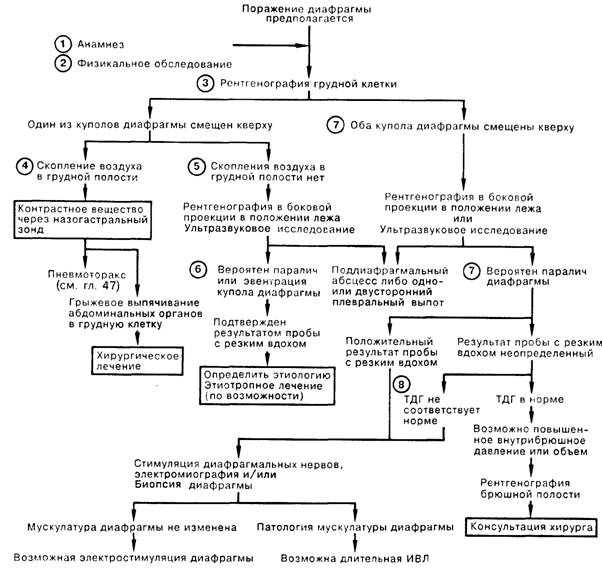
1. Травматический разрыв диафрагмального нерва (нервов) или разрыв одного (или обоих) купола диафрагмы может привести к внезапному прекращению дыхания. Многие диафрагмальные расстройства могут протекать бессимптомно либо с прогрессирующим диспноэ, которое усугубляется в положении лежа, когда органы брюшной полости сдвигают оба купола диафрагмы в сторону головы. Расстройство функции диафрагмы следует подозревать у больных, которые не могут дышать самостоятельно без ИВЛ, поскольку клинически значимые или субклинические формы нарушения функции куполов диафрагмы осложняют, вероятно, многие виды дыхательной недостаточности.
2. Недостаточность или дисфункция куполов диафрагмы приводит к мобилизации во время вдоха других дыхательных мышц; в том числе наружных межреберных и шейных мышц. Отсутствие движения вверх—вниз одного из куполов отражается в отсутствии бокового смещения соответствующей половины грудной клетки. Если это движение отсутствует у обоих куполов, то сокращение остальных дыхательных мышц создает отрицательное давление в плевральной полости, подтягивающее во время вдоха куполы диафрагмы в сторону головы, что в свою очередь создает отрицательное внутрибрюшное давление, из-за чего брюшная стенка вместо движения наружу втягивается внутрь. Это парадоксальное движение брюшной стенки может быть не замечено врачом у пациента, находящегося в положении стоя, так как оба купола диафрагмы будут пассивно опускаться при вдохе, а у больного, находящегося в положении лежа, вдох приводит к проявлению феномена.
3. У 20% здоровых людей на рентгенограмме грудной клетки в прямой проекции можно обнаружить, что правый купол диафрагмы проецируется на плоскость, уровень которой колеблется от верхнего края пятого ребра до шестого межреберного промежутка по передней стенке грудной клетки. Левый купол диафрагмы расположен ниже, чем правый, на расстоянии, составляющем от половины до одного межреберного промежутка. Экскурсия куполов диафрагмы при максимальном вдохе составляет от 3 до 6 см.
4. Грыжевое смещение органов брюшной полости может произойти через врожденный дефект в пояснично-реберном треугольнике либо в результате травматического разрыва, обычно при тупой абдоминальной травме. Чаще встречаются повреждения левого купола, возможно, благодаря тому, что печень защищает правую половину диафрагмы.
5. Эвентрацией называют врожденную аномалию, заключающуюся в нарушении развития мышц части купола, одной или обеих половин диафрагмы; обычно встречается лишь на левой стороне. Односторонний паралич наступает в результате нарушения проводимости диафрагмального нерва на стороне нарушения. Это состояние может быть идиопатическим, но чаще всего встречается при травме, оперативном вмешательстве или неопластическом заболевании. У взрослых односторонний паралич не нарушает или нарушает незначительно дыхательную функцию, кроме случаев, когда присоединяется другое заболевание, например пневмония; лечение требуется лишь по поводу второго заболевания. В то же время у новорожденных парадоксальный сдвиг парализованного купола диафрагмы в сторону головы может приводить к развитию дыхательной недостаточности.
6. Обнаруживаемые во время флюороскопии или ультразвукового исследования отсутствие смещения или смещение в сторону головы одного либо обоих куполов в ответ на резкое инспираторное движение (втягивание носом воздуха) могут встречаться при самых различных легочных плевральных и субдиафрагмальных расстройствах. Диагностическим критерием паралича диафрагмы служит ее парадоксальная экскурсия как минимум на 2 см в сторону головы при резком вдохе.
7. Двусторонний паралич диафрагмы может являться признаком мышечной слабости у больных с дыхательной недостаточностью самого различного генеза. Двусторонний паралич также может быть следствием повреждения шейного отдела спинного мозга на высоком уровне, проявлением генерализованного нейромы-шечного заболевания, например синдрома Гийена—Барре, либо возникать как изолированный феномен. В последних случаях паралич сам по себе служит причиной дыхательной недостаточности.
8. Так как при вдохе дыхательные мышцы сокращаются, а купола диафрагмы пассивно смещаются в сторону головы, и давление в плевральном пространстве, и давление в брюшной полости остаются отрицательными; следовательно, трансдиафрагмальный градиент давления (ТДГ) не возникает. Измерение этого градиента посредством введения пищеводного и желудочного баллонов служит окончательным диагностическим тестом для распознавания двустороннего паралича диафрагмы.
9. Успешное лечение основного заболевания при расстройстве функции диафрагмы вследствие мышечной слабости обычно приводит к обратному развитию имеющихся нарушений. Паралич, возникший на фоне нейромышечного заболевания, обычно требует проведения длительной ИВЛ, чаще всего в режиме перемежающегося положительного давления. Для больных с неповрежденной мышцей диафрагмы следует рассмотреть возможность электрической стимуляции диафрагмальных нервов на уровне грудного или шейного отдела.
Глава 46
АСПИРАЦИЯ ЖЕЛУДОЧНОГО СОДЕРЖИМОГО В ДЫХАТЕЛЬНЫЕ ПУТИ
1. К первой группе факторов, предрасполагающих к аспирации желудочного содержимого, относятся: увеличение объема желудочного содержимого или повышение внутрижелудочного давления, наблюдаемые при обструкции привратника или асците. Факторы, которые позволяют осуществиться забросу содержимого желудка в глотку или провоцирующие этот заброс, составляют вторую группу. К ним относят грыжу пищеводного отверстия диафрагмы, а также введение гастроскопа. К третьей группе предрасполагающих факторов относят нарушения функции глотки, наступающие, например, при коме или местной анестезии и допускающие движение жидкого желудочного содержимого в трахею. Профилактика имеет решающее значение; среди больных с подтвержденной аспирацией смертность достигает 50%. Важное значение имеет тщательный уход за больными из группы риска по этому осложнению. Например, введение назогастрального зонда не всегда позволяет эффективно эвакуировать желудочное содержимое, но может привести к функциональной несостоятельности желудочно-пищеводного соединения, а также спровоцировать рвоту во время его введения. При уходе за больным, находящимся в полукоматозном состоянии, ему следует придать положение «лежа на боку» со слегка опущенной головой, а при кормлении через назогастральный зонд голову больного следует приподнять. При нарушении глотания или затемненном сознании иногда приходится вводить больному эндотрахеальную трубку с манжеткой.