знаками общей воспалительной реакции с тяжелым клиническим течением и приводящее к полиорганной недостаточности вследствие неспособности иммунных сил организма к локализации инфекции.
Классификация сепсиса:
• по локализации первичного очага: общехирургический, раневой (ожоговый), посттравматический, абдоминальный, ангиогенный, урологический, гинекологический;
• по виду и характеру возбудителя: вызванный аэробной флорой: грампо-ложительный сепсис — стафилококковый, стрептококковый; грамот-рицательный сепсис: колибациллярный, псевдомонозный, протейный; вызванный анаэробной флорой: клостридиальный; неклостридиальный;
• по характеру генерализации инфекции: септицемия (сепсис без метастазов), пиемия (сепсис с метастазами) и септикопиемия (смешанные формы сепсиса);
• по фазам развития: фаза напряжения (реакция организма в ответ на внедрение возбудителя в условиях несостоятельности его защитных сил); катаболическая фаза (прогрессивная недостаточность ферментных и структурных факторов с развитием недостаточности систем организма), анаболическая фаза (восстановление организмом утраченных резервных материалов);
• по клиническому течению: молниеносный — клиническая картина развертывается в течение 1—2 сут; острый — в течение 5—7 сут без ремиссий; подострый — 7—14 сут; хронический — более 3 мес и нередкими ремиссиями;
• по времени развития: ранний, возникающий в сроки до 2 нед; поздний — более 2 нед.
Существуют также критерии диагностики и классификация, предложенные Чикагской согласительной конференцией Американского колледжа торакальных врачей и Общества специалистов критической медицины (табл. 17.7).
|
|
Таблица 17.7. Классификация сепсиса
| Клинический синдром | Характеристика |
| ССВР Сепсис Легкий сепсис Сепсис средней тяжести Тяжелый сепсис Септический шок | Синдром системной воспалительной реакции на различные тяжелые повреждения тканей, проявляющийся двумя и более из следующих признаков: — температура тела выше 38 °С или ниже 36 °С; — тахикардия более 90 уд/мин; — частота дыхания более 20 в 1 мин; — число лейкоцитов более 12 • 109/л, палочкоядерных нейтрофилов — менее 4 • 109/л или не менее 10 % незрелых клеток (палочкоядерные, юные) ССВР при выявлении очага инфекции ССВР + гнойно-воспалительный очаг + полиорганная дисфункция по 1—2 системам ССВР + гнойно-воспалительный очаг + полиорганная дисфункция по 3 системам и более ССВР + гнойно-воспалительный очаг + полиорганная недостаточность Сепсис с гипотензией (ниже 90 мм рт. ст.), сохраняющейся несмотря на адекватную коррекцию гиповоле-мии + синдром гипоциркуляции |
Продолжение
| Клинический синдром | Характеристика |
| Синдром полиорганной дисфункции Синдром полиорганной недостаточности | Органные функциональные нарушения печени, почек, легких, сердца, головного мозга, костного мозга, своевременная и адекватная терапия которых позволяет ликвидировать дисфункцию в сроки до 7 сут Органные нарушения печени, легких, сердца, головного мозга, костного мозга, при которых даже своевременная и адекватная терапия не позволяет ликвидировать недостаточность в сроки до 7 сут |
Помимо воспалительного процесса, ССВР может быть вызван неинфекционными причинами — панкреатит, ишемия, тяжелая сочетанная травма (ранения), геморрагический шок, повреждения органа иммунологического характера или экзогенное введение медиаторов воспаления (фактор некроза опухоли, цитокины).
|
|
17.8.1. Этиология и патогенез сепсиса
Возбудителями сепсиса могут являться бактерии и грибы; на долю первых приходится более 95 % случаев, а также почти все существующие патогенные и условно-патогенные бактерии. Этиологическая структура сепсиса периодически меняется в связи с трансформацией патогенных свойств микробов, изменением реактивности макроорганизма и экологических условий.
Для стафилококкового сепсиса характерны пиемические метастазы в различные органы и частые септические пневмонии. Входными воротами инфекции, как правило, являются обширные раневые поверхности, особенно при наличии некротизированных тканей и нарушении оттока гнойного отделяемого. В закрытых очагах при наличии фиброзной капсулы стафилококки могут долго сохраняться, являясь источником дремлющей инфекции.
Общая стрептококковая инфекция отличается тяжестью клинического течения и отсутствием метастазов. Стрептококки чаще, чем стафилококки, распространяются по лимфатическим путям, вызывая лимфангиты и лимфадениты. Возбудители продуцируют агрессивные и повреждающие факторы. Для стрептококкового сепсиса характерно частое сочетание с другими видами возбудителей. Приобретенный иммунитет нестоек. Чаще вьщеляют гемокультуры пиогенного стрептококка, зеленящего и гемолитического стрептококков, реже — пневмококков.
Синегнойный сепсис — один из наиболее тяжелых, часто протекает молниеносно с выраженным инфекционно-токсическим шоком. Возбудитель обитает на ожоговых поверхностях, реже — в гнойных затеках. Патогенетическим фактором является эндотоксин, обладающий выраженными протео-литическими свойствами. Специфический иммунитет обычно отсутствует. Синегнойная палочка выделяется в ассоциации со стрептококками.
|
|
В симбиозе с синегнойной палочкой и другими аэробными и анаэробными бактериями часто находится протей, что приводит к развитию смешанной инфекции, или суперинфекции. В сочетании с гнилостными анаэробами он вызывает воспаление, по клиническим проявлениям сходное с газовой гангреной. Патогенность протея обусловлена наличием у него
гиауронидазной активности и токсигенности, а клиническая картина — быстрым распространением некрозов по клетчатке и фасциальным пространствам.
Кишечная палочка является основным возбудителем абдоминального сепсиса и нередко вызывает эндотоксический шок. Из первичного очага инфекции чаще выделяется в ассоциации с другими видами бактерий, в том числе с анаэробами.
Вопрос об этиологической роли спорообразующих аэробных бактерий рода Bacillus при бактериемии решается неоднозначно. Большинство исследователей считают их контаминантами, загрязняющими кровь при взятии биологического материала или в процессе субкультивирования. Согласно другой точке зрения, относительно безвредные микроорганизмы могут служить причиной опасных осложнений у ослабленных больных.
Анаэробные септицемии нередко вызываются токсигенными клостридия-ми. Анаэробная инфекция чаще обусловлена полимикробной ассоциацией, но в каждом случае преобладает определенный микроб, накладывающий отпечаток на течение заболевания. Для С. perfringens характерно газообразование в ране, С. oedematiens вызывают отек, а С. septicum — некроз тканей. Клостридиальная инфекция очень редко сопровождается метастазиро-ванием, но обычно протекает тяжело с высокой летальностью.
В последние годы в связи с совершенствованием бактериологических методов диагностики чаще выявляют неспороносные анаэробы: бактероиды, фузобактерии, пептококки, пептострептококки. Наиболее распространены бактероиды, обусловливающие своеобразную клиническую картину сепсиса — образование метастатических гнойников в крупных суставах, брюшной и плевральной полостях, легких, головном мозге и других висцеральных органах. Они продуцируют протеолитические ферменты, способствующие усилению инвазивных свойств и распространению других возбудителей, а также энзим, разрушающий гепарин, что ведет к образованию тромбозов и эмболии. В их присутствии чаще наблюдается ДВС-синдром.
Кандидаты й сепсис возникает значительно реже и вызывается в основном С. albicans и С. tropicalis. Генерализация инфекции обусловлена выделением токсичных субстанций и способностью дрожжеподобных грибов рода Candida размножаться в макрофагах. Иммунитет к ним не вырабатывается.
В настоящее время в этиологии раневой инфекции возрастает удельный вес полимикробного сепсиса (10—50 % случаев), что отражает общую тенденцию в эволюции заболеваний, вызываемых условно-патогенными бактериями.
Интегральное взаимодействие макро- и микроорганизма носит динамический характер, и системная воспалительная реакция вначале в виде локального ответа на повреждение или инфекцию при сепсисе может быстро стать хаотическим нарушением всех механизмов противоинфекционной защиты.
Центральным звеном патогенеза грамотрицательного сепсиса является эндотоксин, или липополисахарид. Последний в комплексе с липополисаха-ридсвязывающим белком активирует макрофаги и синтез в них провоспа-лительных антигенов. Последние обладают широким спектром биологического действия, проявляющегося в многообразных изменениях метаболизма, гемопоэза, свойств сосудистой стенки, функции регуляторных систем, в первую очередь ЦНС. При высокой концентрации эндотоксина в крови возможна агломерация или опсонизация клеток организма, в том числе эн-дотелиальных. Прямое повреждение клеток эндотелия играет большую роль в развитии полиорганной недостаточности.
Патогенез грамположительного сепсиса обусловлен взаимодействием поверхностных структур микробных клеток с компонентами иммунной системы человека.
Следует отметить, что при септических состояниях в процессе лизиса бактерий происходит накопление так называемых молекул средней массы, ингибирующих ряд метаболических процессов и нарушающих многие функции форменных элементов крови.
Таким образом, начальным этапом в развитии «каскада» септических реакций является появление в сосудистом русле больного антигенов, выполняющих роль триггера (спускового курка), провоцирующего запуск эндотоксина при грамотрицательной бактериемии, бактериальных грамположи-тельных или дрожжевых фрагментов стенок, частиц вирусов или грибов, продуктов разрушения собственных тканей организма.
Активация иммунитета в ответ на инвазию антигенов, кроме защитной функции, имеет оборотную сторону — выделение большого числа провоспалительных агентов (фактор некроза опухолей — альфа, интерлейкин-1р, 2, 6, 8, 15, фактор активации тромбоцитов, тромбоксан, фосфолипаза А2, свободные радикалы кислорода, простациклин, простагландины, интерферон-у), играющих патогенетическую роль в развитии системного воспаления и интоксикации.
Часть из них (фактор некроза опухолей-альфа, фактор активации тромбоцитов, тромбоксан) в значительной степени ответственны за развитие синдрома внутрисо-судистого диссеминированного свертывания, другие (ИЛ-1, лейкотриены, эндоте-лиальный фактор релаксации, эндотелии-1, тромбоксан А2, интерферон-у) способствуют повышению проницаемости сосудистой стенки при сепсисе. Нарушение функции эндотелия является центральным звеном распространения системного воспаления за границы сосудистого русла и его неблагоприятного действия на печень, почки, легкие, центральную нервную систему. Вслед за повреждением эндотелия нарушается метаболическая активность клеток этих и других органов, проявляющаяся снижением тонуса сосудов, нарушением режима микроциркуляции — признаками полиорганной недостаточности.
Иммунная система организма, помимо различных активирующих цито-кинов, способна продуцировать и их инактиваторы, противовоспалительные агенты (ИЛ-4,10,13, ИЛ-1 и ИЛ-2 растворимый рецептор, белки, связывающие липополисахариды, трансформирующий фактор роста-р\ адреналин, ФНО-а растворимый рецептор, антагонист рецептора лейкотриена В4, белок «теплового шока»).
В случае нормального течения инфекционного процесса достигается равновесие активности провоспалительных и противовоспалительных цито-кинов.
Разбалансированный иммунный ответ может проявляться активацией про-и противовоспалительных агентов и постоянными их колебаниями, что клинически обычно соответствует фазе синдрома полиорганной недостаточности. Длительно существующие нарушения иммунных реакций обусловливают постепенный переход сепсиса в форму под острого и далее хронического.
Клиническая картина сепсиса в большой степени обусловлена характером резистентности организма больного, выраженностью ответной реакции на внедрение и распространение микроорганизмов, их количеством и вирулентностью.
Классические проявления системной воспалительной реакции, составляющие симптомокомплекс сепсиса (лихорадка, тахикардия, одышка и лейкоцитоз), недостаточно чувствительны и специфичны для точной диагностики. Клиническая картина, подобная сепсису, нередко наблюдается у пациентов со стерильными формами панкреонекроза, тяжелой травмой, ожога-
(^pg!2^2Ј^
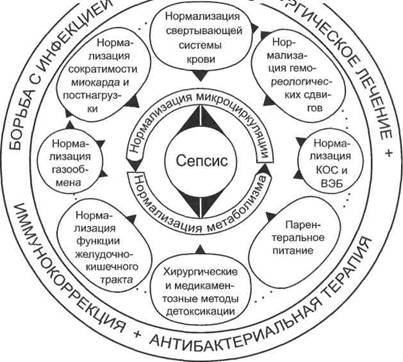
Рис. 17.21. Основные компоненты интенсивной терапии сепсиса.
ми, лекарственной реакцией, после обширных хирургических вмешательств и даже при тяжелой сердечной недостаточности.
Одним из наиболее частых симптомов, присущих сепсису, является изменение терморегуляции в сторону гипертермии (чаще всего) или гипотермии (реже). Повышение температуры тела вызывают пирогенные цитокины (прямое и опосредованное действие на гипоталамус), которые выделяют в кровь преимущественно моноциты и макрофаги в ответ на внедрение инфекции. Наиболее типична для сепсиса нестабильная гипертермия в течение суток: характерны внезапные кратковременные подъемы температуры тела один или несколько раз в течение суток с последующим литическим снижением, проливными потами, слабостью, тахикардией и одышкой. Озноб свидетельствует о массивной инвазии тканевых и микробных антигенов. Данный период является наиболее благоприятным для диагностического посева крови на гемокультуру.
Прогностически неблагоприятным признаком является неожиданное снижение температуры тела у таких больных до нормы (или даже ниже нормы) при отсутствии положительной динамики общего состояния.
Бактериемия и сепсис. Бактериемия — присутствие микроорганизма в системном кровотоке — не является обязательным проявлением сепсиса. Обнаружение микроорганизмов у лиц без клинико-лабораторных подтверждений синдрома системного воспалительного ответа, но при наличии
факторов риска должно расцениваться не как сепсис, а как транзиторная бактериемия. Ее возникновение описано после лечебных и диагностических манипуляций, таких как бронхо- и фиброгастроскопия, колоноско-пия, стоматологические манипуляции.
Даже при самом скрупулезном соблюдении техники забора крови и использовании современных технологий идентификации микроорганизмов частота положительных результатов при посевах крови не превышает 55 %. Традиционным методом диагностики сепсиса является посев крови, при этом частота выделения гемокультуры существенно варьирует (от 22,5 до 87,5 %) и в значительной степени зависит от методики исследования.
Лечение хирургического сепсиса, основу которого составляет гнойный очаг, инициирующий генерализованную инфекцию, должно быть комбинированным (рис. 17.21).
Хирургическая санация — прекращение поступления микроорганизмов из очага инфекции посредством вскрытия очага с удалением гноя и некроти-зированных тканей, а также адекватного дренирования гнойной полости, занимает ведущее место.
17.8.2. Приоритетные методы интенсивной терапии сепсиса
Рациональный выбор режима антибактериальной терапии сепсиса определяется локализацией источника (очага) инфекции и условиями возникновения инфекции (внебольничная или госпитальная). Если есть основания предположить внебольничный характер инфекции, то препаратами выбора могут быть целофалоспорины III поколения (цефотаксим, цефтриак-сон). Допустимо также использование цефалоспоринов II поколения или защищенных пенициллинов в комбинации с аминогликозидами.
Инфузионная терапия при сепсисе способствует восстановлению адекватной тканевой и органной перфузии, повышению потребления кислорода тканями, коррекции гомеостатических расстройств, снижению концентрации токсических субстанций и медиаторов септического каскада.
Инфузионная программа зависит от степени гиповолемии, фазы ДВС-синдрома, уровня альбумина крови, тяжести респираторного дистресс-синдрома. Плазмозаменители (декстраны, желатиноль, гидроксиэтиламидоны) показаны при выраженном дефиците ОЦК, сочетающемся с артериальной гипотензией. Переливание альбумина имеет преимущество перед искусственными плазмозаменителями при уровне альбумина менее 25—30 г/л.
Применение криоплазмы (15 мл/кг массы) показано при дефиците антитромбина III (AT III) или плазменных факторов коагуляции.
Восстановлению адекватной тканевой и органной перфузии способствуют инфузионно-трансфузионная терапия в режиме гемодилюции и использование гепарина (10—20 тыс. ЕД/сут внутривенно), трентала — 10—20 мл/сут.
При сердечной недостаточности начинают инфузию добутрекса (5— 7,5 мкг/кг/мин) или допамина (5—10 мкг/кг/мин). При развитии септического шокового синдрома показано введение адреналина (0,05—0,1 мкг/кг/мин).
Адекватная и своевременная респираторная поддержка — один из главных моментов лечения сепсиса. Для купирования респираторного дистресс-синдрома используют механическую вентиляцию легких, кортикостероиды, му-колитические средства, синтетические и естественные сурфактанты.
При тяжелом течении сепсиса наблюдается развитие вторичного иммунодефицита, наиболее типичного для хирургической инфекции. Направленная иммунокоррекция проводится в соответствии с выявленным дефек-
том конкретного звена иммунитета — заместительная (взвесь лейкоцитов, интерферон, гипериммунная антистафилококковая плазма, иммуноглобулины для внутривенного введения и др.), иммуностимулирующая (стафилококковый анатоксин, тималин и др.) терапия.
Ингибиторы свободных радикалов показаны в силу активации при сепсисе процессов свободнорадикального окисления и развития дисбаланса в системе перекисного окисления липидов — антиоксидантной системы, усиливающего структурные органные повреждения. Наибольшее увеличение скорости свободнорадикального окисления наблюдается при сепсисе, сочетающемся с респираторным дистресс-синдромом. Для повышения антиокислительного потенциала к терапии добавляют унитиол, витамин С, токоферол, синтетические антиоксиданты (эмоксипин, мексидол и др.).
Современные методы лечения сепсиса предусматривают цитокиновую терапию [ронколейкин (ИЛ-2), беталейкин (ИЛ-ip), рекомбинантный гра-нулоцитарно-макрофагальный колониестимулирующий фактор и др.)].
Восстановление функции печени осуществляют внутрипортальной оксиге-нацией, введением эссенциальных фосфолипидов, даларгина, трансплантации изолированных гепатоцитов.
Тяжелый сепсис, как правило, сопровождается проявлениями гиперметаболизма. В этой ситуации покрытие энергетических потребностей происходит за счет деструкции собственных клеточных структур («аутоканниба-лизм»), что усугубляет органную дисфункцию и усиливает эндотоксикоз. Поэтому проведение искусственной питательной поддержки является очень важным компонентом лечения. Оптимальное суточное потребление энергии — 30—35 ккал/кг. Назначают энтеральное питание специальными смесями, которые сбалансированы по основным питательным компонентам, высококалорийны, содержат добавки микроэлементов и витаминов. Энтеральное питание предупреждает транслокацию микрофлоры из кишечника, развитие дисбактериоза, повышает функциональную активность энтероци-та и защитные свойства слизистой оболочки, снижая степень эндотоксико-за и риск возникновения вторичных инфекционных осложнений.
Наиболее эффективными методами детоксикации при сепсисе являются экстракорпоральные — обменный плазмаферез, перфузия крови через свиную селезенку, плазмосорбция.
17.8.3. Клинические формы хирургического сепсиса
Клинические формы хирургического сепсиса вариабильны.
Абдоминальный сепсис является системной воспалительной реакцией организма в ответ на развитие первоначально деструктивного процесса в органах брюшной полости и/или забрюшинного пространства. Основу абдоминального сепсиса в подавляющем числе случаев составляет распространенный перитонит на почве деструктивных процессов или перфораций органов брюшной полости, а также в результате закрытой травмы и ранений живота, реже — послеоперационный.
Основную роль играет неэффективная хирургическая санация гнойно-воспалительного очага в брюшной полости, продолжающийся перитонит или несвоевременное хирургическое и интенсивное лечение (позднее поступление больных в стационар).
Схема комплексного лечения абдоминального сепсиса предусматривает воздействие на все звенья его патогенеза. После поступления больных в стационар проводят экстренную адекватную предоперационную подготовку
до стабилизации гемодинамики, уменьшения сгущения крови, разгрузки верхних отделов желудочно-кишечного тракта. Через 2—4 ч выполняют экстренную хирургическую операцию, направленную на удаление источника перитонита и тщательную санацию брюшной полости.
Важная роль в лечении абдоминального сепсиса отводится рациональной интенсивной терапии, основные принципы которой изложены в начале настоящей главы.
Сепсис с локализацией первичного очага в сосудистом русле (катетериза-ционный сепсис) возникает, если патогенные возбудители генерализованной инфекции и их токсины поступают в кровоток, минуя биологические барьеры организма. Проблема ангиогенного сепсиса в хирургии обусловлена широким внедрением в клиническую практику различных инвазивных методов диагностики и лечения заболеваний. Нарушение целости сосудистой стенки инструментами из синтетических материалов (катетеры, сосудистые трансплантаты, сердечные клапаны) повысило риск развития генерализованной инфекции.
17.9. Специфическая хирургическая инфекция 17.9.1. Столбняк
Столбняк (tetanus) — раневая инфекционная болезнь, вызываемая токсином анаэробной спороносной палочки Clostridium tetani при ее проникновении в организм через дефект кожи или слизистой оболочки, характеризующаяся поражением нервной системы, приступами тонических и тетани-ческих судорог, гипоксией и сердечно-легочной недостаточностью.
Заболеваемость столбняком во всем мире сохраняется на достаточно высоком уровне, несмотря на широкий охват населения вакцинопрофилакти-кой. Частота осложнений ран столбняком составляет 0,6—0,7 на 1 тыс. ранений. Летальность составляет 25—50 % среди больных молодого возраста и 70—80 % среди лиц пожилого возраста.
Возбудитель столбняка cl. tetani — строго анаэробный, спорообразую-щий, грамположительный микроб. Споры его высокоустойчивы, они могут выжить при кипячении и сухом нагревании до 150 °С в течение 1 ч; в обычных условиях сохраняются десятилетиями. Входными воротами для столбняка могут служить любые, даже самые незначительные раны. В военное время это, как правило, огнестрельные раны, а в мирное — микротравмы, особенно содержащие инородные тела.
Распространяется столбнячный токсин из места его образования или введения несколькими путями: по окружающим тканям, по лимфатической и кровяной системе, по нервным стволам. При распространении столбнячного токсина по регионарному невральному пути возникает относительно локальное поражение соответствующих нервных центров, которое проявляется развитием местного столбняка соответствующих мышц. Если количество столбнячного токсина значительно, он может далее распространяться по спинному мозгу в восходящем направлении, охватывая новые нервные центры (восходящий столбняк). При поступлении столбнячного токсина первоначально в кровь он разносится по всему организму (гематогенный путь распространения), попадает в мышцы и затем по двигательным нервам, составляющим общий невральный путь, достигает различных двигательных центров. Время поступления его в центры находится в прямой за-
висимости от длины каждого нерва. Поэтому вначале столбнячный токсин достигает двигательных центров мимических и жевательных мышц, затем мышц шеи, спины, а на более поздних этапах поражаются центры мышц рук и ног. Нисходящее движение столбнячного токсина имеет место в том случае, когда возникает депо столбнячного токсина в верхних отделах спинного мозга (при лицевом столбняке). При генерализованном процесе в последнюю очередь вовлекаются дыхательные мышцы, в частности диафрагма.
Клиническая картина. Поражение вегетативных центров проявляется в виде проливного пота, гиперпирексии, тахикардии, наклонности к гипо-тензии. Меньшую роль играет прямое патологическое влияние токсина на сердце, легкие, кровь, печень.
Лимфатические узлы при столбняке могут выполнять роль временных резервуаров столбнячного экзотоксина.
Различают общую и местную форму столбняка. Последняя встречается редко и сопровождается длительной ригидностью конечности, на которой имеется рана. Такая форма заболевания не опасна для жизни, так как судороги самостоятельно ликвидируются на фоне лечения раны.
Типичной местной разновидностью является лицевой столбняк Розе, при котором наряду с тризмом на пораженной стороне развивается паралич мышц лица, нередко и мышц глазного яблока, а на противоположной стороне обычно отмечается напряжение мышц лица и сужение глазной щели.
Однако местные формы столбняка могут привести и к летальному исходу из-за развития ларингоспазма.
Классическое описание клинической картины столбняка было дано еще Гиппократом, сын которого умер от этой грозной инфекции. Болезнь всегда проявляется триадой симптомов: тризмом, дисфагией и ригидностью затылочных мышц. Наиболее ранним и имеющим особое диагностическое значение симптомом столбняка является тризм — тоническое сокращение жевательных мышц. В начале заболевания тризм проявляется умеренным затруднением при жевании и открывании рта, а затем прогрессирует вплоть до полной невозможности разомнуть зубы. При этом отмечаются боли в горле и расстройства глотания.
Для клинической картины столбняка также характерна сардоническая улыбка, возникающая вследствие тонического сокращения мимических мышц и придающая лицу своеобразное выражение одновременно улыбки и плача.
К тризму и дисфагии последовательно в нисходящем порядке присоединяются «тянущие» боли и ригидность затылочных мышц, которая распространяется на длинные мышцы спины, поясницы, передней брюшной стенки и проксимальных отделов конечностей.
Судороги вначале проявляются в виде спастической ригидности, распространяющейся сверху вниз и постепенно захватывающей мышцы туловища и нижних конечностей.
На фоне тонического гипертонуса возникают приступы болезненных клонических судорог, провоцируемых любыми, даже незначительными раздражителями (свет, звук, прикосновение).
Быстрое нарастание клинических симптомов столбняка свидетельствует о глубокой степени интоксикации организма и тяжести заболевания.
А При столбняке I степени тяжести продолжительность инкубационного периода составляет 3 нед, начального — 5 сут и более, а средние сроки обращения больных за медицинской помощью — 5—7 дней заболевания. Судорожный синдром в основном проявляется в виде умеренного гиперто-
нуса мышц спины, брюшного пресса. Непостоянные легкие клонические судороги не вызывают расстройств дыхания. Больные полностью сохраняют способность жевать и проглатывать пищу. Все симптомы самостоятельно исчезают за 2—3 нед.
А Инкубационный период при столбняке II степени тяжести составляет 2 нед, начальный — 4 сут и более, больных госпитализируют на 4—5-й день заболевания. Клиническая картина либо вовсе не нарастает, либо прогрессирует очень медленно. Мышечный гипертонус выражен умеренно, редкие клонические судороги практически не сопровождаются нарушением дыхания. Жевание и глотание пищи затруднены в значительной степени. Общая продолжительность болезни не превышает 3 нед.
Л При столбняке III степени тяжести инкубационный период колеблется от 9 до 15 сут, начальный период составляет 3—4 сут, а больных обычно госпитализируют на 2—3-й день заболевания. Уже при поступлении возможны сильные приступы клонико-тонических судорог с опасными расстройствами дыхания. Поэтому врач, принимающий больного, должен быть готов к оказанию помощи при внезапном приступе апноэтического криза. Частота и сила судорог прогрессируют очень быстро, буквально по часам. Температура тела часто поднимается до 39 °С и выше, хотя может быть и субфебрильной. Пульс достигает 120—140 уд/мин. Резко выраженный тризм, расстройства глотания полностью исключают возможность кормления через рот. Введение нейролептической смеси, седуксена, гексе-нала, хлоралгидрата и других противосудорожных средств ликвидирует судороги при сохранении достаточного уровня спонтанного дыхания.
А Столбняк IV степени тяжести характеризуется наиболее коротким инкубационным периодом (5—8 сут), начальный период в большинстве наблюдений не превышает 1—1,5 сут, больных госпитализируют в 1-й день заболевания с уже выраженной клинической картиной и приступами судорог, ежеминутно угрожающими асфиксией. В ближайшие 1—2 сут, несмотря на введение предельно высоких доз наиболее сильных противосудорожных средств, приступы судорог усиливаются и учащаются, поэтому возникает необходимость систематического введения миорелаксантов с переводом больного на режим постоянной ИВЛ. Предельно высокий подъем температуры тела (40—41 °С) с тенденцией к дальнейшему росту может стать непосредственной причиной остановки сердца, если вовремя не прибегнуть к гипотермии — искусственному охлаждению больного. Тахикардия до 120—160 уд/мин может приводить к сердечной недостаточности. Тоны сердца глухие, отмечается наклонность к гипотензии. На ЭКГ регистрируют признаки ишемии и токсического поражения миокарда. При физикаль-ном и рентгенологическом исследовании легких определяется картина очаговой, сливной пневмонии, прогрессирующего застоя и начинающегося отека. Стул и мочеиспускание нередко задержаны.