Лечением онкологических больных занимаются взаимодействующие между собой врачи как минимум трех специальностей: онколог (химиотерапевт), хирург и специалист по лучевой терапии. Противоопухолевое лечение с использованием как стандартных, индивидуализированных, так и экспериментальных методов должно начинаться со сбора необходимой информации. В каждом случае необходимы гистологический диагноз, определение стадии заболевания, разработка программы лечения больного, определение прогноза заболевания.
При планировании лечения, оценке прогноза заболевания определяющее значение имеет стадия онкологического заболевания. Стандартного объема исследований, подходящего для всех клинических случаев, не суще-
ствует. В каждом конкретном случае выбирают те исследования, которые позволяют определить первичный очаг, поражение регионарных лимфатических узлов и наличие отдаленных метастазов. Вместе с тем обследование онкологических больных должно быть максимально возможным. Нельзя довольствоваться принципом достаточности («достаточно для начала лечения», «достаточно для выполнения оперативного вмешательства»).
Принципы хирургического лечения опухолей. Хирургическое лечение было первым успешным способом лечения онкологических заболеваний. С совершенствованием анестезиологического и реанимационного обеспечения расширяются возможности и хирургического лечения. Вместе с тем в последнее время при некоторых опухолях все чаще выполняют органосохра-няющие операции, позволяющие в значительной степени сохранить функцию органа, не изменяя прогноз заболевания.
Различают радикальные оперативные вмешательства, имеющие целью полное излечение больного от опухолевого заболевания, и паллиативные операции с целью предупреждения или устранения осложнений опухолевого процесса, улучшения качества и увеличения продолжительности жизни больного.
|
|
Основным принципом радикального хирургического вмешательства является полное удаление опухоли в пределах здоровых тканей. Удаление опухоли при радикальной операции производят не только с учетом ее инва-зивности, но также анатомо-физиологических особенностей органа или структуры, в которых располагается опухолевый очаг. Полнота удаления опухолевых элементов контролируется гистологическим исследованием пограничного среза ткани, что должно быть выполнено еще до полного окончания операции с тем, чтобы в случае обнаружения в этих срезах опухолевых элементов можно было расширить объем удаляемых тканей. Исходя из основного принципа радикальной операции, в большинстве случаев считается более целесообразной не резекция, а удаление всего пораженного органа (молочная железа, желчный пузырь, почка, надпочечники) или сообразно анатомо-физиологическому строению резекция сегмента, доли, части, отдела органа (легкие, желудок, пищевод, кишечник). Индивидуальный выбор вида радикальной операции основывается на понимании биологии опухолевого роста, оценке анатомической и функциональной операбельно-сти больного, типа и стадии опухоли, ее клинического течения.
При удалении злокачественной опухоли следует соблюдать принципы футлярности и зональности, учитывающие пути лимфовенозного оттока и топографоанатомические особенности расположения пораженного органа. Этой же цели подчинено соблюдение абластики — т. е. такой техники и методики оперативного вмешательства, которые исключают диссеминацию опухолевых элементов в процессе операции. Однако полная абластика в настоящее время недостижима, так как в крови и лимфе больного часто остаются опухолевые клетки, которые могут быть источником формирования ее метастазов. Для обеспечения максимального радикализма на основании этих принципов разработаны типовые схемы удаления в пределах здоровых тканей не только опухолевого очага, но и регионарных лимфатических узлов единым блоком. При раке желудка удаляют большую часть или весь желудок с большим и малым сальником и регионарными лимфатическими узлами, при раке матки — всю матку с обоими яичниками, трубами и широкими маточными связками, окружающей клетчаткой и лимфатическими узлами.
|
|
Выполнению основной цели оперативного вмешательства по поводу злокачественных новообразований способствует использование различных приемов антибластики, т. е. воздействия различными средствами на воз-
можно оставшиеся опухолевые клетки как в зоне оперативного вмешательства, так и за ее пределами. С этой целью производят обработку раневой поверхности и особенно ложа после удаления опухолевого очага и регионарных лимфатических узлов 70 % этиловым спиртом, химиотерапевтиче-скими препаратами, подвергают лучевой терапии в послеоперационном и предоперационном периодах.
Обязательным компонентом онкологической операции является хирургическая оценка стадии опухолевого процесса, что позволяет определить наиболее целесообразный и оптимальный объем хирургического вмешательства. При визуальных (наружных) новообразованиях такой объем может быть определен до операции, но при локализации опухолевого очага во внутренних органах окончательное решение принимают только после интраоперацион-ного обследования всей зоны предполагаемого вмешательства посредством осмотра, пальпации, биопсии опухолевого очага и регионарных лимфатических узлов, а также оценки морфологической характеристики опухоли.
|
|
При удалении опухолевого очага, пораженной части или всего органа, помимо общехирургических правил, необходимо соблюдение и специфических онкологических рекомендаций: ранняя перевязка или блокада кровеносных и лимфатических путей оттока из удаляемых тканей, минимальные манипуляции со злокачественной опухолью до и в процессе ее удаления, удаление «одним блоком» первичной опухоли и ее регионального распространения на прилежащие ткани и лимфатические узлы. Если до операции проводилась биопсия, то в удаляемый «блок» должен быть включен и био-псийный тракт. При резекции органа до окончания операции должна быть гистологически подтверждена ее адекватность. Инструменты, использовавшиеся при удалении опухоли, нельзя использовать для биопсии или повторного удаления препаратов.
Хирургическое вмешательство — радикальный метод лечения локализованных и местно-распространенных опухолей. Радикальный характер могут носить и операции, направленные на удаление одиночных метастазов при удаленном первичном очаге медленно растущей опухоли.
Хирургическое лечение может быть и паллиативным, направленным на остановку кровотечения, устранение обструктивного синдрома, купирование или уменьшение интенсивности болей. При некоторых опухолях, когда радикальная операция невозможна, в рамках комбинированного лечения проводят циторедуктивную операцию. Такой подход бывает успешным в детской онкологии, у взрослых — при лечении, например, рака яичников.
К числу других видов хирургического лечения по поводу новообразований относятся применение электрохирургических способов удаления опухоли, криодеструкции и криогенной терапии, лазерной технологии.
Полное удаление опухолевых очагов остается и в настоящее время единственным эффективным и предпочтительным методом лечения доброкачественных новообразований и многих злокачественных опухолей. Помимо этого, хирургическое лечение имеет ряд существенных преимуществ перед многими методами терапии новообразований. Эти преимущества состоят в основном в следующем:
• оперативное вмешательство и удаление опухоли не обладают потенциальным канцерогенным воздействием, и нет опухолей, резистентных к хирургическому лечению;
• оперативное вмешательство не сопряжено со сколько-нибудь значительным иммуносупрессивным воздействием, как лучевая и противоопухолевая химиотерапия;
• высокая эффективность хирургического лечения при всех недиссеми-нированных опухолях и ранних стадиях развития опухолевого процесса;
• одновременно с лечебным воздействием хирургическое вмешательство обеспечивает высокую точность морфологического диагноза, определение стадии заболевания и позволяет более обоснованно определить содержание и объем адъювантной терапии.
Недостатком хирургических методов лечения является неизбежность удаления части тканей, не пораженных опухолевым процессом, а также дополнительная для больного опасность хирургической агрессии и возможность связанных с ней осложнений хирургического, анестезиологического и реаниматологического происхождения. Кроме того, лишь около 30 % онкологических больных могут быть излечены с помощью только этого метода, а остальным оперируемым в последующем необходим тот или иной вид адъювантной терапии, так как у большинства из них к моменту операции уже имеются метастазы опухоли за пределами первичного очага.
По этим причинам хирургическое лечение как единственный метод терапии злокачественных новообразований в значительной степени утратило свое монопольное значение. Наряду с хирургическим вмешательством применяют лучевую терапию, в основе которой лежат различия в радиочувствительности опухолевой и рядом расположенных тканей. Используют гамма-и рентгеновское излучение, реже корпускулярное (протоны, нейтроны, электроны). При дистанционной лучевой терапии источник излучения находится вне тела больного; при внутриполостной — в полости. Например, при облучении опухолей матки при контактной лучевой терапии источником излучения являются радиоактивные капсулы, вводимые непосредственно в ткань опухоли. Радикальная лучевая терапия в качестве самостоятельного метода лечения применяется при ранних стадиях лимфогранулематоза, некоторых лимфом, некоторых злокачественных опухолях головы и шеи, при начальных стадиях рака предстательной железы, опухолях женских половых органов, некоторых опухолях ЦНС и кожи, у функционально неоперабельных больных раком легких. Лучевая терапия может носить и паллиативный характер, например, для снижения интенсивности болей при костных метастазах, для профилактики патологических переломов, при некоторых кровотечениях, упорных висцеральных болях, развитии обструкции полых органов. Кроме того, лучевая терапия используется как метод неотложной помощи при осложнениях онкологических заболеваний — сдавлении спинного мозга метастазами, обструкции дыхательных путей, синдроме верхней полой вены.
Химиотерапия является основным методом лечения химиочувствитель-ных и диссеминированных опухолей. Для значительного числа опухолей разработаны схемы радикальной химиотерапии, для других злокачественных новообразований она применяется в качестве паллиативной меры. Важную роль химиотерапия играет в составе комбинированного лечения. Химиотерапию проводят в виде нескольких циклов, как правило, 4—6. Практически в каждом случае еще до проведения всех циклов необходимо прогнозировать эффективность лечения согласно стандартным показателям. Необходимой минимальной продолжительностью для оценки противоопухолевого лечебного эффекта (табл. 20.3) считают 4 нед.
Разработаны отдельные критерии эффективности при лечении метастазов в кости:
• полная регрессия — полное исчезновение всех поражений на рентге
нограммах или сканнограммах;
Таблица 20.3. Критерии оценки химиотерапии
| Исход лечения | Состояние опухоли |
| Полная регрессия Частичная регрессия Стабилизация Прогрессирование | Исчезновение всех поражений Большее или равное 50 % уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов Уменьшение менее чем на 50 % при отсутствии новых поражений или увеличение не более чем на 25 % Большее или равное 25 % увеличение размеров одной или более опухолей или появление новых поражений |
• частичный эффект — частичное уменьшение остеолитических метастазов, их рекальцификация или уменьшение плотности остеобластных поражений;
• стабилизация — отсутствие изменений в течение 8 нед от начала лечения;
• прогрессирование — увеличение существующих или появление новых поражений.
При оценке объективного эффекта учитывают также динамику биохимических и других лабораторных показателей, в том числе онкомаркеров.
При лечении гормонозависимых опухолей (рак предстательной железы, молочной железы, эндометрия и др.) широко используют гормональные препараты — глюкокортикоиды, блокаторы рецепторов андрогенов, эстрогены, антиэстрогены, прогестагены, ингибиторы ароматазы, аналог сомато-статина.
В последние годы изучают клиническую эффективность иммунотерапии, использования цитокинов, адаптивной терапии, противоопухолевых вакцин и других соединений.
Важную роль в лечении онкологических больных играет поддерживающая терапия, ранее определяемая как симптоматическое лечение, мероприятия паллиативной помощи и др. Важность такого лечения определяется тем, что это единственная возможность обеспечить нормальную жизнь больному, улучшить качество его жизни, особенно при невозможности выздоровления или достижения стойкой ремиссии. Наиболее часто поддерживающая терапия решает проблемы устранения боли, ослабления тошноты и рвоты, лечения серозитов, коррекции белково-энергетического дефицита, гиперкальциемии.
Лечение хронической боли осуществляют проведением специальной лекарственной терапии, пролонгированным введением обезболивающих средств (внутривенно, эпидурально), различными способами блокады нервов, электростимуляционной анальгезией.
Согласно рекомендациям комитета экспертов ВОЗ от 1986 г., медикаментозная терапия боли осуществляется ступенчато в зависимости от интенсивности болей.
• При слабой боли (1—4 балла по шкале ВОЗ) назначают парацетамол, аспирин, нестероидные противовоспалительные средства (НПВС).
• При умеренной боли (4—7 баллов по шкале ВОЗ) — НПВС, ненаркотические анальгетики, комбинированные препараты, препараты, содержащие кодеин.
• При сильной боли (7—10 баллов по шкале ВОЗ) назначают наркотические анальгетики.
Некоторые анальгетики, в том числе и наркотические, выпускают в виде таблеток длительного действия, пластырей, что значительно облегчает их использование. Добиваясь необходимого результата, с первых дней лечения необходимо соблюдать три принципа: дозу анальгетика подбирать индивидуально в зависимости от интенсивности и характера боли, добиваясь ее устранения или значительного облегчения; назначать анальгетики «по часам», вводя очередную дозу препарата до прекращения действия предыдущей; анальгетики применять «по восходящей».
В особых случаях при безуспешной консервативной терапии показаны инвазивные методы лечения хронической боли. Для пролонгированного введения лекарственных средств используют имплантируемые системы, позволяющие в течение продолжительного времени вводить лекарственные препараты парентеральным методом, т. е. в венозное и артериальное русло, брюшную полость, в эпидуральное пространство, а также производить забор крови для анализов.
Среди других инвазивных методов лечения хронической боли выделяют блокады нервов, которые производят с помощью лучевой или хирургической денервации, инъекции нейролитиков (этиловый спирт, фенол, глицерин), криоаналгезии (замораживание периферических нервов), радиочастотной деструкции. Лучевая денервация — наиболее распространенный способ паллиативного воздействия при болях, обусловленных метастатическим поражением костей скелета, реже при висцеральных болях, обусловленных раком поджелудочной железы. Инъекции нейролитиков используют в лечении боли, вызванной, например, компрессией межреберных нервов; в лечении больных раком поджелудочной железы применяют блокады чревного сплетения. Хирургическую денервацию, криоаналгезию используют практически в тех же ситуациях, но заметно реже, так как они требуют дополнительного оборудования и специально подготовленного персонала.
В последнее время отрабатывают способы радиочастотной деструкции периферических нервов. Способ основан на эффекте выделения тепловой энергии при прохождении через биологические ткани токов ультравысокой частоты.
Электростимуляционная анальгезия — разновидность рефлексотерапии, при которой воздействие на точки акупунктуры осуществляется электрическим током. Метод имеет довольно ограниченные показания в лечении хронических умеренных и сильных болей, но эффективен при слабых или умеренных болях. К электростимуляционному воздействию быстро развивается резистентность, и по мере увеличения длительности лечения эффективность метода прогрессивно падает через 2—3 нед.
Лечение тошноты и рвоты, вызванных использованием противоопухолевых средств, в настоящее время хорошо разработано и широко используется в клинической практике (антиэметики в виде монотерапии или в сочетании с гормональными препаратами, седативные средства).
В ряде случаев онкологические заболевания сопровождаются развитием опухолевого плеврита, перикардита, асцита, которые требуют выполнения пункций или дренирования.
Одной из актуальных направлений поддерживающей терапии является коррекция белково-энергетического дефицита (дополнительное, зондовое, парентеральное питание и их сочетание), гиперкальциемии (использование бифосфонатов).
Прогноз у больных злокачественным новообразованием определяется характером и распространенностью заболевания, общим состоянием пациента, правильностью выбора программы лечения, точностью ее осуществления.
Таблица 20.4. Критерии оценки общесоматического статуса пациентов
| Шкала Карновского | Шкала ВОЗ | ||
| 100% | Нормальная (обычная) деятель- | Полностью активен, | |
| ность, без жалоб, отсутствие при- | способен выполнять ра- | ||
| знаков заболевания | боту, которую осуществ- | ||
| 90% | Способен к нормальной деятель- | лял до болезни, без ог- | |
| ности, незначительные симптомы или признаки заболевания | раничений | ||
| 80 % | Нормальная деятельность с усили- | Испытывает трудности | |
| ем, некоторые симптомы или при- | при выполнении физи- | ||
| знаки заболевания | ческой или напряжен- | ||
| 70% | Сам заботится о себе, не способен | ной работы. Способен | |
| к нормальной деятельности или | зыполнять легкую или | ||
| активной работе | сидячую работу | ||
| 60% | Нуждается порой в помощи, но | Обслуживает себя пол- | |
| способен сам удовлетворить | ностью, но не способен | ||
| большую часть своих потребностей | выполнять работу | ||
| 50 % | Нуждается в значительной помощи, частом медицинском обслуживании | ||
| 40 % | Инвалид, нуждается в специаль- | Обслуживает себя с ог- | |
| ной помощи, в том числе меди- | раничениями. Более | ||
| цинской | 50 % времени проводит | ||
| 30 % | Тяжелая инвалидность, госпитализация показана, хотя скорая смерть не предстоит | лежа | |
| 20 % | Госпитализация необходима, серь- | Полная инвалидность. | |
| езно болен, нуждается в активном | Не способен обслужи- | ||
| поддерживающем лечении | вать себя, прикован к | ||
| 10% | Умирающий, быстрое прогресси-рование патологических процессов | постели |
Большое значение имеют и функциональные резервы, которые определяют, насколько успешно организм будет выдерживать нагрузки, связанные с самим злокачественным новообразованием и его лечением. Непосредственно измерить этот показатель невозможно, поэтому его оценивают по косвенным показателям — возрасту пациента, по шкале ВОЗ или Карновского (табл. 20.4).
Прогностически неблагоприятны пожилой возраст и оценка по шкале ВОЗ ниже 2 (70 % по шкале Карновского).
Важным фактором прогноза онкологического заболевания является правильность выбора программы лечения и тщательность ее реализации. Такие (наиболее эффективные) методы лечения стандартизируются и становятся обязательными к реализации в каждом конкретном случае заболевания. Стандартные методы лечения выработаны практически к каждой нозологической форме злокачественных новообразований. При невозможности реализации стандартного метода лечения больной должен быть информирован о том, что предстоящий способ лечения таковым не является, и дать согласие на его реализацию. Развитие нежелательных последствий лечения следует вовремя купировать, при минимальной или незначительной их выраженности это не должно являться основанием для прекращения лечения.
Профилактика развития злокачественных опухолей — актуальное направление современной медицины. С позиций профилактики важно знать, что злокачественная трансформация является следствием целого ряда событий в клетке, некоторая часть которых может быть идентифицирована. Выделяют первичную и вторичную профилактику злокачественных опухолей. Задача первой — предупреждение развития опухоли путем воздействия на эндогенные и экзогенные факторы ее развития (борьба с курением, нормализация питания, медикаментозная профилактика). Задача второй — своевременное выявление заболевания в ходе массовых обследований, целью которых является раннее выявление заболевания. Эффективность массового обследования считается доказанной, если в группе, проходившей обследование, достоверно снижается показатель смертности. Неубедительными считаются исследования, в которых в результате профилактического обследования уменьшилась частота неизлечимых случаев болезни (т. е. увеличилась диагностика ранних стадий) или повысилась средняя продолжительность жизни. Такие данные тоже важны, но для доказательства пользы массового обследования их недостаточно.
Главным фактором риска развития злокачественного новообразования является возраст: 2/3 больных злокачественными опухолями перешагнули рубеж 65 лет.
Среди массовых обследований высокоэффективен маммографический скрининг рака молочной железы в возрастной группе 50—69 лет, который позволяет снизить смертность от рака молочной железы на 21—23 %. Получены очевидные доказательства эффективности скрининга рака шейки матки выполнением мазков-отпечатков шейки матки у молодых женщин. Кроме того, доказана эффективность исследования кала на скрытую кровь и выполнения ректороманоскопии или сигмоскопии в снижении смертности от рака толстой кишки. Наиболее актуальны прицельные обследования в группах повышенного риска развития злокачественных опухолей. Вместе с тем не существует методов скрининга рака легкого, рака предстательной железы.
В табл. 20.5 приведены рекомендации по массовому обследованию граждан, не относящихся к группам риска (рекомендации не имеют правового статуса и играют в большей степени информационную роль).
Таблица 20.5. Рекомендации по проведению массовых обследований
| Метод | Рекомендации по массовому обследованию | |
| Американская специальная комиссия по профилактике | Американское общество по борьбе с раком | |
| Ректороманоскопия Анализ кала на скрытую кровь Пальцевое ректальное исследование Определение содержания PSA Цитологическое исследование мазка с шейки матки | До 50 лет не рекомендуется После 50 лет — периодически После 50 лет — ежегодно Рекомендаций нет Нецелесообразно 18—65 лет, каждые 1— 3 года | После 50 лет — каждые 3—5 лет После 50 лет — ежегодно После 40 лет — ежегодно После 50 лет — ежегодно После 18 лет ежегодно в течение 3 лет, затем по усмотрению врача |
Продолжение
| Метод | Рекомендации по массовому обследованию | |
| Американская специальная комиссия по профилактике | Американское общество по борьбе с раком | |
| Гинекологическое обследование Аспирационная биопсия эндометрия Самообследование молочных желез Врачебный осмотр молочных желез Маммография Осмотр всех кожных покровов | Не рекомендуется (только при наличии жалоб) Не рекомендуется Рекомендаций нет После 50 лет — ежегодно 50—75 лет, каждые 1— 2 года Не рекомендуется | 18—40 лет, каждые 1—3 года. После 40 лет — ежегодно В менопаузе при ожирении и приеме эстрогенов После 20 лет — ежемесячно 20—40 лет каждые 3 года. После 40 лет — ежегодно 40—49 лет, каждые 1—2 года. После 50 лет — ежегодно 20—39 лет, каждые 3 года |
20.6. Принципы организации онкологической службы
Основными задачами в организации онкологической помощи населению являются: профилактика онкологических заболеваний; ранняя диагностика, включающая профилактические осмотры населения как один из методов раннего выявления опухолей; лечение онкологических больных (в том числе и симптоматическое лечение больных с запущенными злокачественными новообразованиями); наблюдение за онкологическими больными.
Настоящий этап их развития онкологической службы характеризуется дальнейшим совершенствованием материально-технической базы и техническим переоснащением: развитием диагностической базы (аппараты УЗИ, КТ, МРТ), переоборудованием парка лучевых аппаратов, прежде всего за счет развертывания ускорителей и аппаратов для брахиотерапии, увеличением коечного фонда.
Г л а в а 21. ОСНОВЫПЛАСТИЧЕСКОЙ ХИРУРГИИ И ТРАНСПЛАНТОЛОГИИ
Современное толкование термина «пластика» обобщает название хирургических методов восстановления формы и(или) функции отдельных частей тела (органов или анатомических структур) путем перемещения, трансплантации или имплантации замещающих их материалов. В данном случае имеются в виду биологические ткани, так как использование небиологических материалов принято обозначать термином «эндопротезирование».
Имплантация — операция, направленная на внедрение в организм небиологических аппаратов или конструкций с целью восстановления функции органов или замещения тканей организма. Имплантаты могут быть временными (металлоконструкции, винты, спицы для остеосинтеза кости), которые после выполнения функции удаляются из организма, либо постоянными (эндопротезы суставов или молочных желез).
Реконструкция — изменение взаимоотношений анатомических структур сегмента для восстановления его нормальной функции или формы, утраченных в результате травмы или заболевания. Именно поэтому сочетание этих терминов в понятии «пластическая и реконструктивная хирургия» широко используется в медицинской практике и литературе.
Восстановление, или восстановительная операция — понятие, идентичное реконструкции, но только в той части, когда в ходе операции необходимо восстановление какой-либо функции, например, движения.
В специальной литературе по пластической хирургии применяют термины «лоскут», «комплекс тканей», «трансплантат».
Лоскут — участок тканей, имеющий определенную площадь и состав тканей (кожа, подкожная клетчатка, мышцы, сухожилия, кость или их комбинации), отделенный от тела оперативным путем либо отделившийся вследствие ранения. Этот термин появился у истоков пластической хирургии, когда стали применять участки тканей вытянутой формы на ножке. В последние годы его синонимом стал термин «комплекс тканей», а оба термина стали применять более широко независимо от формы, состава и размеров пересаживаемых участков тканей. Лоскут и комплекс тканей в процессе операции могут быть полностью отделены от организма или сохранять с ним связь в виде ножки; в первом случае лоскут называется свободным в другом — несвободным.
Существенное отличие имеет термин «трансплантат» (от лат. transplanta-tio — пересадка), которым стали называть участок собственных либо взятых из другого организма тканей, полностью отделенных от донорского ложа с целью пластики. Соответственно лоскуты стали делить на свободные (трансплантаты) и несвободные (лоскуты, не потерявшие связь с донорским ложем). В свою очередь лоскуты (трансплантаты) подразделяют на васкуляри-зированные и неваскуляризированные. В связи с наличием барьера тканевой несовместимости васкуляризированные трансплантации возможны лишь для аутотрансплантатов. Неваскуляризированные аллотрансплантаты (сухожильные, костные и сосудистые трансплантаты) широко применяются в хирургии.
Хирургическая операция, предусматривающая использование лоскутов с пластической целью, называется пересадкой. Пересадку свободных лоскутов обозначают термином «трансплантация», основой которой является полноценное восстановление васкуляризации органа или ткани путем наложения сосудистых артериальных и венозных анатомозов. Пересадку несвободных
комплексов тканей обозначают термином транспозиция (перемещение), во время которой питающие сосуды не пересекаются.
В связи с тем, что биологическая характеристика имеет первостепенное значение, общепринято деление всех свободно пересаживаемых тканей на ауто-, алло- и ксенотрансплантаты (соответственно взятые из организма пациента, умершего человека или животного).
Аутопластика — материал для восстановления получают у самого оперируемого больного, как правило, вдали от области основного вмешательства. Этот вид свободной пластики распространен широко, поскольку пластический материал способен к истинному приживлению в результате восстановления сосудистых связей. Недостатком метода является необходимость дополнительной операции для получения трансплантата, а в ряде случаев количественная ограниченность пластического материала. Частным видом аутопластики является реимплантация отторгнутых кожных лоскутов или кожных покровов отделенных частей тела.
Аллопластика — пересаживаемая ткань имеет биологическое происхождение (от трупа), обработана специальными методами (лиофилизация, замораживание и др.).
Гомопластика — пластический материал берут от другого человека (донора). Положительной чертой этого вида пластики является возможность получения материала без нанесения дополнительной травмы больному.
Гетеропластика — пересадка тканей от животного к человеку. Применяется крайне редко, так как имплантация чужеродного белка приводит к более глубокой несовместимости, чем при гомопластике.
В настоящее время выделяют следующие основные направления рекон-структивно-восстановительной хирургии: пластическая хирургия покровных и подлежащих тканей; реконструктивно-восстановительная хирургия органов и частей тела; эндопротезирование.
В зависимости от вида пересаживаемой ткани выделяют кожную, мышечную, сухожильную, нервную, костную, хрящевую и сосудистую пластики. При необходимости различные виды пересаживаемых тканей могут сочетаться (кожно-фасциальная, кожно-фасциально-мышечная, костно-мы-шечная, костно-сухожильная пластика). Все виды кожной пластики разделяют на два принципиальных варианта: свободную и несвободную.
А Свободная кожная пластика подразделяется на свободную васкуляри-зированную и неваскуляризированную.
• Свободная васкуляризированная кожная пластика связана с применением микрохирургического инструментария и шовного материала, операционного хирургического микроскопа. Замещение дефектов кожного покрова выполняется пересадкой сложных лоскутов, в которых сохраняется своя сосудистая сеть, которая во время операции анастомозируется с сосудами пораженной конечности.
• Свободная неваскуляризированная кожная пластика исторически началась с применения мелких эпидермальных кусочков, что в настоящее время применяется редко. В дальнейшем с изобретением дерматома оказалась возможной пересадка больших по площади лоскутов. Эти лоскуты могут быть на всю глубину дермы (полнослойный лоскут), либо содержать только поверхностные слои эпидермиса (расщепленный лоскут).
А Несвободную кожную пластику разделяют на два вида: закрытие раны путем использования прилежащей кожи с дополнительными разрезами или без них; закрытие раны при помощи перемещения кожного лоскута на ножке, взятого поблизости от раны или с отдаленных участков тела. Последние могут быть островковые, плоские и трубчатые.
21.1. Свободная пересадка кожи
Кожные трансплантаты классифицируют в основном по толщине: 0,25— 0,7 мм средней толщины — расщепленные; 0,8—1,1 мм — полнослойные.
Принципиальная разница пересадки полнослойного и расщепленного лоскутов заключается в технике взятия трансплантата, который выполняют специальным инструментом — дерматомом (рис. 21.1).
Местная кожная пластика используется при ограниченных дефектах кожного покрова, когда в окружности раны имеются запасы кожи, пригодные для перемещения или скольжения. Наиболее простым вариантом местной кожной пластики является закрытие раны путем сшивания мобилизованных краев ее без каких-либо дополнительных разрезов.
Другим вариантом местной кожной пластики является перемещение лоскута по принципу встречных треугольников. При этом происходит перемещение тканей, дающее увеличение их по направлению основного разреза и соответственное уменьшение по направлению, перпендикулярному основному разрезу.
Вариант местной кожной пластики, заключающийся в боковом смещении или ротации (транспозиция) заключается в выкраивании около дефекта кожи различных по форме кожно-жировых лоскутов с последующим их перемещением в область изъяна кожи с замещением донорского места местными тканями или расщепленным трансплантатом.
Местная кожная Z-пластика заключается в следующем. Если из конечных точек прямого разреза под одинаковым углом провести по одному разрезу одинаковой длины, а затем после обмена полученных треугольных лоскутов вшивать их, то направление первоначальной прямой изменится и длина ее увеличится.
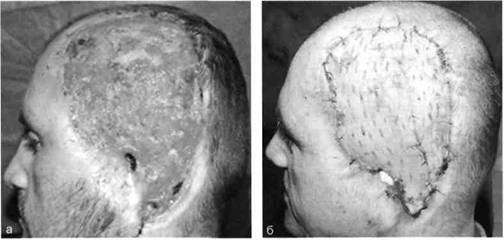
|
| Рис. 21.1. Свободная кожная дерматомная пластика. а — гранулирующая рана после электроожога; б — пластика расщепленным трансплантатом. |
Пластика кожным лоскутом на ножке из отдаленных частей тела, или так называемый итальянский метод, в настоящее время применяется главным образом при операциях на конечностях. Обязательным условием при выкраивании лоскутов является сохранение хорошего питания лоскута на всем его
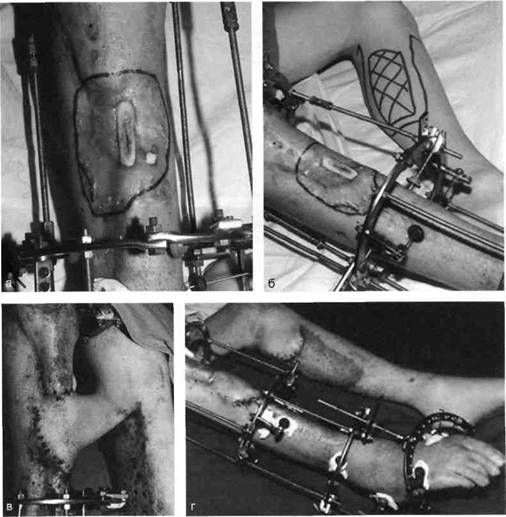
Рис. 21.2. Пластика кожным лоскутом на ножке раны голени после огнестрельного пулевого сквозного ранения.
а — гранулирующая рана голени; б — выкраивание внутреннего кожно-мышечного лоскута противоположной голени; в — перемещение лоскута на рану; г — завершение операции.
протяжении. Для этого нужно включать в состав лоскута жировую клетчатку, а иногда фасцию и мышцу, чтобы использовать их сосуды (рис. 21.2).