 Рис.2.2. Диаграмма высокотемпературного окисления кремния
Рис.2.2. Диаграмма высокотемпературного окисления кремния
Первые попытки описания термического окисления кремния основывались на известных моделях роста окисла на металлах, в которых предполагалось, что при высоких температурах процесс окисления является следствием диффузии заряженных частиц - ионов и электронов -через растушую пленку. При этом скорость химической реакции считалась много большей скорости диффузионного процесса.
Основной моделью роста окисла является модель Дила-Гроува (Д-Г), рассматривающая процесс окисления состоящим из двух этапов - массопереноса окислителя в растущем окисле и протекания химической реакции кремния с окислителем. Модель предполагает три потока (рис.2.2):
1) массоперенос окислителя через внешнюю границу растущего окислаSiO2 из газовой фазы (потокF1):
F = h(C * - C0),
гдеh - коэффициент переноса окисляющих частиц через внешнюю границу окисла;C* и C0 - концентрации окисляющих частиц вне окисла и вблизи
поверхности внутри окисла в любой момент времени окисленияt (C0 принимается обычно равной предельной растворимости окислителя вSiO2);
2)
 |
диффузию окисляющих частиц через окисел к границе разделаSiO2 -Si (потокF2):
 |
гдеD - коэффициент диффузии окисляющих частиц;Ci - концентрация окислителя на границеSiO2 -Si;
3) химическую реакцию взаимодействия окислителя с кремнием (потокF3):1
F3 = kC i
где к - скорость реакции.
В условиях установившегося равновесия (поток F F = F1 = F2 = F3) решается дифференциальное уравнение для скорости окисления:
гдеN - число частиц окислителя, необходимое для создания единицы объема окисла.
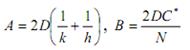 |
Если ввести обозначения то уравнение (2.1) примет вид:
dx/dt=B/(A+2x).(2.2)
Кремний легко окисляется при комнатной температуре, так что его поверхность всегда покрыта слоем окисла толщиной от 2 до 8 нм. Кроме того, термическое окисление может проводиться многократно. Для исследуемого процесса следует иметь в виду, что приt = 0 на поверхности кремния уже мог быть слой окисла толщиной х0. Поэтому интегрирование уравнения (2.2) ведется в пределах х0 - х, и решение его имеет вид:
x2 + Ax = B(t +10), где t0 - время, (2.3)
где t0 - время, соответствующее начальной толщине окисла х0.

Рис.2.3. Зависимость толщины окисла кремния от времени
окисления при высокой температуре
Зависимость толщины окисла от времени окисления при высокой (от 700 до 1200 °С) температуре изображена на рис.2.3. При малых временах окисления t<<A2/4B рост окисла описывается линейным законом 
при больших временах окисления t >> A2 /4B - параболическим
x2 = Bt ≡ kpt, (2.5)
где kl и kp - константы линейного и параболического роста соответственно. Имеется некоторое характерное время tар, при превышении которого
линейный закон роста окисла переходит в параболический (см. рис.2.3). Уравнение (2.3) можно записать также в виде
x2/ B + (A / B) x = t (2.6)
(если t0 << t, то t0 можно не учитывать).
Поделив все части уравнения (2.6) на х и проведя небольшие преобразования, получим:
x = B(t / x - A/B). (2.7)
Уравнение (2.7) есть уравнение прямой в координатах [х, t/x], которая отсекает на оси абсцисс отрезок, численно равный обратной величине линейной константы A / B = kl, и имеет угол наклона, тангенс которого равен
параболической константе роста окисла B = kp.
Модель Дила-Гроува описывает достаточно точно экспериментальные результаты в широком диапазоне температур и толщин окисла,, за исключением начального участка роста окисного слоя (особенно в сухом кислороде) толщиной примерно до 30 нм.
Окисление под давлением

Влияние парциального давления окислителя
Константа kp в модели Д-Г линейно зависит от парциального давления окислителя, вследствие чего может быть использован закон Генри:
C = HPs,
где С - концентрация окислителя; Н - постоянная Генри; PS - парциальное давление окислителя. Экспериментально показано, что в диапазоне температур 850 - 1000 °С при давлениях порядка 104 - 106 Па закон Генри соблюдается. Это свидетельствует о том, что диссоциация молекул окислителя на границе газ - SiO2 отсутствует, следовательно, через окисел идет диффузия и сухого кислорода, и воды в молекулярной форме.
Для линейной константы зависимость от давления окислителя оказалась также линейной, только в узком диапазоне высоких температур (1000 - 1200 °С) и давлений (0,1 - 1,0)-105 Па окислителя. Более точная зависимость может быть описана соотношением k ~ Pn. Для окисления в сухом O2, по данным различных экспериментов, показатель n меняется от 0,59 до 0,70 при температурах до 900 °С и от 0,8 до 1,0 при более высоких температурах. Кроме того, n зависит от ориентации подложки, что может быть связано с промежуточным этапом реакции O2 с Si, хемосорбцией кислорода, а также участием в реакции, помимо молекулярного, и атомарного кислорода.
При окислении в парах воды или влажном кислороде (H 2O + O2) во всем диапазоне температур и давлений порядка 105 Па n = 1/2.