1. Математическое выражение закона Дебая-Гюккеля имеет вид:
1)  2)
2) 

4) 
 2. В реакции Сг3+ + 4OH- [Сг (OH)4]+ с позиции теории Льюиса он Сг3+ является:
2. В реакции Сг3+ + 4OH- [Сг (OH)4]+ с позиции теории Льюиса он Сг3+ является:
1) анионом; 2) кислотой; 3) основанием; 4) окислителем
 3. В реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории Бренстеда является
3. В реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории Бренстеда является
1) кислотой; 2) анионом; 3) акцептором электронной пары; 4) основанием
4. При переходе к растворителю с большей диэлектрической проницаемостью степень диссоциации электролита:
1) уменьшается;
2) не изменяется;
3) может как уменьшаться, так и увеличиваться;
4) увеличивается
5. Среди представленных щелочей самым слабым основанием является:
1) КOH; 2) LiOH; 3) NH3∙H2O; 4) Ba(OH)2
 6. В реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда- Лоури является:
6. В реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда- Лоури является:
1) амфолитом 2) сольватирующим агентом; 3) основанием; 4) кислотой;
 7. В реакции
7. В реакции
молекула белка с позиций теории Льюиса является:
1) акцептором электронной пары; 2) основанием; 3) кислотой; 4) амфолитом
8. При увеличении ионной силы раствора коэффициенты активности ионов:
1) возрастают для анионов, снижаются для катионов;
2) снижаются для анионов, возрастают для катионов;
3) не изменяются; 4) снижаются независимо от заряда иона
 9. В реакции HSO3- + OH- SO32- + H2O с позиций теории Бренстеда- Лоури молекула Н2О по отношению к иону ОН- является:
9. В реакции HSO3- + OH- SO32- + H2O с позиций теории Бренстеда- Лоури молекула Н2О по отношению к иону ОН- является:
1) кислотой; 2) основанием; 3) сопряженной кислотой; 4) сопряженным основанием
10. «Коэффициент активности» - это:
1) отношение числа активных соударений ионов к общему числу ионов в растворе;
2) отношение скоростей движения ионов в растворе в зависимости от их заряда;
3) отклонение поведения ионов в растворе от их поведения в растворе при бесконечном разбавлении;
4) отклонение скоростей диффузии ионов от «идеальной» скорости при отсутствии межионных взаимодействий
11. «Активность иона» - это:
1) максимальная скорость движения иона в электрическом поле;
2) отношение скорости движения иона в растворе к скорости в вакууме; 3) концентрация иона, в соответствии с которой он участвует в ионных взаимодействиях;
4) эффективная концентрация иона, в соответствии с которой он участвует в различных процессах
12. Понятию «ионная сила» соответствует определение:
1) сумма произведений концентраций ионов на их заряд; 2) полусумма произведений концентраций ионов на их заряд; 3) полусумма произведений квадрата концентраций ионов на их заряд; 4) полусумма произведений концентраций ионов на квадрат их заряда
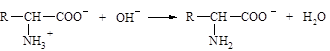 13. В реакции
13. В реакции
молекула белка с позиций теории Бренстеда является:
1) акцептором электронной пары; 2) донором электронной пары;
3) основанием; 4) кислотой
14. Сила кислот HCN ( = 9,14), CH3COOH (
= 9,14), CH3COOH ( = 1,8∙10-5), H2CO3 (
= 1,8∙10-5), H2CO3 ( = 6,2) убывает в ряду:
= 6,2) убывает в ряду:
1) CH3COOH > H2CO3 > HCN; 2) HCN > CH3COOH > H2CO3;
3) CH3COOH > H2CO3 > HCN; 4) CH3COOH > H2CO3 > HCN
15. Кислотой Льюиса является частица:
1) образующая при диссоциации ион H+ ;
2) имеющая неспаренный электрон;
3) способная принимать электронную пару;
4) обладающая повышенной электронной плотностью
16. Основанием Льюиса является частица:
1) образующая при диссоциации ион OH-;
2) обладающая свободной электронной орбиталью для образования ковалентной связи;
3) способная отдавать электронную пару для образования ковалентной связи;
4) обладающая повышенной подвижностью в водных растворах
17. Основанием Бренстеда является частица:
1) обладающая пониженной подвижностью в растворах;
2) способная присоединять протон;
3) имеющая свободную орбиталь;
4) образующая при диссоциации ион OH-
18. Математическая форма закона разведения Оствальда имеет вид:
1)  2)
2)  3)
3)  4)
4) 
19. Понятию «константа диссоциации» соответствует определение:
1) отношение числа распавшихся молекул к общему числу молекул в растворе; 2) отношение числа продиссоциировавших молекул к числу молекул, не подвергшихся диссоциации;
3) отношение концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части молекул;
4) стехиометрическое отношение произведения концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части электролита