Для проведения ДНК-диагностики наследственных и приобретенных заболеваний необходимо подготовить нуклеиновые кислоты, содержащиеся в клинических образцах, и проанализировать их адекватными методами. При этом целью анализа является обнаружение в геноме больного известных или новых мутаций, ассоциированных с развитием мутантного фенотипа в виде симптомов конкретного заболевания.
Получение клинического генетического материала
Для проведения ПЦР используют ДНК клеток различных органов и тканей человека. Основными требованиями, предъявляемыми к такой ДНК, является отсутствие сильной ее деградации и повреждений химическими агентами. Источниками клеток для выделения ДНК служат слюна и другие биологические жидкости пациентов, свежая или высушенная кровь, биоптаты различных тканей, в том числе и корни волос, а также консервированные ткани.
Слюну пациентов (до 5 мл) обычно собирают в пластиковые пробирки. Допускается сбор слюны на фильтровальную бумагу с последующим ее высушиванием с целью облегчения транспортировки. Поскольку источником ДНК в слюне являются соматические клетки слизистых, а также присутствующие в ротовой полости микроорганизмы, необходимо предпринимать усилия для их механического освобождения с внутренней поверхности щек, например движениями языка или используя специальные щеточки. В лаборатории белки слюны расщепляют протеиназой К, а освободившуюся ДНК дополнительно депротеинизируют фенолом и концентрируют осаждением спиртом.
Корни волос содержат несколько сотен соматических клеток, а следовательно, и адекватное число копий ДНК, достаточное для проведения ПЦР. При использовании ДНК из этого источника из-за малого ее содержания необходимо применять особые меры предосторожности против ее загрязнения посторонними ДНК. Преимуществом корней волос перед другими источниками ДНК является почти полное отсутствие внеклеточного матрикса, затрудняющего выделение ДНК из соматических клеток. Это позволяет исключать стадию фенольной обработки образцов для получения ДНК, пригодной для проведения ПЦР. Клетки корней волос лизируют буфером, содержащим неионные детергенты, белки гидролизуют протеиназой К, которую далее инактивируют прогреванием при 100о. При этом одновременно происходит денатурация ДНК, что необходимо для проявления ее матричных свойств при проведении ПЦР.
Срезы для микроскопии и парафинированные ткани используют для проведения семейного генетического анализа, когда другие возможные источники ДНК недоступны из-за смерти пациента или по другим причинам. Для фиксации тканей при проведении патологоанатомических исследований часто используют формальдегид или глутаровый альдегид, которые модифицируют основания ДНК. Поэтому при использовании ДНК из срезов фиксированных тканей возможна амплификация лишь коротких ее сегментов длиной в несколько сотен пар оснований.
Ткани, освобожденные от парафина ксилолом или октаном или же соскобленные с препаратов для микроскопии, суспендируют в лизирующем буфере с протеиназой К и инкубируют в течение 12–24 ч при 56–65о для протеолитического расщепления белков. Дальнейшую депротеинизацию образцов и осаждение ДНК осуществляют так же, как и в предыдущем случае.
Диагностика заболеваний
В процессе диагностики и исследования генетических механизмов наследственных заболеваний человека возникают две тесно связанные друг с другом задачи. На первом этапе исследований в ДНК из клинических образцов пытаются обнаружить уже описанные в литературе мутации, ассоциированные с конкретным наследственным заболеванием. На наличие такой мутации в геномной ДНК пациента указывает диагноз наследственного заболевания, поставленный на основании симптомов болезни. В то же время необнаружение известных мутаций в его геномной ДНК не может считаться доказательством отсутствия у него соответствующего заболевания, поскольку оно может вызываться новыми мутациями в том же самом или других генах, функционально связанных с первым. Поэтому в таких случаях на втором этапе исследования этиологии заболевания следует воспользоваться методами, позволяющими обнаруживать неизвестные мутации.
Методы обнаружения новых неизвестных мутаций. Если раньше точковые мутации, а также микроделеции и вставки обнаруживали преимущественно прямым секвенированием клонированных фрагментов ДНК, то в последнее время преобладающими становятся методы анализа продуктов ПЦР. При этом наиболее часто используются четыре ниже приведенных метода.
Прямое секвенирование продуктов ПЦР является очень эффективным и чувствительным методом выявления мутаций. Принято считать, что с помощью прямого секвенирования одноцепочечных и двухцепочечных продуктов ПЦР стандартными методами можно обнаруживать до 99% мутаций при минимальном количестве ложноположительных и ложноотрицательных результатов. Метод позволяет не только точно локализовать мутацию в исследуемой последовательности нуклеотидов, но и определить ее тип и возможный механизм возникновения с учетом контекста окружающих ее нуклеотидов.
Электрофорез продуктов ПЦР в денатурирующем градиентном геле (denaturing gradient gel electrophoresis – DGGE). Последовательность нуклеотидов в двухцепочечных фрагментах ДНК определяет особенности плавления этих фрагментов в денатурирующих условиях. Отсюда следует, что мутации (в том числе и одиночные замены нуклеотидов) могут изменять температуру плавления (денатурации) локальных участков ДНК, называемых доменами, которые содержат эти мутации. Совокупность доменов плавления определенного участка ДНК образует профиль плавления. Домены ДНК в зависимости от последовательности их нуклеотидов в условиях постоянной температуры будут плавиться при определенных концентрациях денатурирующего агента. В результате положение фрагментов в геле по завершении электрофореза будет зависеть от профилей их плавления и, в конечном счете, от нуклеотидной последовательности доменов плавления. Наличие мутации увеличивает или понижает температуру плавления соответствующего домена. Следовательно, фрагмент ДНК, содержащий мутацию, плавится при более низкой (или более высокой) концентрации денатурирующего агента в геле и двигается медленнее (или быстрее) при электрофорезе по сравнению с аналогичным фрагментом ДНК дикого типа.
Присутствие ошибочно спаренных нуклеотидов (mismatches), как правило, увеличивает разницу в температурах плавления мутантных фрагментов ДНК и фрагментов ДНК дикого типа. С учетом этого факта можно увеличить чувствительность обсуждаемого метода путем сравнения электрофоретических подвижностей фрагментов ДНК дикого типа и гетеродуплексов, образованных фрагментом исследуемой ДНК и соответствующим фрагментом ДНК дикого типа. На практике получение гетеродуплексов продуктов ПЦР не занимает много времени. Для этого достаточно смешать анализируемые продукты в эквимолярных отношениях в определенных ионных условиях, денатурировать их повышением температуры и медленно охладить.
С появлением метода ПЦР получение фрагментов ДНК определенной длины, полностью идентичных анализируемому участку ДНК, стало простой задачей. Для повышения разрешающей способности электрофореза в денатурирующем градиентном геле один из праймеров при проведении ПЦР выбирают таким образом, чтобы его GC-состав был максимально возможным. Это предотвращает преждевременную полную денатурацию и расхождение цепей продуктов ПЦР во время электрофореза, так как противоположные цепи денатурирующих фрагментов ДНК будут более продолжительное время связаны друг с другом GC-богатыми последовательностями праймеров.
Полагают, что метод электрофоретического разделения фрагментов ДНК в гелях с градиентом денатурирующих агентов позволяет обнаруживать до 95% мутаций. Однако несмотря на высокую эффективность, этот метод не дает возможности точно локализовать мутации в анализируемых участках ДНК.
Методы, основанные на обнаружении ошибочно спаренных нуклеотидов. Азотистые основания ДНК содержат реакционноспособные кето- и аминогруппы, которые можно легко модифицировать химическими методами. Основания, находящиеся в составе канонической двойной спирали ДНК, в большей степени защищены водородными связями от действия модифицирующих агентов, чем ошибочно спаренные основания в гетеродуплексах. Поэтому последние можно избирательно модифицировать химически.
В настоящее время используют в основном два подхода к обнаружению мутаций с помощью химических модификаций ошибочно спаренных оснований в гетеродуплексах. В одном из них модификации подвергаются ошибочно спаренные остатки цитозина или тимидина с использованием соответственно гидроксиламина или четырехокиси осмия. После удаления из цепей анализируемых фрагментов ДНК неспаренных пиримидинов и расщепления депиримидинизированных остатков рибозы по фосфодиэфирным связям пиперидином образовавшиеся фрагменты ДНК исследуют с помощью электрофореза, что позволяет локализовать места расщепления цепей ДНК и соответственно положение мутантных нуклеотидов. Комбинированное использование этих методов дает возможность находить все теоретически возможные сочетания мутантных нуклеотидов.
При втором подходе используют водорастворимый карбодиимид для модификации ошибочно спаренных остатков G и Т. ДНК-полимераза прекращает элонгацию строящейся цепи ДНК вблизи модифицированного основания. В результате образуется укороченный гомогенный продукт реакции в виде вновь синтезированного фрагмента ДНК. Поэтому модифицированное основание (а следовательно, и мутация) может быть обнаружено посредством удлинения праймера Taq-полимеразой в присутствии радиоактивно меченных дезоксирибонуклеозидтрифосфатов с последующим электрофоретическим определением размеров меченого продукта реакции. Принято считать, что эффективность выявления мутаций с использованием химических модификаций ошибочно спаренных нуклеотидов приближается к 95%.
Обнаружение мутаций путем оценки конформационного полиморфизма одноцепочечных фрагментов ДНК (single-stranded conformation polymorphism – SSCP). Отдельные цепи денатурированных фрагментов ДНК обладают способностью образовывать вторичную структуру, особенности которой зависят от последовательности нуклеотидов в этих фрагментах. Конформация одноцепочечных фрагментов ДНК, образовавшаяся во время их рефолдинга (сворачивания после тепловой денатурации исходного двухцепочечного фрагмента и быстрого охлаждения, во время которого большинство фрагментов остается в одноцепочечной форме), оказывает влияние на электрофоретическую подвижность фрагментов. Наличие в анализируемом фрагменте ДНК, в том числе и в продукте ПЦР, одной или нескольких мутаций приводит к формированию специфической вторичной структуры у цепей анализируемого фрагмента ДНК, образовавшихся в процессе его денатурации с последующим рефолдингом, и эта структура будет отличаться от структуры фрагментов ДНК дикого типа, что легко обнаруживается по изменению электрофоретической подвижности фрагментов. Метод оценки конформационного полиморфизма одноцепочечных фрагментов ДНК прост в постановке и позволяет выявлять до 80% мутаций. Этот метод, однако, не дает возможности точно локализовать мутации.
Еще один недавно разработанный метод поиска мутаций был назван анализом гетеродуплексов. Установлено, что наличие в двухцепочечном фрагменте ДНК неспаренных оснований (даже одной пары) изменяет конформацию такого гетеродуплекса, и это проявляется в изменении электрофоретической подвижности фрагмента при проведении гель-электрофореза в определенных условиях. Несмотря на свою простоту, метод также позволяет находить до 80% мутаций.
Все методы, описанные в этом разделе, приобрели особую значимость с развитием метода ПЦР, который достаточно просто позволяет амплифицировать конкретные участки геномной ДНК, получать препаративные количества гомогенной по размерам двухцепочечной ДНК и быстро создавать гетеродуплексы. Несмотря на такое широкое распространение ПЦР, в заключение раздела о методах обнаружения неизвестных мутаций целесообразно упомянуть старый, но эффективный метод выявления мутаций, приводящих к полиморфизму длин рестрикционных фрагментов ДНК (ПДРФ) (restriction fragments length polymorphism – RFLP), непосредственно в геномной ДНК. Наличие сайтов рестрикции в геномной ДНК и их взаимное расположение однозначно определяются последовательностью нуклеотидов исследуемой ДНК, поскольку сам сайт рестрикции – не что иное, как строго определенная последовательность нуклеотидов ДНК, узнаваемая и расщепляемая рестриктазами. Следовательно, любая мутация, изменяющая последовательность нуклеотидов сайта рестрикции, уничтожает этот сайт.
Полное расщепление анализируемой геномной ДНК отдельными рестриктазами приводит к образованию определенного набора фрагментов ДНК, число и размеры которых соответствуют расположению сайтов рестрикции. Гибридизация по Саузерну позволяет определять размеры и взаимное расположение рестрикционных фрагментов ДНК после их электрофоретического разделения (подробности см. в разделе 7.5). При наличии мутации в одном из сайтов рестрикции этот сайт остается нерасщепленным после завершения рестрикции, что приводит к слиянию соседних рестрикционных фрагментов ДНК, разделяемых мутантным сайтом, и образованию фрагмента ДНК большего размера. В результате длина рестрикционных фрагментов ДНК, содержащих мутантные сайты, может меняться (становится полиморфной), что четко выявляется при сравнении ДНК из разных источников методом ПДРФ.
Метод ПДРФ широко используется в генетических исследованиях популяций, поскольку наличие в геноме исследуемого организма рестрикционного фрагмента ДНК определенной длины является прекрасным генетическим маркером и одновременно фенотипическим признаком, тесно связанным с генотипом организма. Это позволяет легко следить за распространением такого маркера в популяциях, за передачей его от родителей к потомству при скрещиваниях и использовать для построения генетических карт исследуемых организмов классические генетические методы. ПДРФ-маркеры благодаря их четкой принадлежности определенным генетическим локусам не уступают по информативности распространенным биохимическим маркерам и во многих случаях оказываются удобнее сложных фенотипических признаков (таких, как цвет глаз, окраска волос или шерсти, форма цветков и листьев), определяемых многими генными локусами.
Методы обнаружения известных мутаций. Все рассмотренные выше методы поиска новых мутаций с успехом используются и для идентификации известных мутаций в исследуемой ДНК. Тем не менее, для выявления уже описанных в литературе мутаций, приводящих к отдельным патологическим состояниям организма (например серповидно-клеточной анемии или нарушениям в системе свертывания крови), бывает удобнее использовать некоторые специфические методы, четыре из которых будут рассмотрены ниже.
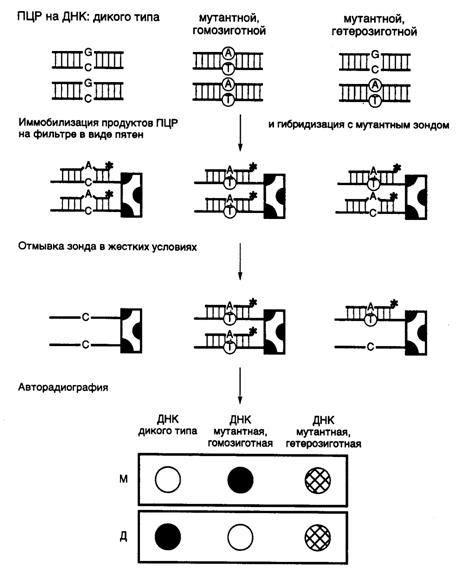
Рис. II.33. Схема обнаружения точковых мутаций гибридизацией с аллель-специфическими зондами
М и Д – зонды, соответствующие мутантному аллелю и аллелю дикого типа. Звездочкой отмечены радиоактивные метки
Аллель-специфическая гибридизация олигонуклеотидов (allele-specific oligonucleotide hybridization – ASO). Фрагменты ДНК, амплифицированные с помощью ПЦР с использованием в качестве матрицы ДНК обследуемых индивидуумов и ДНК дикого типа, денатурируют и иммобилизуют на нитроцеллюлозных или нейлоновых мембранах. Мембрану со специфически связанными с ней нуклеиновыми кислотами обычно называют блотом. В том случае, если ДНК наносят на мембрану в виде круглых пятен с помощью микропипетки, речь идет о дот-блотах. Одни из дот-блотов гибридизуют с олигонуклеотидом (обычно меченным 32Р или флуоресцентной меткой), первичная структура которого соответствует исследуемому аллелю дикого типа (дот-блот-гибридизация). Другой идентичный дот-блот гибридизуют с меченым олигонуклеотидом, соответствующим мутантному аллелю (рис. II.33). Температуры плавления образовавшихся гетеродуплексов и правильных гибридов различаются. Поскольку в гетеродуплексах имеется ошибочно спаренный нуклеотид, температура их плавления (денатурации) будет ниже, чем у соответствующих правильных гибридов. Подобрав температуру, при которой происходит плавление гетеродуплексов, но не правильных гибридов, можно путем промывки буфером соответствующей температуры избирательно убрать с дот-блотов меченые олигонуклеотиды гетеродуплексов, сохранив олигонуклеотиды правильных гибридов в связанном с ДНК дот-блотов состоянии.
После авторадиографии дот-блот-гибридов, промытых буфером соответствующей температуры, получается следующая картина. В случае гибридизации ДНК дот-блотов с олигонуклеотидным зондом, соответствующим последовательности нуклеотидов нормального аллеля, гибрид сохраняется, если в доте присутствует ДНК дикого типа здорового индивидуума. Гибрид разрушается, если в доте присутствует ДНК индивидуума с мутантным геном в гомозиготном состоянии (оба аллеля исследуемого гена, полученные от каждого из родителей, мутантны). В этом случае в результате гибридизации зонда с ДНК обоих аллелей образуются гетеродуплексы, содержащие ошибочно спаренный нуклеотид и обладающие пониженной температурой плавления. В том случае, если обследуемый индивидуум гетерозиготен по исследуемому гену и его ДНК заключает в себе как мутантный аллель, так и аллель дикого типа, в результате промывки разрушается гибрид мутантного аллеля, но не аллеля дикого типа, и половина образованных гибридов сохраняется.
При использовании в дот-блот-гибридизации олигонуклеотидного зонда, соответствующего мутантному аллелю исследуемого гена, по тем же самым причинам после промывки в жестких температурных условиях гибриды сохранятся в случае ДНК гомозиготных и гетерозиготных по мутантному аллелю индивидуумов, но будут разрушены в пробах с ДНК, содержащей только нормальные аллели.
Аллель-специфический анализ с использованием рестриктаз применяют в том случае, когда исследуемая мутация изменяет сайт рестрикции. Принцип этого метода полностью совпадает с таковым метода ПДРФ, рассмотренного выше. Рестриктаза может расщеплять двухцепочечную ДНК только в том случае, если ДНК содержит соответствующий сайт рестрикции. Наличие или отсутствие сайта рестрикции в продукте ПЦР указывает на особенности первичной структуры амплифицируемого участка ДНК: наличие или отсутствие мутации, изменяющей последовательность нуклеотидов этого участка. В результате мутаций могут не только элиминироваться известные сайты рестрикций, но и возникать новые, что выявляется по изменению электрофоретической подвижности продуктов ПЦР после их инкубации с рестриктазами.
Аллель-специфическая ПЦР. Известно, что для эффективного осуществления ПЦР 3'-концевой нуклеотид праймера должен быть комплементарен соответствующему нуклеотиду матричной ДНК. В противном случае эффективность удлинения праймера во время ПЦР резко снижается и при определенных сочетаниях ошибочно спаренных нуклеотидов может отсутствовать вообще. Именно эта особенность ПЦР и лежит в основе метода обнаружения мутаций с помощью аллель-специфической ПЦР, иначе иногда называемой аллель-специфической элонгацией праймера (allele specific primer extension).
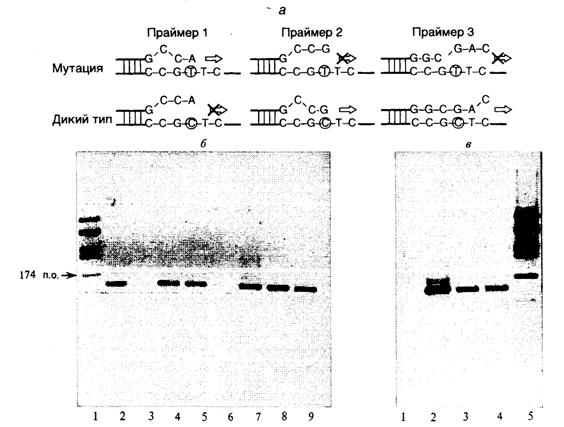
Рис. II.34. Схема одной из современных модификаций аллель-специфической ПЦР (а), использованной для идентификации точковой мутации Leidenв геноме человека (б и в)
Со всеми аллель-специфическими праймерами использован один и тот же встречный праймер. 3’-Концевые нуклеотиды аллель-специфических праймеров комплементарны мутантному нуклеотиду T (4), нуклеотиду дикого типа C (6), праймер 7 комплементарен нуклеотиду дикого типа своей внутренней частью, а его 3’-концевой нуклеотид не комплементарен матричной ДНК. Для усиления специфичности в праймеры 4 и 6 вблизи 3’-концов введены дополнительные нуклеотиды, некомплементарные матрице. Праймер 4 элонгируется ДНК-полимеразой в присутствии гомозиготной мутантной ДНК, но не ДНК дикого типа (б – дорожки 2 и 3 соответственно), в случае праймеров 6 и 7 наблюдается обратная картина (б и в – дорожки 6,8 и 1,3 соответственно). При наличии мутации в гетерозиготном состоянии все праймеры эффективно элонгируются (б – дорожки 5, 9, в – дорожка 4). Увеличение циклов ПЦР сверх оптимального приводит к образованию продуктов ПЦР в тех пробах, где при меньшем числе циклов они не образовывались (б – дорожки 4,7 и в – дорожка 2), что может служить внутренним контролем. Праймер 7 является универсальным, так как позволяет обнаруживать почти любую гомозиготную точковую мутацию, попадающую в его внутреннюю часть. Использование пар праймеров 4 и 6 или 4 и 7 позволяет легко дифференцировать гомозиготные и гетерозиготные мутации
На рис. II.34 представлены схема высокоэффективного варианта аллель-специфической ПЦР, недавно разработанного нами и использованного для диагностики мутации Leiden при тромбофилиях, а также полученные с помощью данного метода результаты. Эта мутация локализована в экзоне 10 гена фактора V системы свертывания крови человека и часто ассоциирована с синдромом повышенной ее свертываемости. В соответствии с последовательностью нуклеотидов анализируемого участка генома синтезируют два праймера, 3'-концевой нуклеотид одного из которых комплементарен мутантному нуклеотиду матричной ДНК, а у другого – нуклеотиду дикого типа (см. рис. II.34, а, б). Для усиления специфичности действия праймеров вблизи их 3’-концов были введены некомплементарные матрице нуклеотиды. Для исключения ложноотрицательных результатов в пробах, где продукт ПЦР отсутствует, повышали число циклов ПЦР сверх оптимального, после чего, если система работает нормально, продукт ПЦР появляется и в этих пробах, что может служить дополнительным внутренним контролем. Другой тип разработанных нами универсальных аллель-специфических праймеров содержит 3’-концевой нуклеотид, всегда некомплементарный матрице, а мутантный нуклеотид матрицы попадает в его внутреннюю часть (см. рис. II.34, а, в). В этом случае продукты ПЦР отсутствуют, если в гибриде во внутреннюю часть праймера попадает любой некомплементарный мутантный нуклеотид матричной ДНК вне зависимости от его точной локализации. Такие праймеры позволяют обнаруживать любые точковые мутации в гомозиготном состоянии и у гаплоидных микроорганизмов.
Для выявления гетерозиготного состояния анализируемого гена иногда используют мутантный и нормальный праймеры разных размеров, которые различаются по длине их 5'-концевых последовательностей, полностью комплементарных анализируемой ДНК. В этом случае в процессе ПЦР в реакционную смесь можно одновременно добавлять оба аллель-специфических праймера: мутантный и нормальный вместе с общим для обоих праймеров – встречным. Образовавшиеся продукты реакции, соответствующие мутантному аллелю и аллелю дикого типа, далее разделяют электрофоретически в гелях, используемых для секвенирования нуклеиновых кислот.
При использовании аллель-специфических праймеров для обнаружения мутаций необходимо иметь в виду, что не все сочетания ошибочно спаренных с матрицей 3'-концевых нуклеотидов одинаково эффективны в блокировании ПЦР. Наименьшей способностью к элонгации праймеров с ошибочно спаренными 3'-концевыми нуклеотидами обладает так называемый фрагмент Шоффлера Taq-полимеразы, который представляет собой молекулу ДНК-полимеразы T. aquaticus, укороченную с N-конца на несколько десятков аминокислотных остатков. В то же время в этом методе не применимы термостабильные ДНК-полимеразы, обладающие 3'®5'-корректирующей активностью, например Vent-полимераза.
ПЦР с аллель-специфическими праймерами является простым и эффективным методом обнаружения мутаций в геномной ДНК обследуемых индивидуумов. В отличие от всех рассмотренных выше методов аллель-специфическая ПЦР в такой постановке позволяет находить небольшое количество мутантных ДНК на фоне большого числа молекул ДНК дикого типа. Аналогичная генетическая ситуация может иметь место в том случае, если соматические мутации возникают в процессе онтогенетического развития организмов, и лишь небольшая часть соматических клеток (клон соматических клеток) таких организмов-мозаиков содержит анализируемые мутации. В этом случае, например при онкологических заболеваниях, мутантные ДНК в препаратах суммарной ДНК сильно разбавлены соответствующими последовательностями дикого типа и их трудно обнаружить другими методами. Аллель-специфические праймеры, полностью комплементарные лишь мутантным последовательностям анализируемой ДНК, вовлекаются в амплификацию таких мутантных последовательностей, а последовательности нуклеотидов ДНК дикого типа не амплифицируются. Подобный подход позволяет обнаруживать несколько десятков или сотен молекул мутантной ДНК на фоне десятков тысяч молекул ДНК дикого типа.
Лигазная цепная реакция – ЛЦР (ligase chain reaction – LCR). Способность ДНК-лигаз восстанавливать фосфодиэфирные связи в одноцепочечных разрывах двухцепочечных молекул ДНК используется при проведении ЛЦР. Для реализации этого подхода синтезируют два олигонуклеотида, комплементарные непрерывной последовательности нуклеотидов ДНК, которые после гибридизации с такой последовательностью примыкают друг к другу и разделены лишь одноцепочечным разрывом. При этом 3'-конец предшествующего нуклеотида должен содержать свободную 3'-ОН-группу, а в 5'-положении 5'-конца олигонуклеотида, следующего за ним, должна находиться фосфатная группа.
В первом цикле ЛЦР два вышеупомянутых олигонуклеотида отжигаются с исследуемой денатурированной ДНК (как и при ПЦР) в присутствии термостабильной ДНК-лигазы, а также всех остальных необходимых кофакторов и ионов. Реакционную смесь прогревают до температуры, оптимальной для лигирования, после чего между отожженными олигонуклеотидами образуется фосфодиэфирная связь, соединяющая оба олигонуклеотида друг с другом. Затем температуру реакционной смеси повышают до температуры плавления гибрида, образованного анализируемой ДНК и лигированными олигонуклеотидами, которые освобождаются в реакционную смесь в составе единого фрагмента. Во время второго цикла температуру реакционной смеси вновь понижают до температуры отжига олигонуклеотидов, которые, находясь в молярном избытке по отношению к освободившимся продуктам реакции, преимущественно гибридизуются с анализируемой ДНК. Далее связавшиеся олигонуклеотиды снова лигируют, и образовавшийся продукт реакции освобождают из гибрида повышением температуры. При этом содержание продукта в реакционной смеси удваивается. После проведения n циклов ЛЦР в реакционной смеси теоретически может оказаться nx молекул продукта реакции, где х – число пар олигонуклеотидов, вступающих в реакцию в каждом цикле, теоретически равное числу копий анализируемой последовательности нуклеотидов в реакционной смеси.
ЛЦР не происходит в том случае, если 3'-концевой нуклеотид первого олигонуклеотида или 5'-концевой нуклеотид второго некомплементарны соответствующим нуклеотидам анализируемой ДНК. Поэтому при наличии мутации в тех сайтах ДНК, где олигонуклеотиды стыкуются друг с другом, в реакцию со своим партнером вступает только измененный олигонуклеотид, полностью комплементарный анализируемой мутантной ДНК, т.е. продукт реакции образуется лишь при наличии в реакционной смеси "мутантного" олигонуклеотида, но не олигонуклеотида дикого типа. Таким образом, принципы, лежащие в основе метода определения мутаций с помощью ЛЦР, в ряде существенных моментов идентичны принципам аллель-специфической ПЦР.
Для количественной оценки ЛЦР один из олигонуклеотидов обычно метят биотином, а другой (соответствующий мутантному аллелю) – с помощью радиоактивной или флуоресцентной метки. По завершении ЛЦР олигонуклеотиды, меченные биотином, связывают с мембранными фильтрами с иммобилизованным стрептавидином, а количество лигированных олигонуклеотидов определяют по количеству связавшейся с фильтрами радиоактивной или флуоресцентной метки после отмывки непрореагировавших олигонуклеотидов.
Количественная ПЦР. Результаты большинства из обсуждавшихся выше методов с использованием ПЦР имеют качественный характер. С помощью этих методов легко обнаруживают качественные изменения в генах: точковые мутации, делеции и вставки. Однако при некоторых наследственных заболеваниях соответствующие симптомы возникают в ответ на изменение дозы (числа копий) определенных генов. Типичным примером наследственного заболевания, обусловленного изменением числа копий определенного участка хромосомы 21 в геноме клеток человека, является синдром Дауна. Цитогенетически это заболевание может быть диагностировано по трисомии хромосомы 21 или по наличию крупных транслокаций части этой хромосомы на другие хромосомы на фоне присутствия двух других нормальных хромосом 21. Тем не менее описаны клинические случаи синдрома Дауна, при которых не происходит видимых изменений кариотипа человека. Это обусловлено дупликацией с последующей транслокацией или без нее небольшого участка хромосомы 21. Выявление таких мутаций невозможно традиционными цитогенетическими методами. Однако с помощью количественной ПЦР определение полуторакратного возрастания дозы соответствующего участка хромосомы 21 становится совершенно реальным.
Проведение количественной ПЦР характеризуется, по крайней мере, двумя особенностями. Во-первых, ПЦР проводят в присутствии дезоксирибонуклеозидтрифосфатов или праймеров, меченных с помощью радиоактивной или флуоресцентной метки, с тем чтобы точно определять количество образовавшегося продукта ПЦР. Во-вторых, во время ПЦР необходимо завершать реакцию достаточно рано, пока не образовалось слишком много ПЦР-продуктов. Это связано с тем, что в конечной фазе насыщения, когда продуктов ПЦР становится слишком много, лимитирующими звеньями реакции становятся как субстраты (дезоксирибонуклеозидтрифосфаты), так и сам фермент, для молекул которого становится слишком много матричной ДНК в виде ПЦР-продуктов. В таких условиях завершение очередного цикла ПЦР уже не сопровождается удвоением количества ПЦР-продуктов и происходит нивелирование небольших количественных различий между разными пробами, которые достаточно четко выявляются на ранних стадиях ПЦР после прохождения нескольких циклов реакции.
При проведении количественной ПЦР в реакционную смесь необходимо вводить внутренние контроли в виде дополнительной пары праймеров, с помощью которых происходит амплификация генетического локуса, для которого точно известна его доза (число копий на молекулу геномной ДНК) в исследуемом геноме. Таким образом, сравнение количества продукта ПЦР, образующегося при амплификации исследуемого локуса, с количеством продукта ПЦР контрольного локуса позволяет определять их количественные соотношения в геноме.
ДНК-типирование
Результаты, полученные при исследовании структуры и организации геномной ДНК животных, растений и микроорганизмов, наложили глубокий отпечаток на методологию их систематизации. Проблема адекватного отнесения конкретного организма к той или иной группе не является чисто академической. Основанная на точных критериях систематика живых организмов, определяющая эволюционное родство между ними, помимо чисто теоретического представляет и большой практический интерес. В частности, знание источника различных штаммов патогенных микроорганизмов, вызывающих больничные инфекции, позволило бы выработать эффективные меры защиты против их распространения.
Недавно были обнаружены генетические маркеры в виде специфических последовательностей ДНК, которые дают возможность выявлять родственные отношения между особями одного и того же вида путем внутри- и межпопуляционных исследований. Такого рода исследования популяций человека особенно важны с практической точки зрения. В настоящее время молекулярно-генетические методы позволяют осуществлять идентификацию личности в судебно-медицинских исследованиях, а также решать в спорных случаях проблему определения отцовства.
Генетическим, или ДНК-типированием, называют определение особенностей генотипа организма путем анализа ДНК его генома. Иными словами, в процессе ДНК-типирования определяют особенности первичной структуры ДНК исследуемого организма в конкретных генетических локусах. Абсолютно консервативных генетических локусов, по-видимому, не существует. Мутационные изменения генома непрерывно накапливаются на протяжении филогенетического (исторического, эволюционного) развития вида. Но такого же рода изменения неуклонно происходят в геномах отдельных особей, принадлежащих одной или разным популяциям. Естественно, что проще всего обнаруживаются межвидовые различия в последовательностях нуклеотидов исследуемых участков генома, поскольку эти различия, как правило, значительны, и именно они определяют эволюционное расстояние между видами (их дивергированность).
Таким образом, у каждого вида организмов имеется большое число внутривидовых различий в первичной структуре ДНК отдельных генетических локусов. Генетические локусы, выполняющие одну и ту же функцию (содержащие один и тот же ген или несколько генов), но различающиеся по первичной структуре ДНК, называют полиморфными, а само явление существования в популяции полиморфных локусов получило название генетического полиморфизма.