В конце хирургической обработки сосуды, нервы и сухожилия следует по возможности закрыть мягкими тканями для предупреждения их высыхания, дополнительной травмы и некроза. Полость суставов закрывают. Если зашивают синовиальную оболочку, то закрывают и капсулу сустава. Когда в ходе ревизии раны выявляется повреждение кости, то свободно лежащие костные фрагменты должны быть удалены, отломки обработаны и сопоставлены, сразу же должна быть обеспечена надежная иммобилизация конечности.
Пассивное дренирование применяют при неглубоких «открытых» ранах и при дренировании подкожной клетчатки небольших ушитых послеоперационных ран. В этих случаях в рану вводят резиновые или марлевые полоски, турунды, трубчатые дренажи (рис. 18.5), которые не дают слипаться краям кожной раны и обеспечивают ток раневого отделяемого в повязку под действием силы тяжести или за счет капиллярных свойств гигроскопичного перевязочного материала.
Недостатком такого способа дренирования является достаточно быстрое прекращение действия марлевых выпускников вследствие заполнения капилляров вязким экссудатом. Кроме того, при их смене травмируются появляющиеся в ране грануляции. Вариантом пассивного дренирования раны является тампонада по Микуличу, применяемая при наличии обширных раневых полостей с дефектом кожи. Дно и стенки раны выкладывают в виде мешка двухслойной марлевой салфеткой, а образовавшуюся полость выполняют тампонами с антисептическими средствами. При смене тампонов подлежащую салфетку не удаляют, чем предупреждают травматизацию грануляций.
Активное дренирование подразумевает принудительное удаление содержимого из полости раны. Активное дренирование показано при глубоких обширных ранах со сложной конфигурацией раневого канала и наличием замкнутых карманов.
|
|
Выбор метода закрытия раны после хирургической обработки является одним из центральных в хирургии. Шов раны показан при условии сопоставления краев раны без натяжения и нарушения кровоснабжения тканей — применяют различные виды швов (схема 18.1).
Схема 18.1. Виды швов и условия, позволяющие их накладывать на рану после хирургической обработки [Шапошников Ю. Г. и др., 1995]
Виды швов
 Первичный Первичный
| Накладывают редко, преимущественно на лице: — в ране не должно быть признаков | |
| или угрозы развития инфекцион- | ||
| ного воспаления; | ||
| — при уверенности в радикальности | ||
| хирургической обработки; | ||
| — при удовлетворительном состоянии | ||
| раненого и возможности наблю- | ||
| дать его на данном этапе эвакуа- | ||
| ции до снятия швов |
Накладывают сразу после хирургической обработки




 Первичный провизорный
Первичный провизорный
Накладывают, не завязывая нитей, на большинство ран без признаков раневой инфекции; швы затягивают на 4—5-е сутки при спокойной ране
Накладывают сразу после хирургической обработки





 Первичный отсроченный
Первичный отсроченный
Накладывают на рану без признаков микробного воспаления до развития грануляций
Накладывают на 6— 7-е сутки после хирургической обработки





 Вторичный ранний
Вторичный ранний
Накладывают на гранулирующую рану без признаков глубокой раневой инфекции при удовлетворительном состоянии раненого
Накладывают на 8— 15-е сутки после хирургической обработки
|
|





 Вторичный
Вторичный
поздний
Накладывают в стадии рубцевания раны; рубцы и грануляции иссекают, края раны мобилизуют для последующего сближения швами
Накладывают на 20— 30-е сутки после хирургической обработки
Первичные швы накладывают непосредственно по окончании хирургической обработки раны. Условиями для наложения шва являются уверенность в радикальности хирургической обработки, отсутствие клинических признаков воспалительной реакции в тканях после хирургической обработки, адекватное кровоснабжение и иннервация в зоне ранения с учетом целости магистральных сосудов и нервов, удовлетворительное общее состояние больного, профилактическое применение антибиотиков.
Такое сочетание благоприятных условий для наложения первичного шва встречается, как правило, в стационарных условиях после выполнения плановых хирургических вмешательств, когда рана, образовавшаяся вследствие выполнения оперативного доступа, наносится по возможности атравматич-но. В хирургии повреждений это встречается достаточно редко, поэтому здесь широко используются первично-отсроченный шов и вторичные швы.
Однако существует ряд повреждений, при которых имеются абсолютные показания к наложению первичного шва или первичной кожной пластики: скальпированные раны головы и лица, ранения пальцев кисти с дефектом кожи, открытые повреждения в области суставов, ранения и отрывы кожи полового члена.
В этих случаях для кожной пластики и шва могут быть использованы кожные покровы, расположенные в непосредственной близости от раны; полностью и частично отторгнутые кожные лоскуты; кожные покровы, взятые в отдалении от раны, в том числе с удаленных сегментов конечностей.
|
|
Первично-отсроченный шов накладывают, как правило, между 4-м и 7-м днем после хирургической обработки до появления в ране грануляций. За это время купируются явления первичной воспалительной реакции, связанной с повреждением тканей, отграничивается зона вторичного некроза, истекают сроки инкубационных периодов для большинства патогенных микробных штаммов. Одновременно проводят профилактические антимикробные мероприятия, осуществляют полноценное комплексное лечение больного.
Вторичные швы накладывают на гранулирующую рану, в которой отсутствуют признаки инфекционного воспаления. Различают ранний вторичный шов, который накладывается на 8—15-й день после хирургической обработки раны. При наложении такого шва грануляции не иссекают, края раны не мобилизуют, так как они должны быть легко сопоставимы. Поздний вторичный шов накладывают на 15—30-й день после хирургической обработки, что, как правило, связано с длительным течением инфекционного процесса в ране. К этому сроку на отдельных участках раны и ее краях развивается рубцовая ткань, которая существенно ограничивает подвижность краев раны. Поэтому операция наложения вторичного позднего шва включает иссечение рубцов и грануляций, мобилизацию краев раны.
В тех случаях, когда одномоментное закрытие раны швом невозможно из-за обширного дефекта кожи, а свободная кожная пластика дает неблагоприятный функциональный результат, возможно использование так называемых экспандерных методов закрытия раны. Один из вариантов такого метода заключается в постепенном дозированном затягивании шва в течение 2—3 нед. Для предотвращения прорезывания швов вдоль края раны проводят укрепляющие металлические конструкции (спицы). По другой методике в непосредственной близости от раны подкожно имплантируют баллон из индифферентного материала, который постепенно увеличивают в объеме. В зоне баллона за счет эластичного растяжения постепенно создается избыток кожи, который и используется для закрытия раны.
При закрытии раны любым видом швов необходимо тщательное клиническое наблюдение за процессом заживления. Оно состоит в контроле за
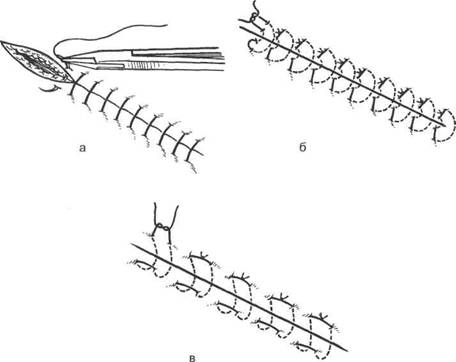
Рис. 18.6. Узловые швы.
а — простой; б — вертикальный матрацный; в — горизонтальный матрацный.
функционированием дренажей, своевременной диагностике неинфекционных осложнений заживления, а также ранней диагностике гнойного воспаления.
При наложении швов необходимо соблюдать принцип хорошей адаптации краев раны, в ней нельзя оставлять недренируемые полости и карманы. В обычных условиях это достигается послойным ушиванием раны обычными узловыми швами. В то же время в ранах с высоким риском нагноения нежелательно оставляет неснимаемые (внутритканевые) лигатуры из нерассасывающегося материала (шелк, капрон, лавсан), которые впоследствии могут являться очагом хронического воспаления.
В этих случаях предпочтительнее наложение наружного многостежкового узлового шва (рис. 18.6).
В условиях умеренных воспалительных изменений краев раны целесообразно использование разгружающих (ретенционных) швов, а также амортизаторов (резиновых и ПХВ-трубок, резиновых пробок, пуговиц) (рис. 18.7).
При наличии округлых раневых кожных дефектов площадью более 5 см2 возможно использование различных вариантов кожной пластики. Свободная кожная пластика для закрытия обширных раневых поверхностей в настоящее время выполняется главным образом в виде дерматомной аутопластики перфорированным (сетчатым) лоскутом.
В целом основные принципы хирургической обработки сводятся к широкому рассечению мышечно-фасциальных футляров, что способствует не толь-
ко хорошему осмотру раны, но и улучшению ее кровоснабжения за счет декомпрессии отечных тканей; щадящему отношению к естественным тканевым барьерам, исключающему их дополнительную травматизацию: отказ от грубых лигатур, неумеренной электрокоагуляции, прошивания больших мышечных массивов; устранению по ходу операции замкнутых пространств и полостей, где создаются оптимальные условия для вегетации микробов; созданию естественных барьеров (кожных, мышечных) между внешней средой и тканями, обладающими невысокой устойчивостью к инфекции; адекватному гемостазу на всех этапах операции.
В практике современной хирургии осуществляют ПХО как одномоментную первично-восстановительную операцию — выполняют восстановительные вмешательства на поврежденных магистральных кровеносных сосудах, костях, сухожилиях и нервах, однако это требует надлежащего оснащения и должной квалификации хирурга.
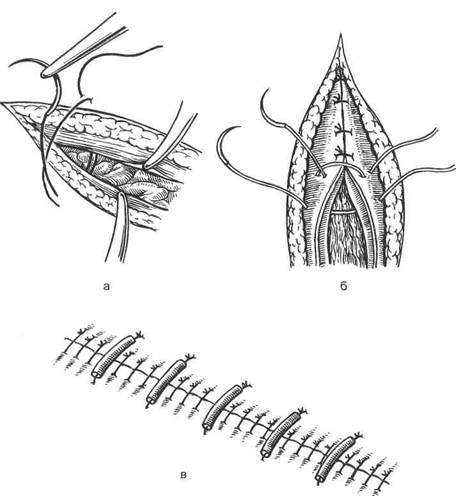
Рис. 18.7. Ретенционные швы.
а — сквозной; б — внутренний коаптационный; в — прокладки под разгружающие швы.
18.2.7. Инфекционные осложнения ран
Инфекционные осложнения являются обязательным компонентом тяжелых травм.
Частота таких осложнений зависит от состояния защитных реакций организма, с одной стороны, и количеством и вирулентностью внедрившихся в рану возбудителей инфекции — с другой.
Пути попадания микробов в рану различны. Наиболее часто микрофлора заносит из окружающей среды в момент ранения — первичное микробное загрязнение раны. Кроме того, микробы-сапрофиты проникают в рану с поверхности кожи и из ее придатков — сальных и потовых желез, волосяных фолликулов, из просвета поврежденных полых органов, при нарушении правил асептики во время перевязок и операций — это вторичное микробное загрязнение раны. При развитии инфекционного процесса в ране в отличие от бактериального загрязнения, микробы распространяются в глубь жизнеспособных тканей и лимфатические и кровеносные пути, после чего проявляется их патогенное воздействие как на течение местного раневого процесса, так и организм в целом.
18.2.8. Современные принципы лечения гнойных ран
В комплексе мероприятий, направленных на лечение гнойной раны, важнейшее значение имеют:
• скорейшее очищение раны от погибших и нежизнеспособных тканей, создание благоприятных условий для оттока раневого отделяемого;
• подавление жизнедеятельности раневой микрофлоры и уменьшение степени микробной обсемененности раны;
• устранение факторов, неблагоприятно влияющих на заживление раны, и коррекция нарушений иммунобиологической защиты организма.
Решение этих задач возможно только при рациональном сочетании оперативных методов лечения с приемами физической санации ран, использованием современных препаратов для местного медикаментозного лечения ран, комбинированным применением антибиотиков, комплексном общем лечении патологических синдромов, определяющих ход заживления раны.
Для лечения гнойных ран разработан метод активного хирургического лечения, включающий следующие основные компоненты:
• радикальная хирургическая обработка раны с удалением всех нежизнеспособных тканей и с использованием дополнительных методов обработки (ультразвук, лазер и др.);
• дренирование ран с промыванием, использование управляемой абак-териальной среды;
• использование мазевых композиций на полиэтиленгликолевой основе;
• раннее закрытие ран с помощью кожной пластики;
• сочетание хирургического лечения с проведением многокомпонентной интенсивной терапии, включая регионарную внутриартериальную и(или) внутрилимфатическую инфузию антибактериальных препаратов.
Ликвидация гнойной раны в большинстве случаев может быть достигнута только одним способом — радикальной хирургической обработкой.
Под хирургической обработкой гнойной раны понимают широкое ее рассечение с вскрытием карманов и затеков и иссечением всех некротических, нежизнеспособных и пропитанных гноем и кровью тканей как основного субстрата для развития раневой инфекции. Помимо удаления нежизнеспособных тканей («питательная среда» для развития микробов), хирургическая обработка имеет целью значительное снижение количества микробов в ране.
Хирургическая обработка показана не только в I фазе течения раневого процесса. Показания к хирургической обработке во II фазе определяются также стремлением максимально быстро закрыть раневую поверхность вторичными швами или местными тканями. Хирургическое вмешательство часто необходимо и в фазе регенерации в связи с образованием гнойных затеков, потребностью повторного иссечения воспалительно-измененных тканей и гнойных грануляций.
Хирургическая обработка состоит из следующих основных элементов: 1) туалет окружности раны; 2) рассечение раны (доступ); 3) иссечение нежизнеспособных, загрязненных и имбибированных тканей; 4) применение методов дополнительной обработки раны (промывание пульсирующей струей жидкости, вакуумирование, ультразвук); 5) дренирование; 6) раннее закрытие раны.
Подготовку и обработку операционного поля следует проводить по всем правилам, принятым в общей хирургии. Для туалета раны и ее окружности эффективно мытье кожи и промывание самой раны гексахлорофеновым мылом и стерильными щетками под проточной водой (душ) или пульсирующий струей раствора антисептиков. Механическая очистка кожи и промывание самой раны уменьшают бактериальную обсемененность и создают асептические условия для оперативного вмешательства.
Рассечение рассматривают как оперативный доступ (разрез), необходимый для ревизии раны и выполнения основного этапа хирургической обработки — удаления нежизнеспособных тканей. Разрез следует производить с учетом анатомо-топографической характеристики раны, он должен быть достаточным для надежного доступа в глубину раны и ее ревизии, обеспечивать возможность полноценного иссечения некротизированных тканей, удаления гематомы и создания хорошего оттока раневого отделяемого.
Затем наступает основной и самый ответственный этап оперативного вмешательства — удаление нежизнеспособных тканей в направлении от поверхностных слоев к глубоким.
В результате радикальной хирургической обработки, особенно при обширном гнойном поражении, нередко образуются значительные дефекты мягких, а иногда и костных тканей. Эти обстоятельства ставят перед хирургом следующие задачи: 1) обязательное определение потенциальных или непосредственных возможностей максимально быстрого закрытия раневой поверхности любым доступным способом пластики; 2) обязательное эффективное активное дренирование раны после хирургического вмешательства любого объема.
В большинстве случаев при хирургической обработке ран различной этиологии и локализации полное иссечение погибших тканей и удаление всей раневой микрофлоры невозможны. Однако значение критического уровня содержания микробов в ране заставляет стремиться к максимальному уменьшению количества их в процессе операции. Повышение технического уровня оснащения хирургии открыло новые возможности для совершенствования техники и улучшения результатов хирургической обработки раны.
Промывание полости раны пульсирующей струей раствора антисептика осуществляется при помощи специальных приборов, которые подают в рану под давлением многократно ритмично прерывающуюся струю жидкости.
Использование специальных наконечников-распылителей позволяет обрабатывать слепые полости и затеки, сочетая промывание с кюретажем (выскабливанием) раневой поверхности. В качестве промывных сред используются растворы фурацилина, диоксидина. Такое промывание позволяет снизить микробную обсемененность раны на 2—3 порядка, создать депо антисептика в стенках раны за счет его импрегнации в ткани.
Метод вакуумной обработки раны основан на кратковременном создании отрицательного давления на отдельных участках раневой поверхности. С этой целью используют обычный операционный вакуум-отсос. При вакуумной обработке наконечник плотно прижимают к стенкам раны и, перемещая его, производят отсасывание детрита, свободных участков тканей, инородных частиц и микроорганизмов.
В настоящее время широко используют для обработки ран так называемые хирургические энергии — все виды хирургического воздействия на ткани с целью рассечения, иссечения, гемостаза, сопоставления краев раны с использованием ультразвукового, лазерного, плазменного воздействия.
Противопоказанием к проведению полной хирургической обработки гнойного очага является опасность повреждения жизненно важных образований — нервов, крупных сосудов, сухожилий, суставных сумок. В таких случаях операцию ограничивают широким рассечением гнойной раны и адекватным ее дренированием с иссечением лишь крупных очагов некроза, т. е. выполняют частичную хирургическую обработку.
Обязательным условием успешной хирургической обработки ран является создание беспрепятственного оттока раневого отделяемого с помощью различных методов дренирования. В зависимости от характера раны, конфигурации раневого канала, количества экссудата возможно применение различных способов дренирования.
А Аспирационное дренирование основано на введении в полость раны трубок и создании в ней отрицательного давления. Отрицательное давление на периферическом конце дренажной трубки может быть создано посредством присоединения сжатой резиновой груши или специального коллектора, которые, расправляясь, отсасывают жидкость из раны (дренирование по Ре-дону). В качестве аспирационного устройства используют также водоструйный отсос, аппарат Боброва, специальные отсосы.
А Промывное дренирование позволяет осуществить механическое удаление раневого содержимого вместе с током промывной жидкости.
Промывное дренирование осуществляют посредством перфорированных трубчатых сквозных дренажей, проведенных через всю полость раны. При наличии глубоких полостей используют слепое дренирование при помощи двухпросветного трубчатого дренажа, один канал которого используется для введения жидкости, а второй — для удаления. Перфузатом может быть любой стерильный раствор, обладающий умеренной гипертоничностью и антимикробным действием, а также не оказывающий раздражающего действия на ткани.
А Аспирационно-промывное дренирование объединяет в себе два вышеуказанных метода и обеспечивается постоянным или периодическим промыванием раны при постоянном отсасывании содержимого из ее полости.
Модификацией этого вида является программированное дренирование, которое позволяет автоматически чередовать промывание и аспирацию ране-
вого содержимого, что приводит к более полному очищению полости и обеспечивает определенную экспозицию перфузата-антисептика в ране.
Хирургическую обработку гнойной раны стремятся по возможности превратить в восстановительную операцию, что дает возможность провести ее закрытие. Используют первично-отсроченный шов, ранний вторичный шов, поздний вторичный шов. Их разделяют на несколько этапов: наложение глухих швов в условиях массивной местной и общей антибактериальной терапии; наложение первичных отсроченных и вторичных швов после энзимотерапии гнойной раны; наложение швов в условиях активного дренирования раны. Наложение швов на гнойную рану возможно только при полном ее очищении от погибших и нежизнеспособных тканей. При наличии разнообразных способов принципы наложения шва на гнойную рану являются практически едиными — нельзя оставлять замкнутых полостей и недренируемых «карманов», адаптация краев и стенок раны должна быть максимальной, нежелательно оставлять лигатуры из нерасса-сывающегося материала, запрещается послойное ушивание раны. Обычно используют узловой шов, проведенный через все слои раны. Можно использовать многостежковой обвивной шов. Хорошее соприкосновение стенок и краев раны обеспечивает шов по Донати. В тех случаях, когда предполагается длительное удерживание краев раны и имеется опасность прорезывания швов, целесообразно наложение вторично-провизорных швов или дополнительно прошивают (на отдельных участках) полость раны чрескожно и затягивают швы на пелоте (марлевые салфетки, полиэтиленовые трубки).
Следующим по значимости и эффекту методом закрытия гнойной раны является кожная пластика главным образом в виде дерматомной аутопластики перфорированным (сетчатым) лоскутом.
18.2.9. Местное медикаментозное лечение ран
Местное медикаментозное лечение ран заключается в нанесении различных лекарственных препаратов на поверхность раны, а также введении их различными способами в ткани, окружающие раневую полость. Местное лечение применяется как с профилактической целью до проведения хирургической обработки, так и в качестве лечения ран после нее. Местному медикаментозному лечению подлежат практически все раны, которые после хирургической обработки нельзя закрыть первичным швом наглухо.
Лекарственные препараты применяют строго в соответствии с фазой раневого процесса в зависимости от задач лечения. Некоторые средства имеют комплексный механизм действия, однако лекарств, которые можно эффективно использовать во всех фазах заживления, в настоящее время не существует.
а В первой фазе раневого процесса для ускорения купирования воспалительной реакции местные медикаментозные средства должны обеспечить подавление инфекции, эвакуацию раневого отделяемого, отторжение некроза, улучшение трофики тканей раны.
С этой целью применяют следующие препараты.
Антисептики в виде растворов и присыпок используют как для промывания раны, так и для аппликации на раневую поверхность вместе с марлевыми повязками. Наиболее широкое распространение получили 0,02 % раствор фурацилина, 0,5 % раствор хлоргексидина, слабый раствор этилового спирта, повидон-йода, йодметроксида.
Использование антисептических растворов целесообразно в виде влажно-высыхающих повязок на свежие раны до появления в них признаков развития инфекции. При лечении гнойных ран возможно применение антисептических ванн, где антибактериальное действие раствора сочетается с механическим очищением раневой поверхности.
Порошкообразные формы антисептиков создают защитный слой на поверхности раны, предотвращая дополнительное внедрение патогенной микрофлоры. Обычно применяют порошки стрептоцида, ксероформа, присыпку И. Д. Житнюка (стрептоцид 20,0; борная кислота 5,0; ксероформ 20,0; анестезин 5,0; глюкоза 50,0).
Гипертонические растворы (10 % раствор хлорида натрия, 40 % раствор глюкозы, 20 % раствор мочевины) улучшают дренирующие свойства марлевой повязки за счет осмотического эффекта, который, однако, уменьшается по мере высыхания повязки и заканчивается через 4—6 ч, что вызывает необходимость очередной перевязки.
Мази на основе полиэтиленоксида (водорастворимые мази) — левосин, ле-вомеколь, 5 % диоксидиновая мазь, 10 % мазь мафенид-ацетата, йодмет-риксилен и др. обладают хорошими гидрофильными, антибактериальными и некролитическими свойствами. Применение водорастворимых мазей быстро купирует отечность поврежденных тканей, уменьшает раневую экссудацию, способствует отторжению омертвевших тканей, оказывает выраженный обезболивающий эффект (за счет местного анестетика).
В последние годы разработана новая серия водорастворимых мазей, где в состав комбинированной основы-носителя введен проксанол. Мази «Диоксиколь», «Мирамистин», «Нитацид» сочетают мягкое дегидратаци-онное воздействие на ткани с высоким антибактериальным и некролити-ческим эффектом.
Протеолитические ферменты способствуют очищению ран и оказывают бактерицидное действие. Несмотря на различие в происхождении (животное, растительное, бактериальное), эти препараты обладают протеолитиче-скими, антикоагуляционными, противовоспалительными свойствами, повышают чувствительность раневой микрофлоры к антибактериальным средствам. Разжижая раневой экссудат, ферменты способствуют его лучшей эвакуации из полости раны.
Ферменты применяют как в нативном виде (трипсин, химотрипсин, папайи), так и в составе различных препаратов (ируксол). Нанесение порошка протеолитических ферментов на раневую поверхность или введение в раневую полость пропитанных ими влажных тампонов оказывает воздействие не более 3—4 ч. Постоянное воздействие достигается при помощи ферментативного орошения ран (в промывную жидкость, вводимую в рану по дренажам, добавляют протеолитический фермент). Промывание проводят постоянно или дробно, оставляя раствор ферментов в ране на 40—50 мин с последующей аспирацией.
Местное использование сорбентов является целесообразным и патогенетически обоснованным. Сорбирующие материалы обеспечивают отток с поверхности раны и из тканей воспалительного экссудата, содержащего микробы и их токсины, биологически активные вещества, продукты некро-лиза.
Местное применение в растворе антибиотиков ограничивается их низкой эффективностью за счет инактивации в кислой среде воспалительного очага, невысоким эффектом воздействия на живые ткани за счет ограничения их лейкоцитарным пиогенным валом, возможностью местного раздражающего воздействия и аллергизации, а также вследствие быстрой генера-
ции антибиотикорезистентных штаммов. Непосредственно вводить в рану можно лишь некоторые специально разработанные антибиотики: полимик-син М, неомицин, грамицидин.
Эффективным оказывается лечение таких ран с использованием коллаге-новой губки с иммобилизованным гентамицином, которую вводят после туалета раны и накладывают асептическую повязку. Перевязку производят в зависимости от вида раны, степени выраженности гнойных выделений 1 раз в сутки; для достижения очищения раны требуется всего 4—5 перевязок.
Введение окситоцин-антибактериалъных комплексов способствует снижению критической массы микроорганизмов в 2—3 раза на 2—3-й день лечения.
Значительно шире антибиотики применяют в составе новокаиновых блокад, действие которых направлено на улучшение трофики тканей, устранение спазма периферических сосудов, прерывание патологической афферентной импульсации, исходящей из зоны ранения. Патогенетическое действие новокаиновых блокад усиливается за счет введения в их состав стероидных гормонов (преднизолон, гидрокортизон, дексаметазон), ингибиторов проте-аз (контрикал, гордокс, трасилол), а также препаратов, улучшающих микроциркуляцию (но-шпа, компламин, трентал, реополиглюкин и др.).