В дальнейшем изучение строения атома развивалось по двум направлениям – исследование атомного ядра и электронной оболочки атома. Первая количественная теория простейшего атома водорода была разработана Н. Бором в 1913г.
В 1913 г. Н. Бор предложил модель атома водорода, исходя из гипотезы Резерфорда, дополненной новыми положениями:
1. Электрон может вращаться по определённым круговым орбитам, не излучая энергии.
2. Ближайшая к ядру орбита отвечает нормальному, наиболее устойчивому состоянию атома.
3. Поглощение и излучение атомом энергии происходят лишь при перескоке электрона с одной орбиты на другую.
Начала волновой механики.
Открытия физики конца XIX - начала XX в. привели к выводу о том, что свет, который раньше рассматривался как пример волнового процесса, можно рассматривать как совокупность частиц (фотонов), обладающих механическими характеристиками движения – массой, энергией и импульсом. В 1900 г. М. Планком было предположено, что процесс излучения атомами световой энергии происходит не непрерывно, а порциями, квантами, величина которых зависит от частоты испускаемого света:
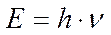
В 1905 г. А. Эйнштейн показал, что масса тела связана с его энергией соотношением  . Уравнения Планка и Эйнштейна дают возможность получить соотношение между массой фотона и длиной волны света, или частотой световых колебаний:
. Уравнения Планка и Эйнштейна дают возможность получить соотношение между массой фотона и длиной волны света, или частотой световых колебаний:

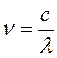
В 1924 г. Луи де Бройль предположил, корпускулярно волновая природа присуща не только свету, но и любым другим микрочастицам. При этом длина волны, соответствующая данной частице:

В 1927 г. Девиссон и Джермер обнаружили, что при дифракции электронов на никеле возникает дифракционная картина, сходная с дифракцией света на кристаллической решетке. Это явление получило название дифракции электронов. Оно считается экспериментальным доказательством существования волн де Бройля или корпускулярно-волнового дуализма электронов.
В волновых свойствах электрона заложен один из принципов волновой механики.
Вторым является принцип неопределённости Гейзенберга (1925г.).
В механике наблюдение волнового процесса – периодического колебания сплошной среды – позволяет определить длину волны и скорость её распространения. Чем больше область пространства, в котором распространяется волна, тем точнее можно определить эти характеристики. Иначе обстоит дело при переходе к объектам микромира. Гейзенберг показал, что точное определение положения электрона на орбите и его скорость не могут быть зафиксированы. Произведение неопределённостей положения (Δx) и скорости (Δp) никогда не может быть меньше, чем h/me:

или

Промежуток пространства, в котором вероятность нахождения электрона велика, называется электронным облаком.
А часть околоядерного пространства, которая охватывает около 90% электронного облака, называется атомной орбиталью.
Представление об атоме с определёнными орбитами заменяется в волновой механике представлением о вероятном нахождении электрона в той или иной части атома. Оценка этой вероятности производится при решении уравнения Шредингера, описывающего движение электрона.
Исходя из представления о наличии у электрона волновых свойств Шредингер в 1925 г. предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение выражение де Бройля (λ=h/mv), он получил новое уравнение, связывающее энергию электрона с пространственными координатами и так называемой волновой функцией (ψ), соответствующей в этом уравнении амплитуде трёхмерного волнового процесса.

Е – полная энергия, U – потенциальная энергия электрона, Ñ2Y – вторая производная волновой функции по осям х, у, z 
Особенно важное значение для характеристики состояния электрона имеет волновая функция ψ. Подобно амплитуде любого волнового процесса, она может принимать как положительные, так и отрицательные значения. Однако величина ψ2 всегда положительна. Причем чем больше значение ψ2 в данной области пространства, тем выше вероятность того, что электрон проявит здесь своё действие, т.е. его существование будет обнаружено в каком-либо физическом процессе.
Более точным будет следующее утверждение: вероятность обнаружения электрона в некотором малом объеме ΔV выражается произведением ψ2ΔV. Таким образом, сама величина ψ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства.
Квантовые числа
Для электрона, находящегося под действием сил притяжения к ядру, уравнение Шредингера имеет решения не при любых, а только при определённых значениях энергии. Решением этого уравнения являются 3 квантовых числа (n, l, m).
Энергия электрона в реальном атоме квантована.
Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа n, которое может принимать положительные целочисленные значения: 1, 2, 3, … и т.д. Наименьшей энергией электрон обладает при n = 1; с увеличением n энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определённым значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при n = 1 электрон находится на первом энергетическом уровне, при n = 2 на втором и т.д.
Главное квантовое число определяет и размеры электронного облака. Для энергетических уровней электрона в атоме (т.е. для электронных слоёв или оболочек), соответствующих различным значениям n, были приняты следующие буквенные обозначения:
Главное квантовое число n 1 2 3 4 5 6 7
Обозначение энергетического уровня K L M N O P Q
Не только энергия электрона в атоме не может быть произвольной. Произвольной не может быть и форма электронного облака. Она определяется орбитальным (побочное) квантовым числом l, которое можетпринимать значения от 0 до (n – 1), где n – главное квантовое число. Различным значениям n отвечает разное число возможных значений l. Так, при n = 1 возможно только одно значение орбитального квантового числа l = 0, при n = 2 l может быть равно 0, 1, при n = 3 возможны значения l = 0, 1, 2.
Состояния электрона, характеризующиеся различными значениями l, принято называть энергетическими подуровнями электрона в атоме. Этим подуровням присвоены следующие буквенные обозначения:
Орбитальное квантовое число l 0 1 2 3
Обозначение энергетического подуровня s p d f
Из уравнения Шредингера также следует, что и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного (азимутального) квантового числа m.
Магнитное квантовое число может принимать любые целочисленные значения, как положительные, так и отрицательные, в пределах от +l до –l через нуль. Так, для s-подуровня (l = 0) возможно только одно значение m = 0; для р-электронов (l = 1) возможны m = 1, 0,–1; при l = 2 (d-подуровень) возможны пять различных значений m = 2, 1, 0,–1,–2.
Состояние электрона в атоме, характеризующееся определёнными значениями квантовых чисел n, l, m, т.е. определёнными размерами, формой и ориентацией в пространстве электронного облака, получило название атомной электронной орбиталью.
Электронные подоболочки обозначают по типам соответствующих им линий в атомных спектрах:
s-подоболочка названа по «резкой» s-линии – sharp;
p-подоболочка названа по «главной» p-линии – principal;
d-подоболочка названа по «диффузной» d-линии – diffuse;
f-подоболочка названа по «фундаментальной» f-линии – fundamental.
Исследования атомных спектров привели к выводу, что, помимо квантовых чисел n, l, m, электрон характеризуется ещё одной квантовой величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина: спин обозначают буквой s. Спин электрона может иметь только два значения: +½ и – ½.
Четыре квантовых числа – n, l, m, s – полностью определяют состояние электрона в атоме.
Принципы заполнения атомных орбиталей электронами
Число электронов в атоме химического элемента определяется зарядом ядра, который равен порядковому номеру этого элемента в периодической системе Д.И.Менделеева. Распределение электронов в атомах подчиняется трём основным принципам.
1. Принцип минимума энергии. Электроны в невозбуждённом атоме распределяются по энергетическим уровням и подуровням так, чтобы их суммарная энергия была минимальна. Энергия электрона в атоме в основном определяется главным и орбитальным квантовыми числами, поэтому сначала заполняются те подуровни, для которых сумма (n+l) является наименьшей (правило В.М.Клечковского). В соответствии с этим в многоэлектронном атоме наблюдается следующая последовательность: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 6p. Эту последовательность можно представить в краткой форме: Еns < E (n – 1)d ≈ E(n - 2)f < Enp
2. Принцип Паули. В атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел.
3. Правило Гунда. В невозбуждённых атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при этом суммарный спин максимален.
Основные характеристики атомов элементов
1. Радиус атома. Размер атома не может быть определён точно, т.к. электронные орбитали атомов не имеют строго ограниченных контуров. Следовательно, речь может идти не об абсолютных размерах атомов, а только о размерах этих частиц в кристаллах и молекулах, т.е. об эффективных радиусах (rат). Эффективные радиусы атомов периодически изменяются в зависимости от заряда их ядра и числа электронов. В периоде с возрастанием заряда ядра атомные радиусы уменьшаются вследствие увеличения сил взаимодействия электронов и ядром. В группах атомные радиусы элементов, как правило. Возрастают сверху вниз, т.к. увеличивается число электронных слоёв в атомах элементов.
Орбитальный радиус несвязанного атома рассчитывается квантово-химическими методами как расстояние от его ядра до максимума электронной плотности, относящегося к последней занятой электронной орбитали.
В группах для однотипных элементов при движении сверху вниз наблюдается закономерный рост орбитальных радиусов, что связано с увеличением числа электронных оболочек. В периодах при движении слева направо прослеживается, как правило, уменьшение орбитальных радиусов.
Отклонение от такого закономерного уменьшения орбитальных радиусов наблюдается, например, при переходе от Mg к Al и объясняется тем, что последний электрон в атоме Al уже занимает 3 p -орбиталь, а это способствует увеличению орбитального радиуса. Аналогичное возрастание орбитального радиуса атома по той же причине происходит и при переходе от Zn к Ga. Приводимые ниже радиусы связанных атомов (атомные, металлические) найдены путем деления пополам кратчайших межатомных расстояний в кристаллических структурах простых веществ с координационным числом 12. При других значениях координационные числа в соответствующие данные внесены необходимые поправки. Обратим внимание, что в кристалле радиус атома гелия намного больше аналогичного для атома водорода. Объяснить это можно, если принять во внимание запрет на перекрывание атомных орбиталей для атомов гелия и отсутствие такого запрета для атомов водорода.
На рисунке 1. сопоставлены орбитальные и атомные радиусы атомов.

|
| Рис. 1. Графическое сравнение орбитальных (пунктир) и атомных (точки) радиусов атомов |
2. Энергия ионизации. Еи – это энергия отрыва электрона от атома элемента с образованием катиона: Э – ē → Э+ (кДж/моль). В периоде наибольшую Еи имеют элементы IA группы (щелочные металлы), т.к. в атомах этих элементов на внешнем энергетическом уровне находится 1 электрон, который значительно удалён от ядра. Поэтому характерной особенностью щелочных металлов является склонность к отдаче электронов (металлические свойства). В пределах каждой группы А энергия ионизации уменьшается сверху вниз, что свидетельствует о большем взаимодействии между ядром и электронами. В группах Б (d-элементы), за исключением IIIБ, изменение энергии ионизации носит обратный характер – она увеличивается сверху вниз.
Различают первую, вторую, третью и т. д. энергии ионизации атома. Первая энергия ионизации – это минимальная энергия, необходимая для удаления первого электрона из основного состояния атома. Вторая энергия ионизации – минимальная энергия, необходимая для удаления второго электрона из основного состояния однозарядного катиона. Аналогично определяются третья и последующие энергии ионизации атома. Очевидно, что для удаления второго электрона необходимо затратить больше энергии, чем для удаления первого электрона. Этот факт объясняется тем, что второй электрон приходится удалять уже из однозарядного катиона. Рассмотрим первые энергии ионизации для некоторых элементов периодической системы Д.И.Менделеева (таблица 3).
Таблица 3 Первые энергии ионизации некоторых атомов, МДж/моль
| Периоды | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 1,31 | He 2,37 | |||||||
| Li 0,52 | Be 0,90 | B 0,80 | C 1,09 | N 1,40 | O 1,31 | F 1,68 | Ne 2,08 | |
| Na 0,49 | Mg 0,74 | Al 0,58 | Si 0,79 | P 1,01 | S 1,00 | Cl 1,25 | Ar 1,52 | |
| K 0,42 | Ca 0,59 | Sc 0,63 | Ti 0,66 | V 0,65 | Cr 0,65 | Mn 0,72 | Fe 0,76 Co 0,76 Ni 0,74 | |
| Cu 0,74 Rb 0,40 | Zn 0,91 Sr 0,55 | Ga 0,58 | Ge 0,76 | As 0,94 | Se 0,94 | Br 1,14 | Kr 1,35 |
Анализ первых энергий ионизации атомов показывает, что в целом наблюдается закономерность роста этих величин в периодической таблице при движении слева направо и снизу вверх. Имеются и объяснимые исключения. Например, энергия ионизации атома Be (0,90) выше аналогичной характеристики атома B (0,80). Этот факт легко объяснить, если принять во внимание, что третий электрон во втором электронном слое атома В помещается уже на 2 р -орбиталь. Здесь сказывается взаимное отталкивание этого электрона и находящихся в предыдущем электронном подслое. Аналогичное исключение наблюдается и при переходе от Mg к Al.
На рисунке 2 графически представлены первые энергии ионизации атомов первых 36 элементов периодической системы Д.И.Менделеева.
3. Энергия сродства к электрону. Еср – это энергия присоединения электрона к электронейтральному атому элемента с образованием аниона:
Э + ē → Э– (кДж/моль).
Она возрастает у элементов в пределах периода слева направо, достигая максимума у галогенов. У элементов группы А сверху вниз наблюдается уменьшение энергии сродства вследствие существенного увеличения радиуса. У элементов группы Б наобарот.
При анализе данных в таблицы 4 можно заметить как положительные, так и отрицательные значения сродства атомов к электрону. Отрицательные значения сродства показывают, что для присоединения еще одного электрона к атому энергию необходимо затратить.
Таблица 4 Сродство атомов к электрону, кДж/моль
| Периоды | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 73 | He < 0 | |||||||
| Li 16 | Be < 0 | B 27 | C 122 | N < 0 | O 141 | F 328 | Ne < 0 | |
| Na 53 | Mg < 0 | Al 43 | Si 134 | P 72 | S 200 | Cl 328 | Ar < 0 | |
| K 48 | Ca < 0 | Sc 18 | Ti 8 | V 51 | Cr 64 | Mn < 0 | Fe 16 Co 64 Ni 112 | |
| Cu 119 Rb 47 | Zn < 0 Sr < 0 | Ga 30 | Ge 107 | As 78 | Se 195 | Br 325 | Kr < 0 |
4. Относительная электроотрицательность (ОЭО). Это величина, характеризующая относительную способность атома элемента притягивать к себе общие электроны в молекуле. За единицу принята ЭО атома лития, у фтора этот показатель равен 4. у элементов в пределах периода с увеличение заряда ядра наблюдается увеличение ЭО. В соответствии с этим элементы становятся всё более слабыми восстановителями и всё более сильными окислителями. Внутри группы ЭО элементов уменьшается сверху вниз.
Химическая связь
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Основным условием образования химической связи является понижение общей энергии Е многоатомной системы по сравнению с энергией изолированных атомов, т.е.
А + В → АВ
атом атом молекула
ЕАВ < EA + EB
Различают 3 типа химической связи: ковалентная, ионная и металлическая.
Соединения с металлической связью имеют два важных отличия от ионно-ковалентных соединений:
1. Высокая электро- и теплопроводность,
2. Металлы – кристаллические вещества (исключение – ртуть).
Свойства химической связи
1. Энергия связи. Это та энергия, которая необходимая для её разрыва; она всегда больше нуля. Энергия разрыва равна по величине, но противоположна по знаку энергии образования. Наиболее прочная связь в молекулах N2 (945.3 кДж/моль) и СО (1070.0 кДж/моль). Самая слабая связь между атомами азота в N2O3 (40.6 кДж/моль).
Экспериментально энергия разрыва определяется по закону Гесса.
2. Длина связи. Это расстояние между ядрами атомов, соединенных связью. Её можно экспериментально измерить с помощью рентгеноструктурного метода. Обычно длина ковалентной связи составляет 0.1 – 0.2 нм. Самая короткая связь в молекуле дейтеро водорода НD (0.074нм). Рекорд в длине связи принадлежит атомам гелия Не…Не – 6.2нм.
3. Кратность (порядок) связи. В различных теориях строения химической связи кратность определяют по-разному. В теории электронных пар Льюиса порядок связи – это число электронных пар, осуществляющих химическую связь. Порядок может быть целым и дробным. Так порядок связи в О2 равен 2, в молекулярном ионе О2- = 2.5, а в ионе О2+ = 1.5. Чем выше кратность связи, тем большее число электронов обеспечивает связь, и тем труднее её разорвать. Так, энергия тройной связи НС ≡ СН 962 кДж/моль, двойной связи Н2С = СН2 712кДж/моль и одинарной Н3С – СН3 369кДж/моль.
4. Полярность связи. Она показывает, насколько электронная плотность смещена к одному из атомов. Способность атома смещать к себе электронную плотность химической связи называется электроотрицательностью. Самые электроотрицательные элементы – активные неметаллы: F, O, N, Cl; самые электроположительные – щелочные металлы. Чем больше разность электроотрицательностей атомов, участвующих в химической связи, тем более полярна связь. Предельный случай полярной связи – ионная. Количественно величина полярности определяется дипольным моментом (μ), который равен произведению эффективного заряда на расстояние между атомами. μ = q × l. Единица измерения - дебай [D = 3.3 × 10-30 Кл × м]. Чем больше дипольный момент, тем более полярна молекула.
HCl HBr HI
μ, D 3.24 2.87 1.14
Дипольный момент уменьшается, т.к. уменьшается разница электроотрицательностей между атомами.
5. Угол связи. Это угол между воображаемыми прямыми, соединяющими центры атомов.
§ 8. Ковалентная связь
В 1927 году учёные Гейтлер и Лондон, рассматривая молекулу водорода сделали вывод о том, что связь образуется только в том случае, если спины электронов разнонаправлены. А связь, образованная за счёт общей пары электронов, получила название ковалентной.
Существует 2 метода описания связи:
1. МВС – метод валентных связей, предложен американскими учёными Слейтером и Полингом;
2. ММО – метод молекулярных орбиталей (Малликен).
Основные положения МВС:
1. Связь возникает между двумя атомами при обобществлении двух электронов с разными спинами или один из атомов предоставляет пару электронов с противоположными спинами, а другой – свободную орбиталь.
А↓ + В↑ → А↓↑В или А↑↓ + ٱВ → А↓↑В. Рассмотрим образование связи в молекуле СО
2. Связь возникает в том направлении, в котором перекрывание электронных облаков максимально.
3. Из двух орбиталей атома наиболее прочную связь образует та орбиталь, которая сильнее перекрывается орбиталью другого атома.
Свойства ковалентной связи в свете МВС.
1. Насыщаемость обусловлена тем, что в образовании связи принимает участие только определённое количество электронов, как правило, единичных.
2. Направленность – свойство ковалентной связи располагаться таким образом, чтобы обеспечить максимальное перекрывание электронных облаков. Различают 3 вида ковалентной связи:
σ – связь – образуется по линии, соединяющей центры атомов,

π – связь – возникает в направлении перпендикулярном линии соединяющей центры атомов, 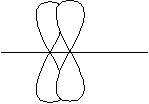
δ – связь образуют d-облака, находящиеся в параллельных плоскостях.

Направление связи обуславливает пространственную структуру (геометрическое строение) молекулы.
3. Поляризуемость связи. Все молекулы с разными элементами более или менее полярны. Электронная пара связи смещается к более электроотрицательному элементу. Условный заряд, возникающий на атомах при образовании связи, называется эффективным зарядом. Он устанавливается экспериментально. В молекуле НСl степень ионности составляет 18%. В молекуле NaCl ионная связь составляет 80%. Поэтому ковалентная связь подразделяется на ковалентную неполярную (частичный заряд δ ≈ 0) Н2, О2, F2; ковалентную полярную (δ ≠ 0) и, как крайний случай, при δ ≈ 1 – ионная. Т.к. ионная связь имеет свои особенности, этот тип химической связи выделяют.
Ионная связь
Ионная связь отличается от ковалентной полярной тем, что она ненаправлена и ненасыщаема.
Ионная связь осуществляется в результате электростатического притяжения противоположно заряженных частиц. Ионная связь не обладает направленностью, т.к. электростатическое поле иона имеет сферическую симметрию. Центральный ион не компенсируется одним ионом противоположного знака, т.е. его поле действует по всем направлениям, поэтому связь ненасыщаема.
Отсутствие этих свойств обуславливает склонность ионных молекул к ассоциации, т.е. к соединению друг с другом.
Гибридизация атомных орбиталей
Итак, как было отмечено в начале, молекула образуется лишь в том случае, когда общая энергия молекулы меньше, чем энергия отдельных атомов.
Учёные Слейтер и Полинг предложили концепцию о гибридизации. Согласно ей в образовании ковалентной связи участвуют не «чистые», а так называемые «гибридные», усреднённые по форме и размерам, а, следовательно, и по энергии, орбитали. Число таких орбиталей равно числу исходных орбиталей.
Гибридные орбитали вследствие особой симметрии в образовании π-связей участия не принимают.

Водородная связь
Водородная связь – это разновидность ковалентной связи, образованной по донорно-акцепторному механизму.
Если водород в соединении взаимодействует с сильно электроотрицательным элементом (F, O, N, S, Cl), то он может образовывать дополнительную связь с этим атомом.
Энергия водородной связи невелика 8…40 кДж/моль, поэтому она легко образуется и легко разрушается.
H … F H …O H … N
40 кДж/моль 20 кДж/моль 8 кДж/моль
С уменьшение электроотрицательности атома, энергия связи также уменьшается.
Так при образовании молекулы воды, ковалентная связь О – Н сильнополяризована за счёт электроотрицательности атома кислорода. Электронное облако связи смещено к кислороду, и вследствие этого, кислород приобретает эффективный отрицательный заряд –δ, а водород +δ, т.е. водород почти лишается электронного облака. Между Н одной молекулы и О другой молекулы возникает электростатическое притяжение и, как следствие, водородная связь.

Образуется молекула состава (Н2О)n.
Благодаря водородным связям температура плавления и кипения в таких соединениях значительно выше, чем у аналогичных соединений без водородных связей.
Водородная связь бывает двух видов:
1. Внутримолекулярная – связь, образованная между атомами одной молекулы

2. Межмолекулярная – между атомами разных молекул. За счёт таких связей удерживаются спирали белков, нуклеиновых кислот.
Метод молекулярных орбиталей.
Расчеты по методу валентных связей очень сложны. Кроме того, этот метод не рассматривает вклад неспаренных электронов в образование связи.
Для некоторых молекул в образовании хим. Связи определенную роль играют не электронные пары, а отдельные электроны. Это отчетливо видно на примере ионизированной молекулы водорода Н2+, которая получается при электронной бомбардировке молекулярного водорода. Спектральные исследования показывают, что расстояние между ядрами в этой частице составляет 108 нм, а энергия связи 2,65 эВ, т.е. это очень прочная молекула. Поскольку в Н2+ имеется только один электрон, то очевидно в данной молекуле осуществляется одноэлектронная связь.
Атом кислорода имеет 2 неспаренных электрона, поэтому на основании метода валентных связей можно было бы ожидать, что при соединении 2-х атомов кислорода появятся 2 электронные пары и неспаренных электронов в молекуле кислорода не будет. Однако исследование магнитных свойств кислорода свидетельствует о том, что в молекуле О2 имеются два неспаренных электрона.