12. Окислительно-восстановительные системы. Типы окислительно-восстановительных реакций.
13. Потенциал реакции. (Э.д.с. реакции). Направление протекания окислительно-восстановительных реакций. Влияние различных факторов на направление протекания окислительно-восстановительных реакций.
14. Использование окислительно-восстановительных реакций в аналитической химии.
15. Свойства d-элементов.
16. Современное содержание понятия комплексные соединения. Теория Вернера. Структура КС: центральный атом, лиганды, комплексный ион, внутренняя и внешняя сфера, координационное число центрального атома.
17. Способность атома различных элементов к комплексообразованию, природа химической связи в КС.
18. Образование и диссоциация КС в растворах, константы образования и нестойкости комплексов.
19. Химическая связь в комплексных соединениях. Метод валентных связей.
20. Классификация и номенклатура комплексных соединений.
21. Изомерия комплексных соединений.
22. Основные комплексные соединения d-элементов и их медико-биологическая роль. Хелатные и макроциклические комплексные соединения. Биологическая роль комплексных соединений.
23. Кислотно-основная классификация ионов.
24. Характерные реакции на катионы I – VI аналитических групп.
Занятие 12. Протолитическое равновесие в растворах электролитов. Протолитическая теория Бренстеда-Лоури. Расчет рН и рОН сильных и слабых электролитов. Ионное произведение воды. Гидролиз солей.
Контрольные вопросы.
1. Теория сильных электролитов. Ионная сила растворов электролитов. Активность электролитов и ионов. Коэффициент активности.
2. Применение закона действующих масс в аналитической химии.
3. Основные типы равновесий, применяемых в анализе. Константы равновесий для различного типа реакций.
4. Теории кислот и оснований (Аррениуса, Льюиса, Бренстеда-Лоури). Константы кислотности и основности.
5. Протолитическое равновесие. Протолитическая теория кислот и оснований.
6. Ионное произведение воды. рН водных растворов. Константа кислотности и основности.
7. Кислотно-основное равновесие в организме.
8. Протолитическое равновесие в водных растворах солей.
9. Расчет рН в растворах гидролизующихся солей. Степень и константа гидролиза.
КИСЛОТНО-ОСНОВНЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
В соответствии с протолитической теорией кислоты - это частицы, способные в растворе отдавать протоны, а основания - частицы, способные принимать их.
НА Û Н+ + А- В + Н+ Û BН+

Поведение кислот и оснований зависит от свойств растворителя. Основным растворителем, применяемым в практике анализа, является вода. В водных растворах следует учитывать амфотерный характер воды, описываемый реакцией автопротолиза
Н2O + Н2O Û Н3O+ + ОН-
Н2О ÛН+ +ОН- (в упрощённом виде)
Согласно закону действующих масс данное равновесие характеризуется константой автопротолиза (ионным произведением) воды Кw.
Кw = [H+][OH-]=10-14
В чистой воде [Н+] = [OH-] = 10-14 моль/дм3.
Для характеристики кислотности (основности) раствора принято пользоваться десятичными логарифмами молярной концентрации ионов Н+ и ОН-, взятыми с отрицательным знаком, называемыми водородным и гидроксидным показателями:
| рН = - lg [Н+] рОН = - lg [ОН-] |
| рН + рОН = 14 |
При более точных расчётах вычисляют рaH+ и рaOH- - величины, равные отрицательным десятичным логарифмам активности ионов Н+ и ОН - в растворе
рaH+ = - lg [аH+] = -lg (fH+ • СH+)
рaOH- = - lg [aOH-] = - lg (fOH- • СOH-)
Зная рН раствора, легко вычислить концентрации ионов водорода и гидроксид-ионов в растворе и наоборот.
Расчёт рН растворов сильных кислот и оснований.
Сильные кислоты и основания практически полностью диссоциируют на ионы (степень диссоциации равна 1 или 100%), поэтому:
А) в растворах кислот с концентрацией больше 1 · 10-6 моль/дм3
[Н*] = CHA • основность HA => рН =- lg[Н+]
Б) в растворах оснований с концентрацией больше 1 · 10-6моль/дм3
[ОН'] = СB кислотность B => рОН = - lg [ОН-] => рН = 14 - рОН
или [H+] = Кw /[ОН-] => рН= -lg[Н+]
В) в растворах кислот и оснований с концентрацией меньше 1 • 10 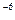 моль/дм
моль/дм  концентрации ионов водорода и гидроксид-ионов вычисляют по более сложным формулам с учетом диссоциации воды.
концентрации ионов водорода и гидроксид-ионов вычисляют по более сложным формулам с учетом диссоциации воды.
Примеры решения задач по расчёту рН растворов сильных кислот и оснований.
Пример 5. Вычислить рН 0,02 М раствора HCl. Без учета ионной силы.
Решение: 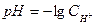 . В сильных кислотах
. В сильных кислотах 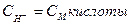

Пример 6. Вычислить рН 0,01 моль/дм3 раствора азотной кислотыбез учёта и - учётом ионной силы раствора.
Решение.
без учёта ионной силы раствора cоставляют уравнение диссоциации кислоты
НNО3 + H2O Û Н3O+ + NO3-
НNО3 - сильная кислота, поэтому [Н+] = СHNO3 = 0,01 моль/дм3, следовательно:
рН = - lg[Н+] = - lg 0,01 =-lg 10-2 = 2
2) с учётом ионной силы.


I = ½ (CH+ • Z2H+ + CNO3• Z2 NO3-) = ½(0,01 - 12 + 0,01 • 12) = 0,01
Находят по справочной таблице для данной ионной силы fH+ = 0,914 и рассчитывают активность ионов Н+
aH+ = fH+* CH+ = 0,914* 0,01 = 9,14*10-3 моль/дм3, тогда paH+ = - lg aH+=
- lg (9,14 • 10-3) = 3 – lg 9,14 = 3 - 0,961 = 2,039
Пример 7. Вычислить рН раствора, в 500 см которого содержится 2 г NaOH.
Решение.
Составляют уравнение диссоциации основания: NaOH Û Na+ + ОН -
Рассчитывают CM NaOH в растворе:
CNaOH = mNaOH • 1000 / MNaOH • VNaOH = 2*1000/40*500 = 0,1 моль/дм3
NaOH - сильное основание, поэтому [ОН-] = CNaOH = 0,1моль/дм3
Далее:
1) рОН=- lg[0Н-] = -lgО,1 = 1 Þ рН=14 – рОН = 14 - 1=13
или
2) [Н+] = Kw/ [ОН-] = 10-14:10-1 = 10-13 моль/дм3 Þ рН =-lg [Н+] = - lg10-13 = 13
Расчёт pH в растворах слабых (средних) кислот и оснований.
Слабые (и средние) электролиты в водных растворах диссоциируют не полностью, равновесие в этих растворах описывается с помощью констант диссоциации (ионизации):
КА - константы кислотности и КВ. - константы основности, которые связаны со степенью диссоциации (a) законом разбавления Оствальда:

|
Для электролитов, степень диссоциации которых меньше 5% при концентрации более 10 моль/дм  или Кд меньше 1*10-4 закон разбавления Оствальда выражается:
или Кд меньше 1*10-4 закон разбавления Оствальда выражается:

|
Расчёты рН в таком случае ведут по формулам:
Для слабой кислоты:
[Н+]= a • Cна =  Þ
рН =- lg Þ
рН =- lg 
|
Для слабого основания:
[OН-]= a • CB =  Þ
рОН =- lg Þ
рОН =- lg   Þ pH = 14 – pOH
или [Н+] = Kw/ [ОН-] Þ pH – lg[H+] Þ pH = 14 – pOH
или [Н+] = Kw/ [ОН-] Þ pH – lg[H+]
|
Примеры решения задач по расчёту рН растворов слабых кислот и оснований.
Пример 8. Вычислить рН 0,001 Н уксусной кислоты, если 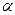 =0,13
=0,13
Решение: 

Пример 9. Определить:
А) рН 0,01н СН3СООН, если 
В) рН 0,01н NH4OH, если 
Решение: Представив уравнение 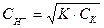 в логарифмической форме получим
в логарифмической форме получим 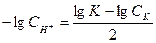 ,
,
таким образом для одноосновной кислоты 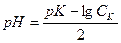
 , следовательно
, следовательно  , для слабого основания
, для слабого основания  ;
;
 , следовательно
, следовательно 
Пример 10. Концентрация ионов Н+ в растворе равна 2.10-4 моль/дм  . Вычислить концентрацию ОН -, рН и рОН в этом растворе.
. Вычислить концентрацию ОН -, рН и рОН в этом растворе.
Решение:
 ;
;


Пример 11. Вычислить рН раствора, в 500мл которого растворено 2г NaOH.
Решение:
РН=14-рСоснов; 
 ; рН = 14 – 1 = 13
; рН = 14 – 1 = 13
Пример 12. Рассчитать рН 0,01 моль/дм3 раствора аммиака, КNH3*Н2O = 1,76*10-5.
Решение.
В водном растворе аммиака имеет место равновесие
NH3 + Н2O Û NH4+ + ОН -
Поскольку раствор аммиака - слабое основание и KB < 1*10-4, то расчёт ведут следующим образом:
[OH-] = 
рОН = - lg [ОН-] = - lg 4,2 • 10-3 = 3- 0,623 = 2,38
pH = 14- рОН = 14 - 2,38 = 11,62
Пример 13. Степень диссоциации СН3СООН в 0,1 моль/дм3 растворе равна 1,32*10-3. Вычислить концентрации ионов Н+ и СНзСОO-, pH раствора и Кд кислоты.
Решение.
Записывают уравнение диссоциации уксусной кислоты
СН3СООН + Н2O Û Н3О+ + СН3СОО-
СН3СООН - слабая кислота, поэтому
[H=] = a*CH3COOH = 1,32*10-2*0,1 = 1,32*10-3 моль/дм3
pH = - lg [H+] = - lg 1,32 • 10 -3 = 3 - 0,12 = 2,88 [Н+] = [СН3СОО-] = 1,32*10-3 моль/дм3
Из закона разбавления Оствальда 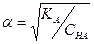 находят КСН3СООН:
находят КСН3СООН:
КСН3СООН = a2* ССН3СООН = (1.32*10-2)2 • 0,1 = 1,74 *10-5
Задачи:
Расчет концентрации ионов и ионной силы в растворах сильных электролитов
1. Считая диссоциацию полной, вычислить концентрации ионов:
А) К+ в 0,5М растворе K2SO4, K3PO4;
Б) Al3+ в 2М растворе Al2(SO4)3, AlCl3.
2. Вычислить ионную силу в растворах:
0,3 М хлорида бария, 0,06 М ортофосфата калия, 0,02 М сульфата алюминия.
Ответ: (0,9;0,36; 0,3)
3. Рассчитать ионную силу раствора, содержащего в 1 дм  0,01 моль сульфата натрия и 0,01 моль сульфатажелеза (III).
0,01 моль сульфата натрия и 0,01 моль сульфатажелеза (III).
Ответ: (0,18)
4. Рассчитать коэффициент активности и активность иона Сl- в 0,015 М растворе хлорида цинка.
Ответ: (0,82; 2,45•10  моль/дм3)
моль/дм3)
5. Вычислить активность ионов Na+,H+,SO42- в растворе с концентрацией 2•10  моль/дм3 сульфата натрия и 5•10
моль/дм3 сульфата натрия и 5•10  моль/дм3 серной кислоты.
моль/дм3 серной кислоты.
Ответ: (3,16*10  моль/дм3; 7,9х10
моль/дм3; 7,9х10  моль/дм3; 8,2*10
моль/дм3; 8,2*10  моль/дм3)
моль/дм3)
6. После растворения хлорида калия, сульфата магния и сульфата железа (III) в воде молярная концентрация этих солей равна соответственно: 0,05; 0,02 и 0,01 моль/дм3. Вычислить ионную силу раствора.
Расчет концентрации ионов, рН и РОН в растворах слабых электролитов:
7. Вычислить рН 0,01н раствора гидроокиси аммония, степень диссоциации которой равна 0,1.
8. Активная кислотность желудочного сока равна 0,047. Найти рН желудочного сока.
9. Найти рН молочной кислоты, константа диссоциации которой равна 1,44.10-4, С=0,01.
10.Вычислить рН раствора азотной кислоты, если массовая доля кислоты в растворе равна 4% ( ).
).
11.Вычислить концентрацию и число ионов водорода в крови объёмом 100мл,если рН крови=7,36.
12.К 99 мл воды добавили 1 мл 0,1н NaOH. Как изменилось значение рН? Ответ: 7-11
13. Вычислить концентрацию гидроксид-ионов при температуре 200С, если концентрация ионов водорода равна 2.10-4 г-ион/дм  ,
,  =0,69.10-14.
=0,69.10-14.
14.Вычислить рН и рОН 0,001 моль/дм3 раствора хлороводородной кислоты с учётом ионной силы раствора.
Ответ: (3,02; 0,99)
15.Сколько граммов гидроксида натрия потребуется для приготовления 500 см  раствора, рН которого 9?
раствора, рН которого 9?
(Ответ: 2,10 г)
16.Вычислить рН 0,02 моль/дм3 раствора серной кислоты, считая её диссоциацию на ионы полной. (Ответ: 1,40)
17 Рассчитать рН раствора гидроксида калия с массовой долей 0,19%. (12,53)
18 Вычислить активность гидроксид-ионов и ран+ в 0,01 моль/дм3 растворе гидроксида калия. (Ответ: 9*10 моль/дм3; 11,95)
19 Вычислить концентрации ионов водорода и гидроксид-ионов в растворе хлороводородной кислоты при рН 4.
(Ответ: 10 моль/дм3;10 моль/дм3)
20 Рассчитать рН 0,60%-ного раствора уксусной кислоты. (Ответ: 2,38)
21 Вычислить рН 0,1 моль/дм  раствора фенола, если KС6Н5OH = 1*10
раствора фенола, если KС6Н5OH = 1*10 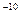 . (5,48)
. (5,48)
22 Чему равна степень диссоциации 0,01 моль/дм3 водного раствора уксусной кислоты, если КснзСООН = 1,76*10-5? (4,2 * 10 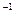 или 4,20%)
или 4,20%)
23 Вычислить рН 10%-ного раствора аммиака. Ответ: (11,71)
24 Найти концентрацию водородных ионов в 2М,0,5М и 0,2М растворе уксусной кислоты (Кд = 1,8 10-5).
АКТИВНОСТЬ И ИОННАЯ СИЛА РАСТВОРОВ ЭЛЕКТРОЛИТОВ.
Для оценки способности ионов сильных электролитов вступать в химические реакции введено понятие «активность».
Активность (а) - эффективная (кажущаяся) концентрация иона в водном растворе с учётом электростатического взаимодействия между ионами, соответственно которой он вступает в химические взаимодействия.
Мерой отклонения свойств реальных растворов от идеальных является коэффициент активности f - отношение активности (а) к истинной концентрации иона (С):
| fa = а/С |
В идеальных и близких к ним растворах межионное взаимодействие практически отсутствует. Для таких растворов f ® 1, а ® С.
Отклонение реальных растворов от идеальных зависит не только от концентрации ионов, но и от величины их заряда. Оба эти фактора учитывает величина, называемая ионной силой раствора (m, I) равная полусумме произведения молярной концентрации всех ионов в растворе на квадрат заряда каждого иона:
 
|
Единица измерения «а» и «С» - моль/дм  (моль/л), коэффициент активности и ионная сила раствора не имеют размерности.
(моль/л), коэффициент активности и ионная сила раствора не имеют размерности.
Для данной ионной силы коэффициенты активности ионов можно найти в справочной химической литературе или расчётным путем.
Для растворов с ионной силой 0,01 - 0,2 коэффициенты активности можно рассчитать по уравнению Дебая - Хюккеля:
 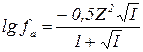
|
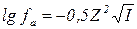
|
Для растворов с ионной силой 0,0005 - 0,01 коэффициенты активности вычисляют по формуле:
Если ионная сила раствора меньше 0,0005, коэффициенты активности близки к единице, и для расчета можно пользоваться не активностями, а молярными концентрациями ионов.
Примеры решения задач по определению активной