КРИВЫЕ ТИТРОВАНИЯ. ВЫБОР ИНДИКАТОРА
Для того чтобы наиболее точно зафиксировать точку эквивалентности данного титрования, необходимо выбрать такой индикатор, который резко меняет свою окраску при значении рН, максимально близком к эквивалентной точке. Поэтому необходимо предварительно изучить, как в различных случаях изменяется рН по мере течения процесса нейтрализации.
Изменение рН, происходящее по мере нейтрализации различных по степени диссоциации кислот и оснований, обычно изображают графически. Такие графики постепенного изменения рН при нейтрализации называют кривыми нейтрализации или кривыми титрования метода нейтрализации.
В качестве рабочих растворов в кислотно-основном методе обычно применяют сильные кислоты или сильные основания, поэтому возможны следующие три случая;
1) титрование сильной кислоты сильным основанием (и наоборот);
2) титрование слабой кислоты сильным основанием;
3) титрование слабого основания сильной кислотой. Мы рассмотрим все три случая.
1. Нейтрализация сильной кислоты сильным основанием.
Предположим, мы титруем 0,1 н. раствор НС1 0,1 н. раствором NaOH. В разбавленных растворах сильные основания и сильные кислоты можно считать полностью диссоциированными на ионы и концентрацию ионов Н+ принять численно равной общей концентрации кислоты. Таким образом, до начала нейтрализации взятый 0,1 н. раствор сильной кислоты будет иметь [Н+]=0,1=10-1 и рН=1.
Предположим, что нейтрализовано 90% кислоты, т. Е. осталось 10% ее первоначального содержания. Следовательно, количество кислоты уменьшилось в 10 раз. Для упрощения вычисления можно пренебречь увеличением общего объема раствора, так как допущенная при этом погрешность в вычислении рН будет настолько мала, что это не отразится на общем характере кривой нейтрализации. При уменьшении общей концентрации кислоты в 10 раз во столько же раз уменьшится концентрация ионов Н+, т. Е. [Н+] =0,01, рН=2.
После нейтрализации 99% кислоты общая ее концентрация уменьшится в 100 раз по сравнению с.первоначальной, следовательно [Н+]=0,001=10¯3, рН=З. После нейтрализации 99,9% кислоты [Н+]= 0,0001=10-4, рН=4.
Таблица 7.Изменение Н+ и рН при нейтрализации 0,1 и. раствора сильной кислоты
| Ход нейтрализации | [H+] | pН | Примечание Эквивалентное количество кислоты и щелочи. Раствор нейтральный |
| Нейтрализовано кислоты, % | |||
| 1*10-1 | 1,0 | ||
| 90,0 | 1*10-2 | 2,0 | |
| 99,0 | 1*10-3 | 3,0 | |
| 99,9 | 1*10-4 | 4,0 | |
| 100,0 | 1*10-7 | 7,0 | |
| Избыток щелочи, % | |||
| 0,1 | 10-¹º | ||
| 1,0 | 10-11 | ||
| 10,0 | 10-¹² | ||
| 100.0 | 10-¹³ |
Когда же будет нейтрализована вся кислота (100%), в растворе будет содержаться только соль NaCI, не подвергающаяся гидролизу, концентрация ионов Н+ и ОН- будет одинаковой и рН раствора будет равна 7. Точка эквивалентности совпадает с точкой нейтрализации (таблица 7).
Если и далее приливать щелочь к титруемому раствору, концентрация ионов ОН- будет увеличиваться в таком же порядке, как шло уменьшение концентрации ионов Н+. При добавлении 1% избытка щелочи [ОН¯]= 10-3, а [Н+]=10-11, рН=11. При добавлении 10% избытка гидроксида натрия [ОН¯]=10-2, [Н+]=10-12 и рН=12.
Если добавить 100% избытка щелочи, то концентрация NaOH в растворе будет 0,1 н., а концентрация ионов ОН-=10-1, [Н+]=10-14 : 10-¹ = 10-13 (см. табл.1).
Изменение рН раствора от количества прибавленного раствора при титровании можно выразить графически. В данном случае на кривой точка эквивалентности совпадает с точкой нейтральности, т. Е. лежит при рН 7,0. Следует заметить, что в начале титрования рН раствора изменяется медленно; в конце титрования происходит резкий скачок рН; после эквивалентной точки рН снова изменяется медленно. Таким образом, при нейтрализации 99,9% кислоты рН изменяется всего на 3 единицы (от 1,0 до 4,0), а переход от 0,1% избытка кислоты к 0,1% избытка щелочи изменяет рН раствора на 6 единиц (от 4,0 до 10,0). В конце титрования 1—2 капли щелочи понижают концентрацию ионов Н+ в растворе в миллион раз: от 10-4 до 10-10. Такое резкое изменение рН вблизи эквивалентной точки, т. Е. в конце титрования, называется скачком титрования.

Кривая нейтрализации 0,1 н. раствора НСl 0,1 н. раствором NaOH.
Титрование слабой кислоты сильной щелочью.
Возьмем 0,1 н. раствор слабой кислоты, например уксусной, и будем титровать его раствором сильного основания:
СНзСООН + NaOH ⇆ СНзСООNа + Н2О
Так как СНзСООН слабая кислота, для вычисления рН необходимо принимать во внимание не только ее концентрацию, но и степень диссоциации. По мере нейтрализации концентрация соли СНзСООNа будет повышаться. Эта соль, как сильный электролит, имеющий одинаковый ион со слабой кислотой, будет уменьшать ее диссоциацию. Вследствие этого [Н+] будет понижаться быстрее, чем это наблюдалось при нейтрализации сильной кислоты. Когда вся кислота будет нейтрализована, [Н+], а, следовательно, и рН раствора зависят практически от присутствия в растворе соли, подвергшейся гидролизу. Все это усложняет вычисления изменения рН при титровании. Здесь эти расчеты не приводятся.
Таблица 8. Изменение рН и [Н+] при нейтрализации 0,1 н. раствора уксусной кислоты
| Ход нейтрализации | [Н+] | Н | Примечание Нейтральная среда рН 7,0 Эквивалентное количество кислоты и щелочи |
| Нейтрализовано кислоты, % | |||
| 1,35.10-3 | 2, 87 | ||
| 10,0 | 1,60.10-4 | 3, 80 | |
| 50,0 | 1,80.10-4 | 4, 75 | |
| 90,0 | 2,00.10-6 | 5,70 | |
| 99,0 | 1,80.10-7 | 6,75 | |
| 99,9 | 1,80. 10-8 | 7,75 | |
| 100,0 | 1,35.10-9 | 8,87 | |
| Избыток щелочи, % | |||
| 0,1 | 10-¹º | 10,00 | |
| 1,0 | 10-¹¹ | 11,00 | |
| 10,0 | 10-¹² | 12,00 |
Когда нейтрализация кислоты закончится и к раствору начнут прибавлять избыток щелочи, рН раствора практически будет зависеть только от концентрации щелочи, так как в присутствии избытка ионов ОН- гидролиз соли будет подавлен, а потому ее присутствие практически не будет оказывать влияния на рН раствора. Таким образом, в данном случае прибавление к раствору избытка щелочи после достижения точки эквивалентности должно создать в растворе практически те же [Н4-] (и рН), которые имели место при прибавлении избытка щелочи в случае нейтрализации сильной кислоты. В табл. 2 приведены результаты вычисления рН и [Н+] в случае нейтрализации 0,1 н. уксусной кислоты 0,1 н. гидроксида натрия. Данные таблицы представлены также кривой.
Данные таблицы и кривая титрования позволяют сделать следующие выводы. Заметное изменение рН происходит с самого начала титрования. При рН 7,0 в растворе еще остается не нейтрализованная кислота. Точка нейтральности не совпадает с точкой эквивалентности. Скачок титрования составляет всего 2,25 единицы (от рН 7,75 до рН 10,0). Точка кривой, соответствующая моменту эквивалентности, находится около рН 9,0, т. Е. в щелочной области.

Кривая нейтрализации 0,1 н. раствора уксусной кислоты 0,1 н. раствором NaOH.
Титрование слабого основания сильной кислотой.
В качестве примера можно взять титрование раствора аммиака хлороводородной кислотой:
NH4OH + НСl ⇆ NH4Cl + Н2O
Таблица 9. Изменение рН и [Н+] при нейтрализации 0,1 н. раствора аммиака.
| Ход нейтрализации | [H+] | РН | Примечание Нейтральная среда (РН 7,0) Эквивалентное количество кислоты и щелочи |
| Нейтрализовано щелочи, % | |||
| 7,50.10-¹² | 11,13 | ||
| 50,0 | 5,55.10-10 | 9,25 | |
| 90,0 | 5,00. 10-9 | 8,30 | |
| 99,0 | 5,55.10-8 | 7,25 | |
| 99.9 | 5,55.10-7 | 6,25 | |
| 100,0 | 7,42.10-6 | 5,13 | |
| Избыток кислоты, % | |||
| 0,1 | 10-4 | 4,00 | |
| 10-³ | 3,00 | ||
| 10-2 | 2,00 |
Вычисление [Н+] и рН, которые будут иметь место на различных стадиях нейтрализации слабого основания сильной кислотой, производится аналогично вычислениям в случае нейтрализации слабых кислот сильным основанием. На величину рН влияет не только концентрация, но и степень диссоциации слабого основания. Образующаяся вследствие нейтрализации соль понижает степень диссоциации слабого основания. В точке эквивалентности рН раствора будет зависеть от присутствия соли, подвергшейся гидролизу. В табл.9 и на кривой титрования отображено изменение рН при этом титровании.
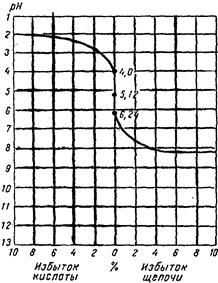
Кривая нейтрализации 0,1 и. раствора аммиака 0,1 н. раствором НСl.
Изменение окраски различных индикаторов происходит при самых разных рН, т. Е. показатели титрования различны у различных индикаторов. Наличие скачка титрования позволяет правильно выбрать индикатор. Для каждого отдельного случая нейтрализации необходимо подобрать такой индикатор, у которого показатель титрования лежит в пределах скачка рН па кривой титрования.
Так, скачок на кривой титрования сильной кислоты сильным основанием (и наоборот) находится в области pH от 4,0 до 10,0. В данном случае можно взять любой индикатор, который изменяет свою окраску при значениях рН в этом интервале: метиловый оранжевый (показатель титрования 4,0), метиловый красный (показатель титрования 5,5), фенолфталеин (показатель титрования 9,0).
В случае применения метилового оранжевого раствор немного не дотитровывается, а в случае фенолфталеина немного перетитровывается. Однако ошибка в том и другом случае незначительна и не превышает объема капли (0,03 мл). Такой ошибкой можно пренебречь.
Все вышеуказанные индикаторы можно использовать при титровании растворов, концентрация которых не ниже 0,1 н. При титровании 0,01 н. растворов НСl 0,01 н. раствором NaOH скачок на кривой титрования лежит в пределах рН от 5,0 до 9,0. Очевидно, в этом случае индикатор метиловый оранжевый применять нельзя.
При титровании 0,1 н. уксусной кислоты щелочью применимы индикаторы, точки перехода которых лежат в пределах рН от 7,73 до 10,0, т. Е. из перечисленных индикаторов можно применять фенолфталеин.
В случае титрования раствора аммиака сильной кислотой можно применять метиловый оранжевый и метиловый красный, так как скачок на кривой титрования лежит в пределах рН от 4,0 до 6,24.
Задачи:
1. Рассчитайте, какой объем хлороводородной кислоты с плотностью 1,170 г/мл потребуется для приготовления 200 мл раствора с концентрацией HCl 0,05 моль/л.
2. Для стандартизации раствора KOH было взято 0,02г H2C2O4 2H2O. На титрование пошло 15 мл раствора КОН. Чему равна концентрация титранта?
3. Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,5 мл этой кислоты. Ответ: 0,1264М, 0,004608 г/мл.
4. Для определения молярной концентрации эквивалента H2SO4 к 10,0 мл ее добавили избыток BaCl2. Масса полученного осадка BaSO4 после фильтрования, прокаливания и взвешивания составила 0,2762г. Вычислить молярную концентрацию эквивалента раствора H2SO4 (f = ½) и его титр. Ответ: 0,01161 г/мл.
5. Навеску Н2С2О4 2Н2О массой 0,6000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,34 мл NaOH.
6. Определить молярную концентрацию раствора NaOH и его титр по Н2С2О4. Ответ: 0,1038М; 0,004673 г/мл.
7. Определить Т(КОН/Р2О5) раствора гидроксида калия, используемого при определении Р2О5 в суперфосфате, если на титрование 18,00 мл 0,1М раствора HCl (K=0,9064) израсходовано 19,32 мл КОН (Н3РО4 титруется до КН2РО4). Ответ: 0,05993 г/мл.
8. Навеску щелочи массой 0,5341г, содержащей 92,00% NaOH и 8% растворили в колбе вместимостью 100,00 мл. Определить молярную концентрацию кислоты, T(HCl/NaOH), если на титрование 15,00 мл раствора NaOH израсходовали 19,50 мл кислоты.
9. Определить молярную концентрацию раствора КОН, если на титрование 15,00 мл его израсходовали 18,70 мл раствора HCl (T(HCl) = 0,002864): Ответ: 0,09792 моль/л.
10. До какого объема нужно довести раствор, в котором содержится 1,532 г NaOH, чтобы на титрование его аликвоты в 20,00 мл израсходовать 14,70 мл HCl (THCl = 0,003800). Ответ: 500 мл.
11. Вычислить концентрацию N2O5 в г/л раствора HNO3, если на титрование 20,00 мл раствора кислоты израсходовано 21,12 мл 0,1120М NaOH. Ответ: 6б387 г/л.
12. На титрование раствора, полученного из навески щавелевой кислоты массой 0,1371 г, израсходовано 22,10 мл 0,09842М NaOH. Сколько молекул кристаллизационной воды содержалось в исходном препарате кислоты?
13. На титрование раствора, полученного из навески щавелевой кислоты массой 0,1371г, израсходовано 22,10 мл 0,09842М NaOH. Сколько молекул кристаллизационной воды содержалось в исходном препарате кислоты? Ответ: 2,0.
14. Какую массу вещества, содержащего 90% Na2CO3 и индифферентные примеси, нужно взять, чтобы на ее титрование с метиловым оранжевым израсходовать 20,00 мл 0,1М HCl? Ответ: 0,12 г.
Лабораторная работа.
Стандартизация раствора хлороводородной кислоты.
Цель работы: Научиться определять концентрацию титранта с применением метод прямого титрования и проводить расчеты с использованием закона эквивалентов.
Оборудование и реактивы:
1. Бюретка вместимостью 25 мл, закрепленная в штативе;
2. Воронка;
3. Пипетки Мора вместимостью 5 мл;
4. Колбы конические вместимостью 100 мл;
5. Стаканчик для слива;
6. Титрованный раствор тетрабората натрия;
7. Индикатор метиловый оранжевый;
8. Раствор хлористоводородной кислоты, приготовленный в предыдущей работе.
Ход работы.
1. Готовят бюретку к работе. Для этого выливают из бюретки дистиллированную воду, ополаскивают ее изнутри приготовленным HCl и заполняют до нулевой отметки. Следят за тем, чтобы в кончике бюретки не было пузырьков воздуха.
2. В коническую колбу для титрования пипеткой переносят 5 мл раствора тетрабората натрия, соблюдая все правила работы с пипеткой. В каждую колбу добавляют по 1 капле раствора метилоранжа.
3. Титруют раствор тетрабората натрия раствором хлористоводородной кислоты. Для этого из бюретки добавляют небольшие порции титранта, постоянно перемешивая содержимое колбы. Колбу держат в правой руке за её верхнюю часть и постоянно перемешивают содержимое кругообразными движениями, не встряхивая колбу. Левой рукой приливают титрант из бюретки. Титрование заканчивают, когда заметное изменение окраски происходит от одной капли добавляемого титранта. Результаты титрования записывают в таблицу (с точностью до 0,05 – 0,1 мл)
4. Титрование проводят три раза. При этом расхождение между параллельными результатами не должно превышать 0,1 мл. Если это расхождение велико, то титрование повторяют еще 2-3 раза до получения допустимого расхождения.
5. Результаты титрования заносят в таблицу.
| №п/п | V(Na2B4O7) | N(Na2B4O7) | V(HCl) | Средний V(HCl) | N(HCl) |
Определение щелочи и карбонатов в растворе при совместном присутствии.
Цель работы: Овладеть методом титрования с двумя индикаторами.
Оборудование и реактивы:
1. Бюретка вместимостью 25 мл, закрепленная в штативе;
2. Воронка;
3. Пипетки Мора вместимостью 5 мл;
4. Колбы конические вместимостью 100 мл;
5. Стаканчик для слива;
6. Титрованный раствор хлороводородной кислоты.
7. Индикаторы: метиловый оранжевый и фенолфталеин.
Ход работы:
1. Готовят бюретку к работе так же, как в работе 2.
2. С помощью пипетки Мора вместимостью 5 мл отбирают пробы (аликвоты) в колбу для титрования. Добавляют 2 капли фенолфталеина.
3. Титруют раствором HCl, так же, как в предыдущей работе. Сначала титруют до исчезновения розовой окраски. Записывают в таблицу объем кислоты, затраченный на титрование пробы с фенолфталеином, затем в ту же колбу добавляют одну каплю метилоранжа и титруют до перехода окраски из желтой в оранжевую. Записывают в таблицу общий объем кислоты, затраченный на титрование пробы с метилоранжем и с фенолфталеином. Титрование проводят до получения трех близких результатов.
4. Рассчитывают массу гидроксида натрия и карбоната натрия в контрольной задаче.
Объем раствора кислоты, затраченный на первое титрование (V1) эквивалентен содержащейся в растворе щелочи и половине карбоната, так как последний присоединяет один ион водорода. Объем кислоты, затраченный на второе титрование (V2), эквивалентен половине карбоната, так как при этом титровании идет реакция присоединения второго иона водорода. На взаимодействие с карбонатом по каждой реакции затрачиваются равные количества кислоты. Поэтому всего на титрование карбоната идет 2V2 мл кислоты. Остальная кислота, т.е. (V1 – V2) мл идет на нейтрализацию щелочи. По объему затраченной кислоты рассчитывают нормальность анализируемого раствора по каждому веществу.
 | |||
| |||
NaOH
(V1-V2)
| |||
 | |||
|

 (2V2)
(2V2)
| |||
 | |||
V1=A1 по фенолфталеину
V2 = (A2-A1) по метиловому оранжевому
В основе анализа лежат следующие реакции:
OH¯ + H+ → H2O (1)
CO32- + H+ → HCO3ˉ (2)
HCO3ˉ + H+ → H2CO3 (3)
Объем раствора кислоты, затраченный на первое титровнаие (V1) эквивалентен содержащейся в растворе щелочи и половине карбоната, так как последний присоединяет один ион водорода. Объем кислоты, затраченный на второе титрование (V2), эквивалентен половине карбоната, так как при этом титровании идет реакция присоединения второго иона водорода. На взаимодействие с карбонатом по каждой реакции затрачиваются равные количества кислоты. Поэтому всего на титрование карбоната идет 2V2 мл кислоты. Остальная кислота, т.е. (V1 - V2) мл идет на нейтрализацию щелочи. По объемам затраченной кислоты рассчитывают нормальность анализируемого раствора по каждому веществу.
Для этого используют формулу (2)
Для перехода от количества вещества к его массе в граммах используют соотношение:
CM = 
Результаты титрования заносят в таблицу:
| № | С (HCl) | Объем анализируемого раствора | Объем титранта, HCl, мл | |||
| V1 | V2 | 2V2 | V1 - V2 | |||
Занятие 15 - 16.Окислительно – восстановительное титрование.
Контрольные вопросы.
1 Окислительно-восстановительное титрование. Сущность метода.
2 Классификация редокс-методов.
3 Требования, предъявляемые к реакциям.
4 Виды окислительно-восстановительного титрования (прямое, обратное, заместительное) и расчеты результатов титрования.
5 Перманганатометрическое титрование.Сущность метода. Условия проведения титрования. Титрант, его приготовление, стандартизация. Установление конечной точки титрования.
6 Реакции перманганата в различных средах (рН).
7 Применение перманганатометрии в биологии и медицине
8.Иодометрическое титрование. Сущность метода. Титрант, его приготовление, стандартизация, его приготовление, стандартизация, хранение. Условия проведения титрования, определение конечной точки титрования.
9 Применение иодометрии в биологии и медицине.
Перманганатометрия.
В основе метода лежит окисление восстановителей перманганатом калия КmnO4. Окисление восстановителей можно проводить в различных средах, причем, марганец (YII) восстанавливается в кислой среде до ионов Mn(IY) и в щелочной - до Mn(YI).
Обычно в методе перманганатометрии проводят реакцию в кислой среде. Индикатором служит сам KmnO4, окрашенный в красно-фиолетовый цвет. Конец реакции легко определяется по изменению окраски от одной избыточной капли KmnO4.
MnO4- + 8Н+ + 5е → Mn2+ + 4H2O
Красно-фиолетовый бесцветный
Большим недостатком окислительно-восстановительных реакций является их небольшая скорость, что затрудняет процесс титрования. Для ускорения медленно идущих реакций применяют нагревание. Как правило, с повышением температуры на каждые 10о, скорость реакции увеличивается в 2-4 раза.
В качестве примера можно привести реакцию окисления перманганатом щавелевой кислоты, протекающую при температуре 70-80оС.
5C2O42- + 2MnO4- + 16H+ → 2Mn2+ + 10CO2 + 8H2O
На скорость реакции может оказывать влияние введении в раствор катализатора. При титровании применяют положительные катализаторы, ускоряющие реакцию и отрицательные катализаторы – ингибиторы, замедляющие реакцию.
Реакцию окисления перманганатом щавелевой кислоты можно каталитически ускорить прибавлением MnSO4. В перманганатометрии одним из продуктов реакции окисления щавелевой кислоты являются ионы Mn2+, которые по мере образования в растворе ускоряют реакцию. Такие реакции называются автокаталитическими.
По мере образования ионов Mn2+, играющих роль катализатора, реакция ускоряется. По достижении точки эквивалентности избыточная капля KmnO4 окрасит раствор в бледно-розовый цвет, не исчезающий 1-2 минуты. Объем KmnO4 затраченный на титрование отмечают по верхнему мениску. Титрование повторяют 3 раза и после этого рассчитывается нормальность и титр KmnO4.
Задачи:
1. Укажите, какие из указанных веществ могут проявлять окислительно-восстановительную двойственность: KI, Cl2, Na2SO3, H2O2, K2Cr2O7, H2S, SO2.
2. Расставьте коэффициенты в уравнениях следующих реакций:
KNO2 + KmnO4 + HCl = MnCl2 + KNO3 + KCl + H2O
I2 + MnO2 + H2SO4 ---- MnSO4 + HIO4 + H2O
I2 + Cl2 + H2O --- HIO3 + HCl
PbO2 + MnSO4 + HNO3 ---- HmnO4 + Pb(NO3)2 + PbSO4 + H2O
KclO3 + KI + HCl ----- I2 + KCl + H2O
KclO3 + CrCl3 + KOH ------ KCl + K2СrO4 + H2O
K2Cr2O7 + HCl ---- CrCl3 + Cl2 + KCl + H2O
KBr + KmnO4 + H2SO4 ------ MnSO4 + Br2 + K2SO4 + H2O
3. Закончите уравнения реакций и расставьте коэффициенты:
Zn + H2SO4 ------ S +...
Mg + HNO3 ------- N2O +
KI + KmnO4 + H2SO4 ------ MnSO4 +...
H2S + KmnO4 + H2SO4 + ----- MnSO4 +...
FeO + HNO3 ---- NO2 +...
Br2 + KNO2 + KOH ----- KNO3 +...
4. Навеска 1,2540г Н2С2О4 2Н2О (х.ч.) растворена в мерной колбе на 200мл. На титрование 20,00 мл этого раствора расходуется 22,40 мл раствора KmnO4.
Найти: а) NKmnO4; б) T KmnO4/FeSO4 Ответ: а) 0,08386 н б) 0,00290
5. К раствору, содержащему 0,1510г технического КclO3 прилили 100,0 мл 0,09852н Na2C2O4, избыток которого оттитровали 48,6 мл 0,05320 н раствора KmnO4. Вычислить процентное содержание KclO3 в образце. Ответ: 98,22%
6. К раствору KclO3 прибавили 50,00 мл 0,1048н FeSO4, избыток которого оттитровали 20,00 мл 0,09450н KmnO4. Сколько граммов KclO3 содержалось в растворе? Ответ: 0,06843г.
7. Какую навеску Na2C2O4 требуется взять, чтобы на титрование ее шло 20 мл 0,1N раствора KmnO4. На титрование навески 0,1133г химически чистого Na2C2O4 в кислой среде пошло 20,75 мл раствора KmnO4. Найти: а) нормальность этого раствора; б) его титр по железу.
8. К 0,229г тщательно измельченной пробы MnO2 добавлено 0,1617г безводной щавелевой кислоты. Содержимое колбы полностью растворено нагреванием на водяной бане. На титрование избытка щавелевой кислоты израсходовано 8,80 мл 0,0500н раствора KmnO4. Вычислить %-ное содержание оксида марганца в исследуемом образце. Ответ: 60,48%
9. Навеска NaNO2 равная 1,6900г растворена в мерной колбе емкостью 200 мл. К 20 мл этого раствора прилили 30,0 мл подкисленного 0,100н раствора KmnO4. Избыток KmnO4 связан с 10 мл 0,050н раствора Н2С2О4. Непрореагировавшая Н2С2О4 оттитрована 5,5 мл 0,100н раствора KmnO4. Рассчитать количество NaNO2 в образце нитрита. Ответ: 62,26%
10. На титрование 2,5 мл точно 0,1N раствора щавелевой кислоты израсходовано 27,5 мл KmnO4. Рассчитайте нормальность перманаганата калия.
11. На титрование 20,00 мл Н2С2О4 (ТH2С2О4 2Н2О = 0,006900) израсходовано 25,00 мл раствора KmnO4. Рассчитать нормальность и титр раствора KmnO4.
12. Навеску 5,0000 г Н2О2 растворили в мерной колбе вместимостью 500 мл. На титрование 25,00 мл раствора израсходовали 37,43 мл 0,1 н раствора KmnO4. Вычислить процентное содержание Н2О2 в образце.
13. К навеске в 1,5000 г технического Na2SO3 после растворения прибавили 100,0 мл 0,1н раствора I2. На титрование избытка I2 израсходовали 40,00 мл раствора, в 200 мл которого содержится 2,4820г Na2S2O3. Определить процентное содержание Na2SO3 в образце. Ответ: 33,6 %
14. Навеска 1,2500г оксалата натрия (х.ч.) растворена в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора расходуется 21,20 мл устанавливаемого раствора перманганата калия. Определить: а) NKmnO4; б) T KmnO4; в) T KmnO4/Fe. Ответ: а) 0.08800н; б) 0.8800 к 0.1н; в) 0.002782
Пермангантометрия.
Лабораторная работа
УСТАНОВЛЕНИЕ ТОЧНОЙ КОНЦЕНТРАЦИИ И ТИТРА KmnO4 ПО 0,05N РАСТВОРУ ЩАВЕЛЕВОЙ КИСЛОТЫ
Точную концентрацию и титр KmnO4 устанавливают по щавелевой кислоте.
В основе процесса титрования лежит реакция между KmnO4 и Н2С2О4.2Н2О в кислой среде.
KmnO4 + H2SO4 + H2C2O4 ® MnSO4 + K2SO4 + CO2 + H2O
Ход определения
Бюретку промывают 2-3 раза небольшими порциями 0,05 н раствора KmnO4 и заполняют ее этим же раствором. Кончик бюретки должен быть полностью заполнен раствором перманганата. Пипетку вместимостью 5 мл ополаскивают раствором щавелевой кислоты, а затем вносят 5 мл раствора Н2С2О4 в коническую колбу для титрования. Добавляют 2 – 2,5 мл 2н раствора Н2SO4 и нагревают на водяной бане до 70 – 80оС, не допуская кипения раствора. Горячий раствор титруют перманганатом калия, добавляя его по каплям и непрерывно перемешивая. Следующую каплю добавляют после обесцвечивания в растворе предыдущей. Сначала обесцвечивание преманганата происходит медленно, а затем. по мере образования ионов Mn2+, играющих роль катализатора, реакция ускоряется. По достижении точки эквивалентности избыточная капля KmnO4 окрашивает раствор в бледно-розовый цвет, не исчезающий 1 – 2 минуты.
Объем KmnO4, затраченный на титрование отмечают по бюретке по верхнему мениску. Титрование повторяют 3 раза и данные заносят в таблицу 1. По данным титрования рассчитывают точную концентрацию и титр KmnO4.
Табл.1.
| N п/п | VH2C2O4 2H2O | NH2C2O4 2H2O | VKmnO4 | NKmnO4 | TKmnO4 |
| Сред-нее |
Расчет:
N KmnO4 = 
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА (II) МЕТОДОМ ПЕРМАНГАНАТОМЕТРИИ.
В основе определения лежит окислительно-восстановительная реакция, при которой ион Fe2+ окисляется в Fe3+. В кислой среде окисление протекает быстро по уравнению:
MnO4- + 5Fe2+ + 8H+ ® Mn2+ + 5Fe3+ + 4H2O
MnO4- + 5e + 8H+ ® Mn2+ + 4H2O 2
2Fe2+ - 2e ® 2Fe3+ 5
Исследуемый раствор подкисляют серной кислотой и титруют перманганатом калия до появления в растворе бледно-розовой окраски.
 Ход определения:
Ход определения:
В колбу для титрования вносят пипеткой Мора 5мл полученного раствора соли железа (II) и 2-3 мл раствора H2SO4 (1:4), затем титруют раствором перманганата калия KmnO4 до слабо-розовой окраски. Титрование повторяют 2-3 раза.
Вычисление результатов анализа:
V- Вычисление проводят, пользуясь выражением концентрации через титр по определяемому веществу.
TKmnO4/Fe = 
V- Рассчитывают, сколько граммов Fe (II) содержится в 5 мл раствора соли железа (II), взятого для титрования.
MFe = TKmnO4/Fe V1 KmnO4
V1 KmnO4 - объем раствора, пошедшего на титрование 5 мл соли железа (II).
3. Находят количество железа (II) в исследуемом растворе.
PFe = 
V2 - объем железа (II) приготовленного раствора, мл
Vа - объем аликвоты, взятой на титрование, мл
ОПРЕДЕЛЕНИЕ ПЕРЕКИСИ ВОДОРОДА В РАСТВОРЕ.
Перекись водорода в кислой среде окисляется перманганатом калия. Эквивалент перекиси водорода равен половине ее молекулярной массы:
2KmnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
ЭН2О2 = МН2О2/2 = 17
Анализируемый раствор перекиси водорода количественно переносят в мерную колбу, доливают до метки водой и тщательно перемешивают. Титрование и расчет проводят так же, как при определении железа в соли Мора.
Вычисление результатов анализа:
V- Вычисление проводят, пользуясь выражением концентрации через титр по определяемому веществу.
TKmnO4/Н2О2 = 
2. Рассчитывают, сколько граммов Н2О2 содержится в 5мл раствора перекиси водорода, взятой для титрования.
MН2О2 = TKmnO4/Н2О2 V1 KmnO4
V1 KmnO4 - объем раствора, пошедшего на титрование 5 мл перекиси водорода.
3. Находят количество перекиси водорода в исследуемом растворе.
PH2O2 = 
V2 - объем приготовленного раствора, мл
Vа - объем аликвоты, взятой на титрование, мл
Йодометрия.
Йодометрия основана на окислительно-восстановительных процессах, связанных с восстановлением I2 до 2I- -ионов или окислением их до I2. Свободный йод является слабым окислителем, а I- -ион – сильным восстановителем. Основная реакция при йодометрических определениях:
I2 + 2e → 2I-
Стандарный потенциал пара I2/2I- = + 0,54B. Кристаллы I2 мало растворимы в воде, поэтому их растворяют в растворе KI. При этом образуется комплексное соединение K[I3] по реакции:
I2 + I- ↔ [I3]-
Следовательно, основная реакция выражена уравнением:
[I3]- + 2e → 3I-
Метод йодометрии применяют для определения восстановителей путем окисления их раствором йода, окислителей, используя метод замещения, и сильных кислот на основе реакции:
IO3- + 5I- + 6H+ → 3I2 + 3H2O
В йодометрии применяют специфический индикатор – крахмал, весьма чувствительный к йоду, но не к йодид-ионам. В качестве стандартных растворов используют растворы йода и тиосульфата натрия (0,1; 0,05 и 0,02н растворы).
Растворы тиосульфата натрия готовят по точной навеске или из фиксанала. Хранят растворы а темных стеклянных банках. Проверку титра и нормальности тиосульфата натрия проводят не реже 1 раза в неделю.
Задания для самостоятельного выполнения:
1. К 25,00 мл раствора H2S прибавили 50,00 мл 0,01960 н раствора I2, избыток I2 оттитровали 11,00 мл 0,02040 н Na2SO3. Сколько граммов H2S содержалось в 1 литре исследуемого раствора? Ответ: 0,5150 г.
2. Определите процентное содержание сульфита натрия в техническом образце, если на навеску 0,1450г израсходовано при титровании 20,2 мл 0,1н раствора йода. Ответ: 87,7%
3. К 30 мл 0,11070н раствора KmnO4 прибавлена серная кислота и избыток иодида калия. На титрование выделившегося йода израсходовано 33,27 мл раствора тиосульфата натрия. Определить нормальность раствора тиосульфата натрия и титр его по йоду. Ответ: 0,09650н; 0,01225 г/мл.
4. Определить нормальность раствора тиосульфата натрия по раствору йода, приготовленному растворением 0,2982г в 250 мл раствора. На титрование 2,0 мл раствора тиосульфата натрия израсходовано 1,7 мл раствора йода. Ответ: 0,00798н
5. В основе определения мышьяковистого ангидрида методом йодометрии лежит реакция:
As2O3 + 2I2 + 5H2O = 2H3AsO4 + 4HI. Навеску пробы, содержащую As2O3, массой 1,24г растворили в мерной колбе вместимостью 250мл. На окисление 25 мл полученного раствора израсходовано 24,2 мл 0,098н раствора йода. Определить процентное содержание As2O3 в пробе. Ответ 94,3%
6. На титрование йода, выделенного 2 мл хлорной воды из KI, пошло 1,5 мл 0,0106н раствора Na2S2O3. Сколько грамм хлора содержится в 1 литре хлорной воды. Ответ: 0,2796г.
7. К 10,00 мл сероводородной воды прибавлено 50,00 мл раствора йода, на избыток которого потребовалось для титрования 32,79 мл раствора тиосульфата натрия. Вычислить