Едкие щелочи NaOH и КОН
образуют с ионами Pb2+ белый осадок Pb(OH)2, растворимый как в кислотах, так и в избытке щелочи:
Pb(OH)2 + 2H+ ® Pb2+ + 2H2O
Pb(OH)2 + 2OH 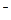 ® PbO22- + 2H2O
® PbO22- + 2H2O
В растворе аммиака осадок Pb(OH)2 нерастворим.
Выполнение реакции:
К 3-4 каплям раствора Pb(NO3)2 прибавить 1-2 капли раствора щелочи. Осадок взмутить, разделить на 3 части.
К I-ой части прибавить 2-3 капли 2М раствора HNO3.
К II-ой части 2-3 капли раствора щелочи.
К III-ей части 2-3 капли 2М раствора NH4OH.
Серная кислота H2SO4 осаждает ионы Pb2+ в виде белого осадка PbSO4.
Pb2+ + SO42- ® PbSO4¯
Осадок PbSO4 растворим в щелочах при нагревании.
Выполнение реакции:
К 2 каплям раствора Pb(NO3)2 прибавить 1-2 капли 1М раствора H2SO4. К осадку PbSO4 при нагревании и перемешивании прибавить по каплям 2М раствор NaOH до растворения осадка.
Действие хромата K2CrO4 и бихромата калия K2Cr2O7.
Хромат и бихромат калия образует с ионами Pb2+ малорастворимый хромат свинца желтого цвета:
Pb(NO3)2 + K2CrO4 == PbCrO4 ¯+ 2KNO3
2Pb(NO3)2 + K2Cr2O7 + H2O = 2PbCrO4 ¯+ 2HNO3 + 2KNO3
Выполнение реакции:
В 2 пробирки поместите по 2-3 капли раствора соли Pb(NO3)2. В одну пробирку добавьте 2-3 капли раствора соли K2CrO4, в другую 2-3 капли раствора соли K2Cr2O7. Обратите внимание на цвет выпавших осадков.
Условия реакции:
1. Реакции следует проводить при рН < 7.
2. В растворах едких щелочей осадок легче растворяется. В водном растворе аммиака и в СН3СООН осадок нерастворим совсем.
3. Реакции мешают катионы Ba2+, Hg2+, Hg22+, Ag+ и др.
Действие иодида калия KI.
Иодид калия дает с ионами Pb2+ желтый осадок PbI2.
Pb(NO3)2 + 2KI = PbI2 ¯+ 2KNO3
Выполнение реакции:
Внесите в пробирку 2-3 капли раствора соли Pb(NO3)2. Добавьте столько же раствора соли KI. Получив осадок, прибавьте в пробирку несколько капель воды и 2М раствора СН3СООН и нагрейте. При этом осадок растворяется, но при охлаждении под струей воды PbI2 снова выпадает в осадок в виде блестящих золотистых кристаллов. Эта характерная реакция является в то же время одной из наиболее красивых аналитических реакций.
Условия реакции:
1. Реакцию следует проводить при рН < 7.
2. Реакции мешают ионы Ag+, Hg2+, Hg22+, Bi3+, Cu2+.
Занятие 10.Химия d-элементов Комплексные соединения.
Контрольные вопросы.
1. Свойства d-элементов.
2. Современное содержание понятия комплексные соединения. Теория Вернера. Структура КС: центральный атом, лиганды, комплексный ион, внутренняя и внешняя сфера, координационное число центрального атома.
3. Способность атома различных элементов к комплексообразованию, природа химической связи в КС.
4. Образование и диссоциация КС в растворах, константы образования и нестойкости комплексов.
5. Химическая связь в комплексных соединениях. Метод валентных связей. Классификация и номенклатура комплексных соединений. Изомерия комплексных соединений.
6. Основные комплексные соединения d-элементов и их медико-биологическая роль. Хелатные и макроциклические комплексные соединения. Биологическая роль комплексных соединений.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Соединения, в которые входят комплексные соединения, способные существовать как в кристалле, так и в растворе, называются комплексными соединениями.
В молекуле комплексного соединения различают следующие структурные элементы: ион-комплексообразователь, координированные вокруг него присоединенные частицы - лиганды или адденды, составляющие вместе с комплексообразователем внутреннюю координационную сферу, и остальные частицы, входящие во внешнюю координационную сферу. При растворении комплексных соединений лиганды остаются в прочной связи с ионом-комплексообразователем, образуя почти не диссоциирующий комплексный ион, Число лигандов называется координационным числом.
Характерными комплексообразователями являются катионы
Fe2+, Fe3+, Co3+, Co2+, Cu2+, Ag+, Cr3+, Ni2+, Al3+
Характерными лигандами являются анионы и дипольные молекулы:
F-, Cl-, Br-, NO2-, CN-, SO42-, NH3, H2O
Заряд комплексообразователя является алгебраической сумме зарядов составляющих его ионов, например:
[Fex(CN)6]4-, x + 6(-1) = 4-; x = 2
Входящие в состав комплексного иона нейтральные молекулы не оказывают влияния на заряд. Если вся внутренняя сфера заполнена только нейтральными молекулами, то заряд иона равен заряду комплексообразователя. Так, у иона [Cux(NH3)4]2+ заряд меди х = 2+
Заряд комплексного иона равен зарядам ионов, находящихся во внешней сфере. В K4[Fe(CN)6] заряд [Fe(CN)6] равен -4, так как во внешней сфере находятся 4 катиона К+, а молекула в целом электронейтральна.
Лиганды во внутренней сфере могут замещать друг друга при сохранении одного и того же координационного числа, например:
Классификация и номенклатура комплексных соединений
По составу внутренней координационной сферы выделяются следующие классы комплексных соединений:
аквасоединеня - лиганды - молекулы воды - [Co(NH3)5NO2]Cl2
аминосоединения - лиганды - молекулы аммиака [Cu(NH3)4]SO4
гидроксосоединения - ионами гидроксила ОН-, Na2[Zn(OH)4]
ацидокомплексы - лиганды - кислотные остатки - K4[Fe(CN)6]
Некоторые лиганды занимают 2, 4 и даже более координационных мест – так называемые полидентантные лиганды (бидентантные, тетрадентантные и т.д., соответственно). Примером бидентантного лиганда может служить оксалат-ион С2О42-, но не потому что он двухвалентен (О2- - монодентантный лиганд; SO42- - может быть моно- (чаще) и бидентантным лигандом в зависимости от того с одним или двумя атомами кислорода соединён комплексообразователь), а из-за своей структуры

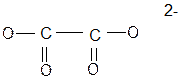
которая обеспечивает возможность происоединения этого иона к комплексообразователю двумя атомами кислорода. Типичен как бидентантный лиганд также этилендиамин H2N – CH2 – CH2 – NH2, присоединяющийся к иону металла-комплексообразователя через 2 атома аминного азота, как например в кобальтовом комплексе [Co(H2O)2En2]3+

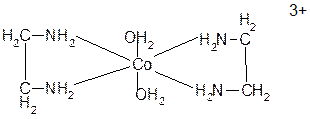
Также пятичленные циклы образуют анионы α-аминокислот. Такие же циклы в хлорофилле и гемоглобине. В них ионы магния и железа окружены тетрадентантными лигандами.
Образование циклов с полидентантными лигандами носит название хелатного эффекта. Хелатные координационные соединения более устойчивы, чем аналогичные соединения с монодентантными лигандами. Дентантность лиганда определяется числом σ-связей, которые он может образовывать.
Названия комплексных соединений образуются подобно названиям обычных солей: сначала называют анион, а потом катион в родительном падеже. Название комплексного катиона формируется следующим образом: указывается координационное число, -ди, -три, -тетра-, пента-, гекса-, и т.д. и название отрицательно заряженных лигандов с окончанием «о» - хлоро-, сульфато-, гидроксо-; далее - координационное число и название нейтрального лиганда - аква-; ОС-, наконец называют атом-комплексообразователь с указанием степени окисления римскими цифрами.
Некоторые лиганды занимают во внутренней сфере разное число координационных мест, т.е. различаются по их дентатности. Существуют монодентатаные, бидентатные и другие лиганды.
Известны комплексные соединения с двумя комплексными ионами в молекуле, для которых существует явление координационной изомерии, которая связана с разным распределением лигандов между комплексообразователями, например:
[Cr(NH3)6][Co(CN)6]
[Co(NH3)6][Cr(CN)6]
Различное пространственное расположение лигандов неоднородного комплекса во внутренней сфере приводит к явлению цис-транс-изомерии.
Соединение [Pt(NH3)2Cl2] существует в двух формах, структуре которых отвечает разное расположение лигандов по углам квдрата:
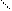
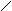

 Cl NH3 Cl NH3
Cl NH3 Cl NH3



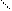 Pt Pt
Pt Pt
Cl NH3 NH3 Cl
оранжево-желтый цис-изомер светло-желтый транс-изомер
Cуществует также явление ионизационной изомерии, связанной с различным расположением ионов во внутренней и внешней координационных сферах. Для соединения Co(Br)SO4 ∙5NH3 известны 2 изомера - красно-фиолетовый и красный. Красно-фиолетовый изомер, будучи растворен в воде, не дает осадка с ионами Ag+, что было бы возможно, если ион брома был бы во внешней сфере, но дает его с ионами бария - сульфат бария. Раствор второго изомера, наоборот, образует осадок с ионами серебра, но не с ионами бария. Следовательно, формулы изомеров могут быть записаны как
[Co(NH3)5Br]SO4 [Co(NH3)5SO4]Br
красно-фиолетовый красный
Особенно часто в водных растворах встречается гидратная изомерия, состоящая в возможности вхождения воды во внутреннюю сферу комплекса вместо лиганда, как например в комплексах хрома (III), различающихся окраской: хлорид гексааквохрома (III) [Cr(H2O)]Cl3 фиолетовый, хлорид хлоропентааквохрома (III) [Cr(H2O)5Cl]Cl2 голубовато-зелёный, хлорид дихлоротетрааквохрома (III) [Cr(H2O)4Cl2]Cl зелёный.
Если имеется не менее трёх различных лигандов или лиганд бидентантен, то возможна зеркальная (оптическая) изомерия.
Метод валентных связей.
В методе валентных связей предполагается, что центральный атом комплексообразователя должен иметь свободные орбитали для образования ковалентных связей с лигандами. Число свободных орбиталей определяет координационное число комплексообразователя. При этом ковалентная связь возникает при перекрывании свободной орбитали атома-комплексообразователя с заполненными орбиталями лигандо-доноров электронных пар. Эта связь называется координационной.
Электронное строение частицы определяет ее магнитные свойства. Если в атоме, ионе, комплексной частице все электроны спарены, то магнитные моменты электронов компенсируются и суммарный магнитный момент равен нулю. Такие вещества выталкиваются из магнитного поля, они называются диамагнитными. Если в частице остаются неспаренные электроны, то она втягивается во внешнее магнитное поле, такая частица называется парамагнитной. Суммарный магнитный момент в этом случае увеличивается с увеличением числа неспаренных электронов. Предельный случай парамагнетизма - ферромагнетизм, который ярко проявляется у железа, кобальта, никеля, гадолиния.
Исследования магнитных свойств веществ приводят к определению числа спаренных и неспаренных электронов. Важно отметить, что при образовании комплексного иона переходного металла в результате взаимодействия его орбиталей с лигандами число неспаренных электронов может изменяться и не совпадать с числом неспаренных электронов свободного иона металла. Например, свободный ион Fe2+ имеет 4 неспаренных электрона 3d4. В комплексном ионе [FeF6]4- число спаренных электронов также 4, ион парамагнитен. Однако, в комплексном ионе [Fe(CN)6]4- все электроны спарены и ион диамагнитен.
В зависимости от того, какие атомные орбитали катиона используются для акцептирования неподеленных пар электронов лигандов, возникающий комплексный ион может быть внешнеорбитальным или внутриорбитальным.

 3d 4s 4p
3d 4s 4p

  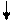 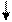 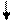 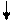 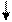 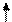 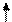   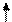  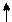 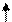 
| 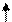
|

Электронное строение иона [NiCl4]2-
3d 4s 4p
 |
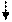  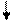  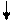 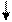 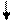 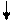 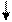 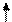  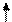  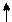 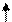 
| 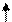
|

Электронное строение иона [Ni(CN)4]4-
Примеры решения задач.
Пример 1. Комплексный ион [Zn(NH3)4]2+ имеет тетраэдрическое строение. Какие орбитали комплексообразователя используются для образования связей с молекулами аммиака?
Решение. Тетраэдрическое строение характрно для sp3-гибридных орбиталей. Ион Zn2+ имеет свободные 4s и 4p-орбитали, гибридизация которых приводит к образованию 4 sp3-орбиталей.
Пример 2. Почему комплексный ион [Cu(NH3)2]+ имеет линейное строение?
Решение. Линейное строение иона является следствием образования двух гибридных 4sp-орбиталей иона Cu+, которые акцептируют электронные пары молекул аммиака.
Пример 3. Почему ион [NiCl4]2- парамагнитен (тетраэдр), а ион [Ni(CN)4]4- диамагнитен (плоский квадрат)?
Решение. Ионы Cl- слабо взаимодействуют с ионами Ni2+. Электронные пары от Cl- поступают на орбитали с главным квантовым числом 4. При этом оставшиеся у иона никеля 3d-электроны остаются неспаренными и ион [NiCl4]2- - парамагнитен. Электронное строение иона может быть представлено схемой (рис.8).
В [Ni(CN)4]4- вследствие sp2d-гибридизации происходит спаривание электронов никеля и комплексный ион становится диамагнитен (рис.9). Пунктрной рамкой обведены орбитали атома никеля, заполняемые электронными парами лигандов. Ион [NiCl4]2- - внешнеорбитальный и высокоспиновый, так как электронные пары от хлора поступают на свободные орбитали с более высоким квантовым числом 4.
Ион [Ni(CN)4]4- - внутриорбитальный и низкоспиновый, так как электронные пары акцептируются гибридной орбиталью, включающей вклад “внутренней” 3d – подоболочки атома никеля, все электроны спарены. При гибридизации образуется комплексный ион плоского строения.
Пример 4. Констаната нестойкости иона [Ag(CN)2]- составляет 1 *10-21. Вычислить концентрацию ионов серебра в 0,05М растворе К[Ag(CN)2], содержащем, кроме того, 0,01 моль/л KCN.
Решение. Вторичная диссоциация комплексного иона протекает по уравнению:
[Ag(CN)2]- → Ag+ + 2CN-
В присутствии избытка ионов CN-, создаваемого в результате диссоциации KCN (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов CN-, образующимся при вторичной диссоциации, можно пренебречь. Тогда [CN-] = C KCN = 0,01моль/л. По той же причине равновесная концентрация ионов [Ag(CN)2]- может быть приравнена общей концентрации комплексной соли (0,05 моль/л).
По условию задачи:
[Ag+] [CN-]2
Kнест = ---------------------- = 1*10-21
[Ag(CN)2]-
Отсюда выражаем концентрацию ионов Ag+.
1*10-21 * [Ag(CN)2]-
[Ag+] = -----------------------
[CN-]2
Подставив значения концентраций ионов CN- и [Ag(CN)2]-, получим:
1*10-21 * 0,05
[Ag+] = ------------------ = 5*10-19 моль/л
(0,01)2
Пример 5. Растворы простых солей кадмия образуют со щелочами осадок гидроксида кадмия Cd(OH)2, а с сероводородом – осадок сульфида кадмия CdS. Чем объяснит, что при добавлении щелочи к 0,05М раствору K2[Cd(CN)4], содержащему 0,1 моль,л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS? Константу нестойкости иона [Cd(CN)4]2- принять равной 7,8*10-18.
Решение:
Условия образования осадков Cd(OH)2 и CdS могут быть записаны следующим образом:
[Cd2+][OH-]2 > ПР Cd(OH)2 = 4,5 * 10-15
[Cd2+][S2-] > ПР CdS = 8 * 10-27
В растворе комплексной соли при заданных условиях концентрация ионов Cd2+ вычисляется по уравнению (см пример 4):
Kнест. * [Cd(CN)4]2- 7,8*10-18 *0,05
[Cd2+] = --------------------------- = ---------------------- = 3,9*10-15 моль/л
[CN-]4 (0,1)4
Задачи:
1. Изобразить распределение электронов в ионе [FeF6]4-, учитывая, что его парамагнетизм отвечает 4 неспаренным электронам.
2. Изобразить распределение электронов в [Fe(CN)6]4-, если этот ион диамагнитен. Какой тип гибридизации?
3. Привести примеры аквакомплексов, аммиакатов, ацидокомплексов.
4. Какова сущность явления цис-транс-изомерии?
5. Почему гидроксид двухвалентной меди растворяется в аммиаке?
6. Гидроксид алюминия растворяется в NaOH с образованием комплексного иона [Al(OH)4]-. Написать реакцию растворения и определить заряд иона-комплкексообразователя.
7. Написать координационные изомеры для комплексов [Co(NH3)5Br]SO4, [Pt(NH3)4Cl2]Br.
8. Привести названия солей: K4[Fe(CN)6], Na2[PdI4], [Pt(NH3)2Cl2], K2[Co(NH3)2 (NO2)4], [Cd(NH3)4]SO4. Какие виды изомерии характерны для этих веществ? Укажите координационное число иона комплексообразователя.
9. Запишите формулы сульфата татрамминникеля (II), тетрахлороплатината (II)
10. калия. Проставьте степени окисления всех элементов в этих соединениях.
11. Растворится ли 1 моль гидроксида алюминия в 100 мл 10%-ного раствора едкого кали с образованием комплексного соединения K[Al(OH)4]?
12. Изобразить распределение электронов в ионе [Ni(NH3)4]2+ парамагнетизм которого определяется двумя неспаренными электронами.
13. Комплексный ион [Cr(H2O)6]3+ является парамагнитным. Изобразить его электронную структуру.
14. Ион [Ag(CN)2]- имеет линейную структуру. Изобразить его электронную структуру.
15. Изобразить распределение электронов в октаэдрическом комплексном ионах [Cr(CN)6]3-, [Fe(CN)6]3-, [Fe(CN)6]4-, [Co(H2O)6]2+, [Co(H2O)6]2+. Указать магнитные свойства ионов.
Качественные реакции d- элементов
Реакции иона хрома Cr3+
Гидроксиды щелочных металлов осаждают Cr(OH)3 зеленого цвета,
растворимый в избытке реактива, вследствие своих амфотерных свойств:
Cr3+ + 3OH- ® Cr(OH)3
Cr(OH)3 + OH- ® CrO2- + 2H2O
Проведение реакции:
К 2-3 каплям раствора соли хрома (III) прибавьте 1-2 капли 2М раствора NaOH. К полученному осадку прилейте избыток реактива. Что наблюдаете? Напишите уравнение реакции.
Действие окислителей.
В результате реакции образуютcя соли хрома и дихромовой кислот.
Действием Н2О2 Cr3+ окисляется в щелочной среде до CrО42- желтого цвета (хромат-ионы).
Cr3+ + 2OH- ® CrO2- + 2H+
2CrO2- + H2O2 + 2OH- ® 2CrO42- + 4H2O
Проведение реакции:
К 2-3 каплям раствора соли хрома (III)добавьте 2-3 капли 3% раствора перекиси водорода и 4-5 капель 2М раствора NaOH. Смесь нагрейте до перехода зеленой окраски в желтую. Это значит, что Cr3+ окислился до CrO4-. Для доказательства в пробирку прилейте 1-2 капли полученного раствора и добавьте 1-2 капли раствора соли бария или раствора серебра. Что наблюдается?
Напишите уравнения реакций.
Действие персульфата аммония (NH4)2S2O8
При окислении Cr3+ персульфатом аммония (NH4)2S2O8 в кислой среде образуется Cr2О72-:
2Cr3+ + 3S2О82- + 7H2O ® Cr2O7 2- + 6SO42- + 14H+
Реакция идет в присутствии катализатора AgNO3 в кислой среде
(HNO3) при нагревании. Образуется оранжевый раствор, обусловленный появлением дихромат-ионов Cr2O72-.
Если этот раствор охладить, добавить к нему 2-3 капли H2O2, смеси изоамилового спирта и эфира и быстро взболтать, то верхний органический слой окрашивается в синий цвет вследствие перехода в него образовавшегося пероксида хрома (надхромовой кислоты):
K2Cr2O7 + 4H2O2 + H2SO4 ® 2H2CrO6 + K2SO4 + 3H2O
Реакция очень чувствительна (2,5 мг) и специфична. Позволяет открывать катион Cr3+ и анионы CrO42-, Cr2O72- в присутствии катионов всех групп.
Реакции ионов цинка (Zn2+).
Гидроксиды щелочных металлов осаждают из водных растворов осадок Zn(OH)2 белого цвета, растворимый в избытке реактива с образованием цинкатов:
ZnCl2 + 2NaOH ® Zn(OH)2 + 2NaCl
Zn(OH)2 + 2NaOH ® Na2ZnО2 + 2H2O
Раствор NH4OH. К 2-3 каплям раствора цинка (Zn2+) прибавьте по каплям 2М раствор аммиака сначала до появления осадка, а затем до растворения. Напишите уравнение реакции и наблюдения.
Гексацианоферрат (II) калия K4 [Fe(CN)6] образует с ионами Zn2+ белый осадок калий-цинк гексацианоферрата (II), нерастворимый в разбавленной HCl. (реакция фармакопейная).
3Zn(NO3)2 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2 + 6KNO3
Условия реакции:
1) рН = 4-5
2) В избытке реактива осадок может раствориться.
3) Ионы Al3+ не мешают определению.
Действие H2S или Na2S (реакция фармакопейная )
Сероводородная вода или сульфид натрия осаждает из водных растворов солей цинка белый осадок ZnS, нерастворимый в уксусной кислоте, нерастворимый в разбавленной HCl.
Zn2+ + S2- ® ZnS (т)