ZnS(т) + 2HCl ® ZnCl2 + H2S(г)
Реакцию с сульфидами используют как дробную, предварительно удалив мешающий Pb2+ осаждением в виде сульфата, Sn2+ - окислением Н2О2, остальные мешающие катионы - осаждением избытком NaOH.
Реакции ионаMn2.+
Действие щелочей.
С ионами Mn2+ едкие щелочи образуют гидроокись - осадок белого цвета, не растворимый в избытке щелочи.
Mn2+ + 2OH- ® Mn(OH)2
Проведение опыта:
В пробирку возьмите 2 капли раствора соли Mn2+ и добавьте 2 капли KOH или NaOH.
Действие Н2О2 в щелочной среде.
Перекись водорода в щелочной среде окисляет Mn2+ до H2MnO3
Mn(OH)2 + H2O2 ® H2MnO3 + H2O
Проведение опыта:
Возьмите в пробирку 2-3 капли Mn(NO3)2, 2-3 капли 6%-ного раствора Н2О2 и столько же 6N NaOH. Cодержимое пробирки нагрейте. Выделяется коричневый осадок H2MnO3.
Условия реакции:
V- Среда щелочная.
2. Реакция проводится при нагревании.
Действие двуокиси свинца (PbO2).
Двуокись свинца окисляет ионы Mn2+ в кислой среде до MnO4- - малиново-фиолетового цвета.
2Mn2+ + 5PbO2 +4H+ ® 2MnO4- + 5Pb2+ + 2H2O
Проведение опыта:
Возьмите стеклянной лопаточкой немного порошка PbO2 и поместите в пробирку, прибавив туда же 4-5 капель 6N раствора HNO3. Содержимое пробирки нагрейте. Затем прибавьте 1-2 капли Mn(NO3)2, перемешайте и вновь нагрейте. При этом ион Mn2+ окисляется в марганцевую кислоту HmnO4, имеющую характерную малиново-фиолетовую окраску.
Условия реакции:
1. Реакцию следует проводить при рН = 3-4.
2.Необходимо отсутствие хлорид-ионов.
Действие персульфата аммония (NH4)2S2O8.
Персульфат аммония окисляет Mn2+ в слабокислой среде до MnO4-:
2Mn2+ + 5S2O82- + 8H2O ® 2MnO4- + 10HSO4- + 6H+
Проведение опыта:
Возьмите в пробирку 1 каплю Mn(NO3)2, прибавьте 1 каплю HNO3, 2 капли AgNO3 и несколько кристалликов (NH4)2S2O8. Содержимое пробирки нагрейте до кипения. В результате этого образуется малинового цвета раствор HmnO4.
Условия реакции:
V- Реакцию следует проводить в слабокислой среде, в присутствии катализатора AgNO3.
2. Реакцию проводят при нагревании.
3. Следует брать следы марганца, иначе Mn2+ не в состоянии окислится до MnO4- и окисляется лишь до MnO2 (осадок коричневого цвета).
Реакции иона Fe2+.
Реакция (фармакопейная) с гексацианоферратом (III) калия K3[Fe(CN)6-]
3 FeSO4 + 2K3[Fe(CN)6] ® 3K2SO4 + Fe3[Fe(CN)6]2
Проведение опыта:
К 3 каплям соли Fe2+ прибавьте 2 капли HCl и 2-3 капли К3[Fe(CN6)]. Образуется синий осадок турнбулевой сини.
Действие диметилглиоксима (реактива Чугаева).
Реактив Чугаева с ионами Fe2+ дают растворимую в воде внутрикомплексную соль розово-красного цвета.
Проведение опыта:
В пробирку возьмите 3 капли соли Fe2+ и прибавьте 1 каплю винной кислоты, 2-3 капли NH4OH и 2-3 капли спиртового раствора диметилглиоксима. Образуется растворимое комплексное соединение диметилглиоксимата железа (II) красно-розового цвета. Cм. Реакцию с ионом никеля.
Условия реакции:
1. Реакцию проводят в аммиачной среде при рН>7.
2. Реакции мешают Fe3+ и Ni2+. Fe3+ связывают в комплексное соединение с винной кислотой, а Ni2+ при помощи KCN связывают в комплексный ион [Ni(CN)4]2-.
Гидроксиды щелочных металлов осаждают зеленый осадокFe(OH)2, буреющий на воздухе, вследствие окисления кислородом воздуха до Fe(OH)3.
Осадок нерастворим в избытке щелочей.
Реакции ионаFe3+.
Гидроксиды щелочных металлов образуют с ионами Fe3+, бурый осадок Fe(OH)3. Осадок нерастворим в избытке щелочей.
Действие гексацианоферрата калия K4[Fe(CN)6].
Гексацианоферрат калия образует с ионами Fe3+ тёмно-синий осадок берлинской лазури.
4FeСl3 + 3K4[Fe(CN)6] ® 12KCl + Fe4[Fe(CN)6]3
В пробирку возьмите 3 капли FeCl3, 1 каплю HCl и 3 капли K4[Fe(CN)6]. При этом выпадает темно-синий осадок берлинской лазури.
Действие роданида аммония (NH4CNS) или калия (KCNS).
Роданид-ион образует с ионами Fe3+ кроваво-красный раствор Fe(CNS)3:
FeCl3 + 3NH4CNS ® Fe(CNS)3 + 3NH4Cl
Проведение опыта:
Возьмите 1 каплю FeCl3 и 2-3 капли воды, затем 1 каплю NH4CNS; при этом образуется кроваво-красный цвет раствора. К этому же раствору прибавьте фосфорную, щавелевую, винную или лимонную кислоту, красная окраска исчезает, вследствие образования комплексного соединения.
Ионы железа (III) восстанавливаются солями олова (II) до ионов железа (II) которые при взаимодействии с K3[Fe(CN)6] образуют темно-синий осадок «турнбулевой сини».
2Fe3+ + Sn2+ ® 2Fe2+ + Sn4+
3Fe3+ + 2Fe(CN)63- ® Fe3[Fe(CN)6]2
К 4 каплям раствора соли Fe3+ прибавьте 3 капли 2М раствора HCl, 2 капли раствора K3[Fe(CN)6] и 2 капли раствора соли олова.
Реакция (фармакопейная) с сульфосалициловой кислотой в кислой среде.

сульфосалицилат железа красно-фиолетового цвета
Реакция с гидроксидами. В результате реакции образуется Fe(OH)3 нерастворимый в щелочах.
Реакция с сульфидом натрия. Сульфид натрия осаждает из растворов солей железа (III) Fe2S3 черного цвета:
2Fe3+ + 3S2- ® Fe2S3(т)
Fe2S3(т) растворим в минеральных кислотах.
Реакции иона Bi3+
Гидролиз солей висмута. Соли висмута подвергаются гидролизу, образуя соединения оксида висмута (III) и висмутила BiO+
BiCl3 + 2H2O → Bi(OH)2Cl (т) + 2HCl
Bi(OH)2Cl → BiOCl (т) + H2O
Сначала образуется осадок висмутгидроксидхлорида, который, отщепляя воду, переходит в осадок висмутоксидхлорида BiOCl.
Осадок растворим в минеральных кислотах и нерастворим в винной кислоте.
Проведение опыта:
Возьмите в пробирку 3 капли раствора соли висмута BiCl3 или Bi(NO3)3 + NH4Cl и разбавьте 4-кратным избытком дистиллированной воды. При этом выпадает белый осадок, растворимый в минеральных кислотах, но нерастворимый в винной кислоте.
Условия реакции:
V- Реакцию следует проводить при рН = 3-4. Если раствор соли висмута сильно кислый, его следует разбавить водой.
3. Соли сурьмы мешают определению.
Восстановление SnCl2. SnCl2 восстанавливает Bi3+ до металлического висмута, выпадающего в виде черного осадка:
SnCl2 + 4NaOH ® Na2SnO2 + 2NaCl + 2H2O
Bi(NO3)3 + 3NaOH ® Bi(OH)3 (т) + 3NaNO3
2Bi(OH)3 + 3Na2SnO2 ®2Bi (т) + 3Na2SnO3 + 3H2O
Условия реакции:
1. Реакцию следует проводить при рН = 10
2. Раствор соли олова должен быть свежеприготовленным.
Реакция с сульфидом натрия. (Реакция фармакопейная).
Сульфид натрия Na2S в кислой среде дает с солями висмута (III) коричнево-черный осадок Bi2S3:
2Bi3+ + 3S2- ® Bi2S3
Bi2S3 + 8HNO3 ® 2Bi(NO3)3 + 2NO + S + 4H2O
Действие тиомочевины.
Тиомочевина образует с ионами Bi3+ растворимое комплексное соединение желтого цвета:
Bi(NO3)3 + 3SC(NH2)2 ® [SC(NH2)2]3+ Bi(NO3)3
Проведение опыта:
Возьмите в пробирку 2 капли раствора Bi(NO3)3 и 3 капли азотнокислого раствора тиомочевины, раствор окрашивается в желтый цвет.
Действие иодида калия.
Иодид калия KI осаждает из растворов солей висмута черный осадок BiI3, растворимый в избытке реактива с образованием комплексной соли - тетраиодвисмутата калия:
Bi3+ + 3I- ® BiI3
BiI3 + KI ® K[BiI4]
Реакции мешают ионы Fe3+, Cu2+, которые окисляют I- до I2.
Реакции катиона Cu2+
В пробирку поместить 3 капли соли меди и прибавить 1-2 капли 2М раствора NH4OH. К полученному раствору прибавить при перемешивании несколько капель концентрированного раствора NH4OН до растворения осадков.
Едкие щелочи NaOH и KOH образуют с катионами Cu2+ голубой осадок Сu(OH)2
Cu2+ + 2OH 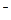 ® Cu(OH)2
® Cu(OH)2
Выполнение реакции.
К 4-5 каплям раствора CuSO4 прибавить 3-4 капли 2М раствора NaOH. Осадок разделить на 3 части.
Одну часть прокипятить до появления осадка CuO черного цвета: Cu(OH)2
1) Cu(OH)2 ® CuO + H2O
2) Ко второй части добавить 2-3 капли 2М раствора HCl.
Осадок легко растворяется:
Cu(OH)2 + 2H+ ® Cu2+ + 2H2O
V- К третьей части добавить 2-3 капли 6М раствора NaOH. Осадок растворяется с образованием купритов:
Cu(OH)2 + 2OH- ® CuO2 2- + 2H2O
Гексацианоферрат калия (II) K4[Fe(CN)6] осаждает ион Cu2+ в виде гесацианоферрата (II) меди красно-бурого цвета:
2Cu2+ + Fe(CN)64- ® ¯Cu2[Fe(CN)6]
Выполнение реакции:
К 2-3 каплям раствора CuSO4 прибавить 1-2 капли реактива. Осадок разделить на две части.
1) К одной части прибавить 2-3 капли 2М раствора HCl. Осадок не растворяется.
2) К другой части прибавить 2-3 капли 2М раствора NaOH.Осадок разлагается с образованием Cu(OH)2:
Cu2[Fe(CN)6] + 4NaOH = 2Cu(OH)2 + Na4[Fe(CN)6]
Тиосульфат натрия Na2S2O3 осаждает катионы меди в виде осадка CuS черного цвета:
СuSO4 + Na2S2O3 + H2O ® ¯CuS + Na2SO4 + H2SO4
Выполнение реакции:
В пробирку поместить 2-3 капли раствора соли меди, прибавить 4-5 капель воды, 2-3 капли 1М раствора H2SO4 и 2-3 кристаллика Na2S2O3. Перемешать и нагреть.
При избытке реактива подкисленный раствор соли меди обесцвечивается, вследствие образования тиосульфатного комплекса одновалентной меди. При нагревании комплекс разлагается с образованием темно-бурого осадка смеси Cu2S с серой:
2CuSO4 + 4Na2S2O3 == ¯Cu2S + ¯S + 3Na2SO4 + Na2S4O6 + SO2
Иодид калия KI восстанавливает катионы Cu2+ до Cu+:
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
белый бурый
Выполнение реакции:
К 1-2 каплям раствора CuSO4 прибавить 2-3 капли раствора KI и 1-2 капли крахмала (синеющего в присутствии I2).
Реакция окрашивания пламени. Соли меди окрашивают бесцветное пламя горелки в синий или зеленый цвет.
Реакции катиона Ni2+
Действие группового реагента.
К 3 каплям раствора соли Ni2+ прибавить 1-2 капли 2М раствора NH4OH. Образуется основная соль
2NiSO4 + 2NH4OH ® ¯(NiOH)2SO4 + (NH4)2SO4
светло-зеленый
К полученному осадку при перемешивании добавить 3-4 капли при перемешивании концентрированного раствора NH4OH. Происходит растворение осадка и образование комплексного соединения:
¯(NiOH)2SO4 + 12 NH4OH ® 2[Ni(NH4)6](OH)2 + (NH4)2SO4 + 12Н2О
синий
Едкие щелочи NaOH и KOH осаждают ионы никеля в виде Ni(OH)2 светло-зеленого цвета:
Ni2+ + 2OH-  Ni(OH)2¯
Ni(OH)2¯
Выполнение реакции: К 1-2 каплям раствора соли никеля прибавить 1-2 капли 2М раствора NaOH. Полученный осадок разделить на 2 части. К одной части прибавить 3-4 капли 2М раствора NaOH. Осадок не растворяется. К другой части раствора прибавить 3-4 капели 2М раствора HCl. Осадок растворяется с образованием растворимой соли никеля:
Ni(OH)2 + 2HCl  NiCl2 + H2O
NiCl2 + H2O
Диметилглиоксим (Реактив Чугаева) осаждает катионы Ni2+ в аммиачной среде в виде внутрикомплексного соединения ало-красного цвета:

 СН3 - С = NOH HON = C – CH3
СН3 - С = NOH HON = C – CH3
+ Ni2+ + + 2NH3 ®
CH3 - C = NOH HON = C – CH3

Выполнение реакции:
К 2-3 каплям раствора соли никеля добавить по 2-3 капли NH4OH и 2-3 капли реактива Чугаева. Полученный осадок разделить на 2 части и проверить на растворимость в HCl и концентрированном растворе NH4OH.
Условия реакции:
1. Аммиачная среда, рН = 8.
2. Реакции мешают ионы Fe2+, Cu2+. Для удаления мешающего влияния данных катионов, их удаляют, связывая в нерастворимые фосфаты. Для этого на фильтровальную бумагу наносят каплю раствора Na2HPO4, каплю соли никеля, а затем еще каплю Na2HPO4. На влажное пятно нанести каплю реактива Чугаева и подержать бумагу над открытым сосудом с концентрированным раствором NH4OH.
Реакции иона Со2+.
Раствор NH4ОН, добавленный в эквивалентном количестве осаждает катион Со2+ в виде основной соли CoOHCl синего цвета.
Выполенение реакции:
К 3 каплям раствора соли Со2+ прибавить 1-2 капли 2М раствора NH4ОН.
CoCl2 + NH4OH ® ¯CoOHCl + NH4Cl
синий
Полученный осадок разделить на 2 части:
К первой части прибавить 3-4 капли 3%-ного раствора Н2О2, а затем в обе части осадка добавить 3-4 капли насыщенного раствора NH4OH и 3-4 капли насыщенного раствора NH4Cl.
В первой пробирке происходит реакция образования комплексного соединения гесаамминкобальта (Ш) вишнево-красного цвета:
2CoCl2 + 10NH4OH + 2NH4Cl + H2O2 ® 2[Co(NH3)6]Cl3 + 12H2O
Во второй пробирке происходит образование комплексного соединения гесаамминкобальта (П) желто-бурого цвета:
CoOHCl + 5NH4OH + NH4Cl ® [Co(NH3)6]Cl2 + 6H2O
Едкие щелочи NaOH и KOH осаждают катионы Со2+ в виде основной соли синего цвета:
CoCl2 + NаOH ® ¯CoOHCl + NаCl
синий
Выполнение реакции:
К 2-3 каплям раствора соли Со2+ прибавить 1-2капли 2М раствора NaOH. Осадок разделите на 2 части. К одной части прибавить 1-2 капли 2M раствора NaOH и нагреть на водяной бане.
СоОНCl + NaOH ® Co(OH)2 + NaCl
Образуется гидроксид кобальта Со(ОН)2 розового цвета.
Осадок разделите на 2 части и убедитесь, что он растворяется в кислотах и щелочах при нагревании.
В пробирку поместите 2-3 капли раствора соли Со2+, добавьте 1-2 капли 2М раствора NaOH и 1-2 капли 3% раствора Н2О2. Образуется осадок Со(ОН)3 бурого цвета
2CoCl2 + 4NaOH + H2O2 ® ¯2Co(OH)3 + 4NaCl
Убедитесь, что в отличие от Co(OH)2 осадок Co(OH)3 не растворяется в кислотах.
Тиоцианат аммония NH 4 NCS в присутствии амилового спирта образует с ионом Со2+ комплексную соль состава (NH4)2[Co(NCS)4] синего цвета:
СоСl2 + 4NH4NCS  (NH4)2[Co(NCS)4] + 2NH4Cl
(NH4)2[Co(NCS)4] + 2NH4Cl
Выполнение реакции:
К 2-3 каплям раствора соли Со2+ добавьте 8 капель насыщенного раствора NH4NCS и 5-6 капель амилового спирта, перемешайте. При этом верхний органический слой окрасится в синий цвет в результате экстракции амиловым спиртом комплексного соединения (NH4)2[Co(NCS)4]
Условия реакции:
1. Реакцию следует проводить при рН = 4-5.
2. Так как комплексоное соединение (NH4)2[Co(NCS)4] очень непрочное, то для сдвига равновесия вправо, берется избыток NH4NCS.
3. Необходимо брать амиловый спирт, так как в органическом растворителе повышается устойчивость комплексного соединения.
4. Реакции мешают катионы Fe3+, поэтому их маскируют добавленеим винной кислоты или NaF, которые образуют с Fe3+ бесцветные комплексные соединения.
Действие нитрита калия KNO2.
Реакция основана на окислении Со2+ ионов в ионы Со3+ азотистой кислотой, образующейся при взаимодействии NO2- - ионов с СН3СООН. Образуется желтый кристаллический осадок гексанитрокобальатата (Ш) калия:
Co(NO3)2 + 7KNO2 + 2CH3COOH ® K3[Co(NO2)6]¯ + 2KNO3 + 9NO + 2CH3COOK + H2O
Выполнение реакции.
К 2-3 каплям раствора соли Со2+ прибавьте несколько капель 2М раствора СН3СООН, несколько кристалликов KNO2. Потрите стеклянной палочкой о внутренние стенки пробирки; при этом выпадает желтый кристаллический осадок соли K3[Co(NO2)6].
Реакции иона Ag+
Ag+ +Cl 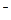 ® AgCl - осадок белого цвета
® AgCl - осадок белого цвета
Полученный осадок разделите на 2 части. К одной части добавьте 1-2 капли 2М раствора HNO3 - осадок не растворяется, ко второй части добавляют по каплям при перемешивании 2М раствор аммиака до растворения AgCl.
AgCl + NH4OH ® [Ag(NH3)2]Cl + H2O
Эту реакцию используют для отделения Hg22+ от Ag+.
При подкислении образовавшийся комплекс разрушается и выпадает осадок AgCl.
[Ag(NH3)2]Cl + 2HNO3 ® AgCl¯ + NH4NO3
Этот комплекс разрушается и KI, при этом выпадает светло-желтый осадок AgI.
Ag(NH3)2+ + I 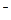 + 2H2O ® AgI ¯+ 2NH4OH
+ 2H2O ® AgI ¯+ 2NH4OH
Разрушение аммиаката серебра происходит вследствие того, что произведение растворимости AgI значительно меньше константы нестойкости комплекса.
Условия реакции:
1. Реакцию следует проводить при рН < 7. В щелочном растворе образуется окись серебра, а в аммиачном растворе осадка не образуется.
2. Осаждение следует проводить из разбавленных растворов.
3. Нагревание способствует коагуляции.
Едкие щелочи NaOH и КОН
Осаждают из растворов солей серебра бурый осадок Ag2O, образующийся вследствие разложения гидроксида серебра:
2AgNO3 + 2NaOH ® 2AgOH + 2NaNO3
2AgOH  Ag2O + H2O
Ag2O + H2O
Осадок Ag2O образуется и при действии NH4OH на растворимые соли серебра, но быстро растворяется в избытке аммиака.
Ag2O + 4NH4OH ® 2Ag[(NH3)2]OH + 3H2O
Хромат калия K2CrO4 образует с ионами Ag+ кирпично-красный осадок Ag2CrO4
2Ag+ + CrO42- ® ¯Ag2CrO4
Осадок растворим в HNO3 и в NH4OH, и весьма незначительно – в СН3СООН.
2Ag2CrO4 + H+ ® 2Ag+ + H2CrO4
Ag2CrO4 + 4NH4NO3 ® 2[Ag(NH3)2]+ + CrO4- + 4H2O
Выполнение реакции:
К 3-4 каплям AgNO3 прибавить 2-3 капли раствора K2CrO4. PH = 6,5 – 7,5.
Растворы бромидов и иодидов
Дают с ионом Ag+ белый или желтоватый творожистый осадок AgBr и светло-желтый творожистый осадок AgI:
Ag+ + Br 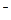 ® AgBr¯ Ag+ + I
® AgBr¯ Ag+ + I  ® AgI¯
® AgI¯
Осадки не растворяются в HNO3. AgBr незначительно растворяется в NH4OH. AgI в NH4OH не растворяется.
Реакция серебряного зеркала.
Формальдегид восстанавливает ионы серебра до металлического серебра:
2[Ag(NH3)2](OH) + HCOH + 3H2O ® 2Ag + 4NH4OH + HCOOH
Выполнение реакции:
В чистую пробирку поместите несколько капель раствора соли AgNO3 и в 2 раза больше раствора NH4OH, затем несколько капель разбавленного раствора формальдегида и 2-3 капли NaOH (как катализатора). Пробирку с раствором погрузите в горячую водяную баню и дайте постоять раствору в бане, пока на стенках не появится блестящий налет серебра.
Условия реакции:
1. Среда должна быть аммиачная.
2. Должно быть умеренное нагревание.
3. Аскорбиновая кислота также восстанавливает ионы серебра:
2Ag+ + C6H8O6 ® Ag¯ + C6H6O6 + 2H+
4. Реакции мешают катионы ртути.
Восстановление ионов Ag+ ионами Mn2+.
Mn2+ восстанавливает ионы Ag+ до Ag
2AgCl + MnCl2 + 4NH4OH ® 2Ag + MnO(OH)2 + 4NH4Cl + H2O
Выполнение реакции:
На листок фильтровальной бумаги поместите каплю HCl и каплю исследуемого раствора. В присутствии ионов Ag+ образуется осадок AgCl. Этот осадок на той же фильтровальной бумаге отмойте при помощи капилляра дистиллированной водой от избытка HCl. Прилейте к осадку каплю раствора соли Mn2+ в качестве восстановителя, а затем каплю раствора аммиака, при этом ионы Ag+ восстанавливаются до металлического серебра и на бумаге появляется черное пятно.
Условия реакции:
Среда должна быть аммиачная. Сильные окислители должны отсутствовать.
Занятие 11.Контрольная работа 2.
Контрольные вопросы.
1. Свойства s-элементов.
2. Взаимодействие металлов с кислородом. Гидроксиды щелочных и щелочно-земельных металлов. Гидриды щелочных и щелочно-земельных металлов. Сульфаты, галогениды, карбонаты, фосфаты щелочных и щелочно-земельных металлов.
3. Биологическая роль s-элементов в минеральном балансе организма. Макро- и микро- s-элементы.
4. Соединения кальция в костной ткани, сходство ионов кальция и стронция. Химические основы применения соединений лития, натрия, калия, магния, кальция, бария в медицине.
5. Свойства р-элементов.
6. Фосфор. Общая характеристика. Фосфиды. Фосфин. Соединения фосфора с положительными степенями окислениями. Фосфорноватистая (гипофосфористая) и фосфористая кислоты. Дифосфорная (пирофосфосфорная) кислота. Изополи- и гетерополифосфатные кислоты. Метафосфорные кислоты. Производные фосфорной кислоты в живых организмах.
7. Химические свойства кислорода, серы, фосфора и их соединений. Кислород. Общая характеристика. Особенности электронной структуры молекулы дикислорода. Трикислород (озон), химическая активность в сравнении с дикислородом (реакция с растворами иодов). Биологическая роль кислорода. Химические основы применения дикислорода и озона, а также соединений кислорода в медицине.
8. Сера. Общая характеристика. Способность к образованию гомоцепей. Водорода сульфид. Сульфиды металлов и неметаллов, их растворимость в воде и гидролиз. Полисульфиды. Сернистая кислота, сульфиты и водородсульфиты (гидросульфиты). Соединения серы (VI) - оксид, серная кислота и ее производные - сульфаты. Олеум. Дисерная (пиросерная) кислота. Пероксомоно- и пероксодисерная кислота и соли. Окислительные свойства пероксосульфатов. Биологическая роль серы. Химические основы применения серы и ее соединений в медицине и химическом анализе. Медико-биологическая роль кислорода, серы, фосфора.
9. Галогены. Хлор и его соединения. Кислородные кислоты хлора и их соли. Хлорная известь, хлораты, броматы и йодаты и их свойства. Биологическая роль фтора, хлора, брома и йода. Применение в медицине, санитарии и фармации
10. Азот. Общая характеристика. Многообразие соединений с различными степенями окисления азота. Аммиак, ион аммония и его соли, кислотные свойства.
11. Кислородсодержащие соединения азота. Оксиды азота. Азотистая кислота и нитриты.