Действие родизоната натрия.
Родизонат натрия образует с ионами бария красно-бурый осадок родизоната бария, который в присутствии HCl становится розово-красным.

Проведение опыта:
 На фильтровальную бумагу нанесите каплю соли Ва2+ и каплю родизоната натрия. Появляется красно-бурое пятно. Затем на это пятно нанесите каплю HCl, при этом осадок становится розово-красным, вследствие превращения в кислый родизонат бария.
На фильтровальную бумагу нанесите каплю соли Ва2+ и каплю родизоната натрия. Появляется красно-бурое пятно. Затем на это пятно нанесите каплю HCl, при этом осадок становится розово-красным, вследствие превращения в кислый родизонат бария.
Условия реакции:
Среда должна быть нейтральной.
Реакция окрашивания пламени.
Летучие соли бария окрашивают бесцветное пламя в зеленый цвет.
Реакции иона Mg2+.
Действие NaOH (групповой реактив).
Mg2+ + 2NaOH ® Mg(OH)2
Проведение опыта.
К 3 каплям соли Mg2+ прибавьте столько же капель NaOH. При этом выпадает белый аморфный осадок Mg(OH)2.
Действие гидрофосфата натрия (Na2HPO4). Реакция фармакопейная.
Гидрофосфат натрия образует с солями магния в присутствии NH4OH и NH4Cl белый кристаллический осадок фосфата магния и аммония MgNH4PO4.
Mg(NO3)2 + Na2HPO4 + NH4OH ® MgNH4PO4 + 2 NaNO3 + H2O
Проведение опыта.
Возьмите а пробирку 2 капли Mg(NO3)2, 2 капли 2N раствора HCl и 2 капли Na2HPO4. После этого прибавляйте по одной капле 2N раствора NH4OH, перемешивая содержимое пробирки после каждой капли. Сначала аммиак нейтрализует кислоту с образованием NH4Cl, которая нужна для предупреждения выпадения в осадок Mg(OH)2. Когда нейтрализация закончится, начинается выпадение кристаллического осадка MgNH4PO4.
Прибавление аммиака нужно продолжать до появления запаха.
Условия реакции:
1. Наличие NH4Cl.
2. рН среды < 7.
Большой избыток NH4Cl препятствует осаждению MgNH4PO4 вследствие образования комплексных ионов [MgCl3]-, [MgCl4]-2.
3. Нагревание раствора до 75 - 100оС благоприятствует образованию кристаллического осадка.
4. Для ускорения выпадения осадка рекомендуется потереть стеклянной палочкой о стенки пробирки.
5. Если концентрация ионов Mg2+ очень мала, то осадок выпадает не сразу, поэтому раствору нужно дать постоять.
6. Реакция используется как дробная, поэтому мешающие ионы предварительно удаляют:
Sr2+, Ba2+ - осаждением (NH4)2SO4
Fe3+, Al3+, Cr3+ - раствором аммиака
Mn2+, Fe2+, Co2+ - окислением Н2О2
Действие 8-оксихинолина (С9Н6NOH).
Оксихинолин образует с аммиачными растворами солей магния зеленовато-желтый кристаллический осадок оксихинолината магния Mg(C9H6NOH)2.
Mg(NO3)2 + 2C9H6NOH ® Mg(C9H6NO)2 + 2HNO3
Проведение опыта:
К капле раствора соли магния Mg(NO3)2 прибавьте по капле растворов NH4Cl и NH4OH, а затем прибавьте одну каплю спиртового раствора оксихинолина, при этом выпадает зеленовато-желтый кристаллический осадок.
Условия реакции:
V- Осаждение следует проводить при рН = 8-13.
2. Осаждение лучше проводить при нагревании.
3. Катионы Ca2+, Sr2+,Ba2+ предварительно следует осадить сульфатом натрия.
Реакция Тананаева.
Эта реакция основана на том, что гидроокись магния, частично растворяясь в воде, создает рН = 10, при котором индикатор фенолфталеин образует ярко-красную окраску.
Выполнение реакции:
На полоску фильтровальной бумаги поместите каплю раствора Mg(NO3)2 и каплю 2N раствора NH4OH. Бумага окрасится в красный цвет, что зависит как от присутствия избытка NH4OH, так и от образования гидроокиси магния:
Mg(NO3)2 + 2NH4(OH) = Mg(OH)2 + 2NH4NO3
При этом аммиак и вода улетучиваются и красная окраска исчезает. Если теперь обработать бумажку каплей воды, то в присутствии Mg2+ она снова покраснеет вследствие частичного растворения Mg(OH)2:
Mg(OH)2 ® Mg2+ + 2OH
В отсутствие ионов Mg2+ бумага останется бесцветной. Реакции не мешают: K+,Na+, Sr2+, Ca2+, Ba2+.
Занятие 8-9. Химия р-элементов. Окислительно - восстановительные реакции.
Контрольные вопросы.
1. Свойства р-элементов.
2. Физические и химические свойства, строение соединений и их свойства, окислительно - восстановительные свойства азота, фосфора, кислорода, серы.
3. Окислительно-восстановительные системы. Типы окислительно-восстановительных реакций.
4. Потенциал реакции. (Э.д.с. реакции). Уравнение Нернста. Направление протекания окислительно-восстановительных реакций.
5. Влияние различных факторов на направление протекания окислительно-восстановительных реакций.
6. Использование окислительно-восстановительных реакций в аналитической химии.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окислительно - восстановительными:
2Mg0 + O20 ® 2Mg+2O-2
2KCl+5O3-2 –t°® 2KCl-1 + 3O20
2KI-1 + Cl20 ® 2KCl-1 + I20
Mn+4O2 + 4HCl-1 ® Mn+2Cl2 + Cl20 + 2H2O
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается:
H20 - 2ē ® 2H+
S-2 - 2ē ® S0
Al0 - 3ē ® Al+3
Fe+2 - ē ® Fe+3
2Br - - 2ē ® Br20
Процесс присоединения электронов - восстановление: При восстановлении степень окисления понижается.
Mn+4 + 2ē ® Mn+2
S0 + 2ē ® S-2
Cr+6 +3ē ® Cr+3
Cl20 +2ē ® 2Cl-
O20 + 4ē ® 2O-2
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями.
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Таблица 6.Важнейшие восстановители и окислители.
| Восстановители | Окислители |
| Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. | Галогены. Перманганат калия(KmnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KclO3). Анод при электролизе. |
Классификация окислительно-восстановительных реакций.
Межмолекулярные окислительно-восстановительные реакции.
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 ® S+4O2-2
S - восстановитель; O2 - окислитель
Cu+2O + C+2O ® Cu0 + C+4O2
CO - восстановитель; CuO - окислитель
Zn0 + 2HCl ® Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 ® I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 ® 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные реакции.
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 ® 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 - восстановитель
N-3H4N+5O3 –t°® N2+1O + 2H2O
N+5 - окислитель; N-3 - восстановитель
2Pb(N+5O3-2)2 ® 2PbO + 4N+4O2 + O20
N+5 - окислитель; O-2 - восстановитель
Диспропорционирование
окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH ® KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O ® 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 ® HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH ® KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных реакций.
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды:
| 2Cl1- – 2ē ® | Cl20 | ||
| MnO41- + 8H+ | + 5ē ® | Mn2+ + 4H2O | |
| 7+ | 2+ |
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
Типичные реакции окисления-восстановления.
Реакции с участием перманганата калия в качестве окислителя.
При взаимодействии перманганата калия с восстановителем образуются различные продукты восстановления в зависимости от pH среды.
Реакции в кислой среде.
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 ® 6K2S+6O4 + 2Mn+2SO4 + 3H2O
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O | |
| SO32- + H2O – 2ē ® SO42- + 2H+ |
2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O ® 3K2S+6O4 +2Mn+4O2¯ + 2KOH
| MnO41- + 2H2O + 3ē ® MnO2 + 4OH- | |
| SO32- + 2OH- - 2ē ® SO42- + H2O |
2MnO4- + 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Реакции в щелочной среде.
K2S+4O3 + 2KMn+7O4 + 2KOH ® K2S+6O4 +2K2Mn+6O4 + H2O
| SO32- + 2OH- - 2ē ® SO42- + H2O | |
| MnO41- + ē ® MnO42- |
SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Реакции с дихроматом калия в качестве окислителя
Степень окисления хрома понижается с +6 до +3.
K2Cr2+6O7 + 3H2S-2 + 4H2SO4 ® K2SO4 + Cr2+3(SO4)3 + 3S0¯ + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| H2S0 - 2ē ® S0 + 2H+ |
Cr2O72- + 8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S0
2.
K2Cr2+6O7 + 6Fe+2SO4 + 7H2SO4 ® 3Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)3 + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| Fe2+ - ē ® Fe3+ |
6Fe2+ + Cr2O72- + 14H+ ® 2Cr3+ + 6Fe3+ + 7H2O
3.
K2Cr2+6O7 + 14HCl-1 ® 3Cl20 + 2KCl + 2Cr+3Cl3 + 7H2O
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| 2Cl1- - 2ē ® Cl20 |
Cr2O72- + 6Cl- + 14H+ ® 2Cr3+ + 3Cl20 + 7H2O
Пероксид водорода в окислительно-восстановительных реакциях
Обычно пероксид водорода используют как окислитель:
H2O2 + 2HI-1 ® I20 + 2H2O
| 2I- - 2ē ® I20 | |
| H2O2 + 2H+ + 2ē ® 2H2O |
2I- + H2O2 + 2H+ ® I2 + 2H2O
При действии сильных окислителей пероксид водорода может окисляться, образуя кислород и воду.
5H2O2 + 2KMn+7O4 + 3H2SO4 ® 5O20 + K2SO4 + 2Mn2+SO4 + 8H2O
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O | |
| H2O2 - 2ē ® O2 + 2H+ |
2MnO4- + 5H2O2 + 16H+ ® 2Mn2+ + 8H2O + 5O2 + 10H+
или 2MnO4- + 5H2O2 + 6H+ ® 2Mn2+ + 8H2O + 5O2
Задачи:
- Что такое окислитель, восстановитель, степень окисления?
- Могут ли данные вещества проявлять в реакциях свойства окислителя: Mg, HNO2, HclO, S, Cr2O3, KOH? Приведите примеры реакций, подтверждающих Ваш ответ.
- Приведите 3 примера веществ, проявляющих как свойства окислителя, так и восстановителя.
- Можно ли окислить ионы Fe2+ хлором в стандартные условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
- Можно ли окислить ионы Fe2+ иодом в стандартных условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
- Закончите, схемы реакций, расставьте коэффициенты, используя электронно-ионные полуреакции:
KI + KIO3 + H2SO4 → I2 + …
P + KOH + H2O → PH3 + …
KmnO4 + FeCl3 + H2SO4 →
H2O2 + Fe2(SO4)3 + H2SO4 →
7. Уравняйте методом электронно-ионного баланса реакции
а) P + HNO3 + H2O → H3PO4 + NO2
б) Al + KOH + H2O → K[Al(OH)4] +H2
в) H2S + H2SO3 → S + H2O
8. Пользуясь табличными данными рассчитайте для стандартных условий Ео этих реакций
Рассчитайте величину окислительно-восстановительного потенциала
Cr2O7 2– + 14H+ +6 e = 2Cr 3+ + 7H2O
- при концентрациях [Cr2O7 2–] =[Cr 3+] = 0,1M и рН =1
- при стандартных концентрациях и t =30oC
9. Вычислить окислительно-восстановительный потенциал в растворе, содержащем:
а) MnO4- = 1 г-ион/л; Mn2+ = 1 г-ион/л; Н+ = 10-1 г-ион/л.
Б) MnO4- = 0,027 г-ион/л; Mn2+ = 0,013 г-ион/л; рН = 6,59.
10. Вычислить окислительно-восстановительный потенциал в растворе, содержащем 0,2 моль/л К2Сr2O7, 0,3 моль/л Cr2(SO4)3 и 0,5 моль/л HNO3.
Качественные реакции катионов р-элементов
В 5 пробирок поместите 3-4 капли солей Al3+, Sn2+, Sn4+.
Добавьте в каждую пробирку 1-2 капли 2М раствора NaOH. Обратите внимание на цвет осадков. Исследуйте их на растворимость в HCl и NaOH.
Напишите уравнения реакций
Обнаружение иона алюминия Al3+.
Реакция с NH4OH.
Гидроксид аммония образует с катионом Al3+ белый аморфный осадок Al(OH)3:
Al(NO3)3 + 3NH4OH → Al(OH)3 + 3NH4NO3
Выполнение реакции:
К 2-3 каплям раствора соли алюминия прибавьте 1-2 капли 2М раствора NH4OH, перемешайте. К полученному осадку прибавьте 3-4 капли насыщенного раствора NH4Cl. Что наблюдаете? Напишите уравнение реакции.
Условия реакции:
V- рН > 10. Избыток едких щелочей или кислот, растворяющих гидроксид
алюминия, препятствует образованию осадка.
2) Реакция идет в присутствии избытка NH4Cl для более полного осаждения
Al(OH)3 и лучшей коагуляции образовавшегося коллоидного раствора.
3)Реакцию следует проводить при нагревании до кипения.
4)Все катионы, образующие осадок с NH4OH должны отсутствовать.
Реакция с ализарином (1,2-диоксиантрахинон).
Ализарин со свежеосажденным Al(OH)3 образует трудно растворимое внутрикомплексное соединение ярко-красного цвета «алюминиевый лак».

Реакции мешают катионы Cr3+, Zn2+, Sn2+, Fe3+, поэтому реакцию в присутствии этих ионов следует проводить следующим образом:
На фильтровальную бумагу нанесите каплю раствора K4[Fe(CN)6]. В центр влажного пятна поместите каплю исследуемого раствора. При этом все мешающие алюминию катионы прореагируют с K4[Fe(CN)6], образовав осадок. Al3+ не взаимодействует с K4[Fe(CN)6], поэтому на пятно наносите
1-2 капли воды, и ионы Al3+ диффундируют вместе с водой на периферию пятна, где они могут быть открыты при помощи ализарина. Для этого пятно обработайте газообразным аммиаком с целью получения Al(OH)3, добавьте по периферии пятна 2-3 капли ализарина, бумагу высушите над горелкой. В присутствии алюминия появляется розовое кольцо на желтом фоне, если бумага подсушена или на фиолетовом фоне, если бумага не подсушена.
Условия реакции:
Среда нейтральная, т.к. свободная щелочь или кислота растворяют образующийся Al(OH)3.
Реакция с нитратом кобальта (фармакопейная)
Нитрат кобальта при прокаливании с солями алюминия образует алюминат кобальта синего цвета, называемый «тенаровой синью».
2Al2(SO4)3 + 2Co(NO3)2 → 2Co(AlO2)2 + 4NO2 + O2 + 6SO3
Реакцию проводят в тигле или платиновой петле, прокаливая соль алюминия, смоченную раствором соли кобальта.
Действие оксихинолина C6H6NOH
Уксуснокислый раствор оксихинолина осаждает алюминий в виде желтого осадка:
Al(NO3)3 + 3C9H6NOH = (C9H6NO3)3Al + 3HNO3
Условия реакции:
1. Реакция протекает в присутствии ацетатной буферной смеси
CH3COOH + CH3COONH4
2. Реакции мешают катионы:Fe2+, Fe3+, Zn2+, Cо2+, Ni2+, Mn2+, Cr3+,Bi3+, Hg2+, Sn2+, Sb3+.
Действие алюминона
Алюминон - соль ауринтрикарбоновой кислоты – C22H11O9(COONH4)3 образует с ионами Al3+ внутрикомплексную соль красного цвета:
C22H11O9(NH  )4 + Al(NO3)3 ® C22H11O9Al + 3NH4NO3
)4 + Al(NO3)3 ® C22H11O9Al + 3NH4NO3
Условия реакции:
1. Ацетатный буферный раствор СН3СООН + СН3СООNa
2. pH = 5
3. Нагревание на водяной бане, отсутствие ионов Fe3+. 
Реакции ионов олова Sn (II).
Раствор аммиака NH4OH с ионами олова (II) дает осадок Sn(OH)2, не растворимый в избытке реактива. К 2-3 каплям раствора соли олова (II) прибавьте 2-3 капли 2М раствора NH4OH, перемешайте и прибавьте избыток реактива. Что наблюдается? Напишите уравнение реакций.
Cоединения висмута (III ) восстанавливаются солями олова (II) в щелочной среде до металлического висмута.
Приготовьте в пробирке раствор Na 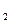 SnO2. Для этого к 2-3 каплям 1М раствора соли олова прибавьте 8-10 капель 2М раствора NaOH. К полученному раствору прибавьте 2-3 капли соли висмута (III). Через некоторое время выпадает черный осадок висмута (металлический). Напишите уравнение реакции.
SnO2. Для этого к 2-3 каплям 1М раствора соли олова прибавьте 8-10 капель 2М раствора NaOH. К полученному раствору прибавьте 2-3 капли соли висмута (III). Через некоторое время выпадает черный осадок висмута (металлический). Напишите уравнение реакции.
Реакции ионов Pb2+