Принцип. Осмотическая резистентность эритроцитов определяется по степени их гемолиза в гипотонических растворах хлорида натрия.
Реактивы.
1. Основной раствор, по осмотической концентрации соответствующий 10% хлориду натрия: двузамещенный фосфат натрия 27,31г; однозамещенный фосфат натрия 4,86г; хлорид натрия 180г; дистиллированная вода до 2л. рН основного раствора составляет 7,4.
2. Рабочий раствор - готовится из основного путем разведения в 10 раз. По осмотической концентрации он соответствует 1% раствору хлорида натрия.
3. Гепарин.
Ход определения. В две стерильные пробирки, содержащие по 2 капли гепарина, вносят по 1,5мл крови, хорошо перемешивают. Кровь из одной пробирки исследуют сразу же, а вторую – на следующий день, после инкубации в термостате при 37ºС в течение 24 часов.
| № пробирок | Количество 1% NaCl, мл | Дист. вода, мл | Концентрация NaCl | экстинция Е | Гемолиз, % | |
| Исслед. крови | В норме | |||||
| 5,0 | - | 1% | контроль | 0% | ||
| 4,25 | 0,75 | 0,85% | ||||
| 3,75 | 1,25 | 0,75% | ||||
| 3,5 | 1,5 | 0,7% | ||||
| 3,25 | 1,75 | 0,65% | ||||
| 3,0 | 2,0 | 0,6% | ||||
| 2,75 | 2,25 | 0,55% | ||||
| 2,5 | 2,5 | 0,5% | 0-6% | |||
| 2,25 | 2,75 | 0,45% | 5-45% | |||
| 2,0 | 3,0 | 0,4% | 50-100 | |||
| 1,75 | 3,25 | 0,35% | 90-100 | |||
| 1,5 | 3,5 | 0,3% | 97-100 | |||
| 1,0 | 4,0 | 0,2% | 98-100 | |||
| 0,5 | 4,5 | 0,1% | 100% | 100% |
В 14 центрифужных пробирках готовят ряд разведений из рабочего раствора хлорида натрия в соответствии с таблицей. В каждую пробирку вносят по 1 капилляру Сали гепаринизированной крови. Перемешивают содержимое всех 14 пробирок, начиная с первой, и оставляют стоять 30 минут при комнатной температуре. Центрифугируют содержимое пробирок в течение 5 минут при 2000 об/мин. Колориметрируют надосадочные жидкости пробирок №№ 2-14 при условиях: светофильтр – зеленый (длина волны 500-560нм); кювета 10мм; против холостой пробы. Холостая проба - надосадочная жидкость в пробирке, содержащей 1% раствор NaCl (пробирка № 1). На следующий день повторяют исследование с инкубированной кровью, так как при некоторых видах гемолитических анемий понижение осмотической резистентности эритроцитов выявляется только после инкубации.
Расчет.
Процент гемолиза рассчитывают для пробирок № 2-13 (пробирка № 1 – холостая проба, гемолиз в пробирке № 14 принимается за 100%). Расчет ведут по формуле: 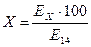 , где
, где
Х - процент гемолиза исследуемой пробы;
Ех – экстинция исследуемой пробы;
Е14 – экстинция надосадочной жидкости в пробирке с 0,1% NaCl (пробирка № 14);
100 – процент гемолиза в пробирке № 14.
Нормальные величины. В свежей крови начало гемолиза отмечается при концентрации хлорида натрия 0,5-0,45%, а полный гемолиз – при 0,4-0,35%.
Клинико-диагностическое значение. Исследование осмотической резистентности эритроцитов проводят при подозрении на гемолитическую анемию. Понижение осмотической резистентности эритроцитов, то есть появление гемолиза при более высокой, чем в норме, концентрации хлорида натрия (0,7-0,75%) характерно для наследственного микросфероцитоза. Повышение осмотической резистентности эритроцитов наблюдается при талассемии и гемоглобинопатиях.
4.9. ЗАКЛЮЧИТЕЛЬНЫЕ КОНТРОЛЬНЫЕ ВОПРОСЫПО ТЕМЕ «АНЕМИИ»
Установите соответствие между элементами в столбцах. Одному элементу в левом столбце соответствует только один элемент в правом столбце.
1. Виды анемий и причины их развития:
1) постгеморрагические а) угнетение кроветворения
2) гипопластические б) усиленный гемолиз эритроцитов
в) кровопотери
г) изменение структуры глобина.
2. Изменение отдельных свойств эритроцитов и термины для их обозначения:
1) размера а) пикноз
2) формы б) агранулоцитоз
3) цвета в) анизохромия
г) пойкилоцитоз
д) анизоцитоз.
3. Диаметр различных видов эритроцитов (мкм):
1) нормоцитов а) 2-3
2) макроцитов б) 5-6
3) микроцитов в) 7-8
г) 9-12
д)12-15.
4. Форма различных эритроцитов:
1) дрепаноцитов а) двояковогнутых дисков
2) сфероцитов б) мишеней
в) шаров
г) серпов.
5. Различные виды анемий и характерные для них формы эритроцитов:
1) серповидноклеточная а) акантоциты
2) талассемия б) дрепаноциты
в) мишеневидные эритроциты
г) микросфероциты.
6. Включения в эритроцитах и методы окраски для их выявления:
1) тельца Жолли а) по Граму
2) тельца Гейнца б) по Романовскому
3) негемоглобиновое железо в) суправитальная окраска
г) реакция на берлинскую лазурь
д) метиленовым синим.
7. Гематокритная величина в норме (%):
1) у мужчин а) 30-35
2) у женщин б) 36-42
в) 40-48
г) 50-55.
8. Форма изменения морфологии эритроцитов при В12-дефицитной анемии:
1) анизоцитоз а) микросфероцитоз
2) анизохромия б) мегалоцитоз
в) гиперхромия
г) полихроматофилия.
9. Различные виды анемий и количество ретикулоцитов при них(‰):
1) В12-дефицитная а) 0
2) талассемия б) 0,5-1,0
3) апластическая в) 5-10
г) 5-12
д) 15-25.
10. Осмотическая резистентность эритроцитов в норме (концентрация NaCl, %):
1) начало гемолиза а) 0,25-0,3
2) конец гемолиза б) 0,35-0,4
в) 0,45-0,5
г) 0,65-0,7.
Глава 5
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ ПРИ ЛУЧЕВОЙ БОЛЕЗНИ
Лучевая болезнь развивается в результате воздействия ионизирующего облучения. В зависимости от длительности облучения различают острую и хроническую лучевую болезнь.
5.1.ОСТРАЯ ЛУЧЕВАЯ БОЛЕЗНЬ
Острая лучевая болезнь (ОЛБ) может быть результатом ядерного взрыва, нарушения правил ТБ или ошибки персонала, использующего источники ионизирующего облучения, аварии систем, содержащих радионуклиды, применения высоких доз ионизирующего излучения с лечебной целью, случайного облучения. Типичная острая лучевая болезнь возникает вследствие кратковременного (от секунд до 3-х суток) общего внешнего облучения или поступления внутрь радионуклидов, создающих в теле поглощенную дозу более 1 Грея.
Один Грей равен поглощенной дозе ионизирующего излучения, при которой веществу с массой в 1кг передается энергия ионизирующего излучения, равная 1 Дж. В практике распространена также внесистемная единица – рад. 1 Грей = 100 рад.
Основным патогенетическим механизмом острой лучевой болезни является повреждение ионизирующим излучением высокочувствительных к нему тканей: костного мозга, эпителия кожи и тонкого кишечника. Клетки костного мозга обладают разной чувствительностью к ионизирующей радиации. Наиболее чувствительны к ней бластные клетки и лимфоциты, поэтому снижение уровня лимфоцитов в периферической крови является ранним признаком острого лучевого поражения, по которому определяют предполагаемую дозу полученного облучения.
В зависимости от дозы облучения развивается та или иная форма острой лучевой болезни.
При дозе 1-10 Грей развивается костномозговая форма острой лучевой болезни, при которой доминирует поражение органов кроветворения. Ведущим является гематологический синдром. В зависимости от дозы облучения и степени тяжести заболевания костномозговая форма ОЛБ может закончиться полным выздоровлением, неполной ремиссией или привести к смерти больного. При всех остальных формах ОЛБ прогноз жизни абсолютно неблагоприятный.
При дозе 10-20 Грей развивается кишечная форма острой лучевой болезни, для которой характерно поражение ЖКТ с отторжением слизистой оболочки тонкого кишечника, обезвоживанием организма и смертельным исходом на 10-14 день.
При дозе 20-80 Грей развивается токсическая форма острой лучевой болезни. На первый план выступает резкая интоксикация организма продуктами белкового распада – азотемия, сосудистая недостаточность, прогрессирующая цитопения. Смерть наступает на 5-7 день болезни.
При дозе более 80-100 Грей развивается церебральная форма острой лучевой болезни с прогрессирующим отеком мозга, нарушением регуляции дыхания и кровообращения. Смерть наступает от комы в первые часы или дни после облучения.
Течение костномозговой формы острой лучевой болезни четко делится на 4 фазы.
I фаза (первичной реакции) длится от 1 до 3 суток, характеризуется диспепсическими расстройствами (тошнотой, рвотой) и нарушением гемодинамики. В костном мозге уже в это время начинается гибель молодых клеточных элементов. В периферической крови уменьшается количество лейкоцитов и, в первую очередь, лимфоцитов – развивается абсолютная лимфоцитопения, глубина которой зависит от полученной дозы облучения.
II фаза (латентный период, или кажущегося клинического благополучия) в зависимости от дозы облучения длится от 10-15 дней до 4-5 недель. Характеризуется общим удовлетворительным состоянием больных при постепенном нарастании изменений в радиочувствительных тканях – продолжается гибель молодых клеток в костном мозге, происходит подавление сперматогенеза, начинается энтерит, выпадение волос, поражение кожи. В периферической крови нарастает лейкопения, абсолютная лимфоцитопения. Уменьшается количество тромбоцитов, ретикулоцитов, эритроцитов. В пунтате костного мозга выявляется угнетение всех трех ростков кроветворения.
III фаза (выраженных клинических проявлений, разгар болезни) характеризуется крайне тяжелым состоянием больных, у которых наблюдается резкое угнетение иммунитета с инфекционными осложнениями, геморрагически-некротические пневмонии, повышение температуры тела до 40-41˚С, язвенно-некротическое поражение полости рта, глотки, кожи, нарушение сознания, кровотечения, облысение. В периферической крови развивается панцитопения. Количество лейкоцитов продолжает уменьшаться. При тяжелых формах болезни развивается агранулоцитоз, угнетение кроветворной функции костного мозга (гипоплазия) сменяется его опустошением (аплазией).
При дозах более 2,5-3,0 Грей и несвоевременном или нерациональном лечении в этот период возможен смертельный исход. В случае выздоровления к концу III фазы в костном мозге появляются молодые клеточные формы. III фаза продолжается не более 2-3 недель.
IV фаза (восстановительная) длится от 3-6 месяцев до 1-2 лет. Общее состояние больных медленно улучшается, температура тела нормализуется, исчезают геморрагические проявления, некротические массы отторгаются, эродированные поверхности заживают. Со 2-5 месяца начинается рост волос. Постепенно восстанавливается гемопоэз – в костном мозге увеличивается общее количество клеток, появляются молодые клетки всех трех ростков. В периферической крови растет количество эритроцитов, лейкоцитов, тромбоцитов, нормализуется СОЭ.
Отдаленные последствия острой лучевой болезни. Даже если острая лучевая болезнь закончилась полным клиническим выздоровлением, у людей, перенесших её, впоследствии могут развиться катаракта, нестойкая и неглубокая лейкопения, гранулоцитопения, тромбоцитопения, снижение способности к деторождению, оплодотворению, опухоли, лейкозы.
5.2.ХРОНИЧЕСКАЯ ЛУЧЕВАЯ БОЛЕЗНЬ
Хроническая лучевая болезнь (ХЛБ) – это сложный клинический синдром, развивающийся при длительном лучевом воздействии небольшими дозами облучения, когда суммарная доза превышает 1 Грей. Хроническая лучевая болезнь характеризуется изменениями в различных органах и системах, а также длительностью и волнообразностью течения. При этом наблюдается нарушение нейрососудистой регуляции, хроническая недостаточность периферического кровообращения, снижение артериального давления, изменение структуры капилляров, угнетение секреции ЖКТ (снижение кислотности желудочного сока, уменьшение активности ферментов пищеварительных соков), в крови наблюдаются лейкопения, нейтропения, тромбоцитопения, анемия.
В зависимости от полученной дозы, сроков действия радиации, индивидуальной чувствительности организма хроническая лучевая болезнь имеет три степени тяжести: 1 (легкая), 2 (средней тяжести) и 3 (тяжелая).
При легкой степени ХЛБ в периферической крови и костном мозге мало изменений. Анемии, как правило, не наблюдается. Несколько уменьшено содержание ретикулоцитов. Отмечается тенденция к лейкопении с нейтропенией и относительным лимфоцитозом, но количество лейкоцитов не ниже 3,0·109/л. Количество тромбоцитов незначительно уменьшено с увеличением количества старых и нефункционирующих тромбоцитов. В костном мозге количество клеток обычно нормальное.
При второй (средней) степени тяжести ХЛБ отмечается умеренная анемия и значительная лейкопения - до 1,5-2,5·109/л с резко выраженной гранулоцитопенией и относительным лимфоцитозом (абсолютное количество лимфоцитов уменьшено). Нарастает тромбоцитопения и ретикулоцитопения. В костном мозге снижено количество клеток.
При третьей (тяжелой) степени ХЛБ угнетены все ростки кроветворения. Нарушается созревание клеток. Отмечается стойкая лейкопения (количество лейкоцитов 1,0·109/л и меньше) за счет нейтропении, абсолютная лимфоцитопения. Возможно развитие агранулоцитоза. Уровень тромбоцитов снижен до 50·109/л и ниже. Эритроцитов менее 1,5-2,0·1012/л. В костном мозге резко снижено общее количество клеток. Развивается гипоплазия, а затем – аплазия (опустошение) костного мозга. Исход заболевания различен: может быть неполная клинико-гематологическая ремиссия, летальный исход, развитие хронического миелолейкоза или острого лейкоза.
К отдаленным последствиям хронической лучевой болезни относятся гипопластические состояния костного мозга, лейкозы, опухоли легких, печени, рак кожи, ускоренная инволюция (старение).
Контрольные вопросы по теме «Лучевая болезнь»
1. Причины развития острой и хронической лучевой болезни.
2. Какие формы острой лучевой болезни развиваются при разных дозах облучения?
3. Что такое радиочувствительные ткани? Перечислите их.
4. Какой гематологический показатель является ранним признаком острой лучевой болезни?
5. Какие процессы происходят в костном мозге под воздействием ионизирующей радиации?
6. Каков прогноз для жизни и здоровья при острой лучевой болезни?
7. Отдаленные последствия острой лучевой болезни.
8. Какое время требуется для восстановления кроветворения после острой лучевой болезни?
9. Какие органы и системы поражаются при хронической лучевой болезни?
10. Какова регенераторная способность костного мозга при хронической лучевой болезни?
Глава 6
ЛЕЙКОЗЫ
Лейкозы, лейкемии [от греч. leukos белый] - это опухолевые клоновые заболевания кроветворной системы, развивающиеся в костном мозге.
6.1. ЭТИОЛОГИЯ, ПАТОГЕНЕЗ, КЛАССИФИКАЦИЯ ЛЕЙКОЗОВ
В основе лейкозов лежит соматическая мутация на уровне стволовой полипотентной клетки и клеток-предшественников II и III классов.
Причины возникновения лейкозов, несмотря на многочисленные исследования, до настоящего времени полностью не выяснены. Существуют вирусная, химическая, эндогенная (обменная) и радиационная теория их происхождения. Вирусная теория предполагает наличие в организме латентных лейкозогенных вирусов, которые под влиянием различных факторов (химических веществ-канцерогенов, облучения и др.) активируются, внедряются в ядро кроветворной клетки и изменяют её ДНК, превращая в злокачественную. Существенную роль в возникновении лейкозов играют генетические факторы.
Все лейкозы имеют клоновый [от греч. klon отпрыск] характер роста, то есть происходят от одной клетки, подвергшейся мутации. Первичный опухолевый клон какое-то время сосуществует с нормальным клоном, но, обладая преимуществом в росте, опухолевый клон приводит к сокращению объема нормального гемопоэза, замене здоровой кроветворной ткани на лейкозную ткань, вытеснению нормальных ростков кроветворения. Воздействие вредных факторов приводит к образованию лейкозного клона в среднем через 3,5 года (минимально – через 1 год; максимально – через 10 лет).
Различают острые и хронические лейкозы. Деление лейкозов на острые и хронические является не клиническим, а цитоморфологическим, т.е. отражает степень анаплазии лейкозных клеток. Анаплазия [от лат. аna обратно + plasis образование] – стойкая утрата клетками специфических свойств с возвращением к более примитивному строению и функциям, потеря способности образовывать специфические структуры и продукты.
Для лейкозов характерна опухолевая прогрессия, то есть нарастание злокачественных свойств. В основе этого процесса лежат многократные мутации в лейкозных клетках. Новые клоны клеток могут оказаться нечувствительными к лекарственным препаратам, и течение лейкоза становится более тяжелым и прогрессирующим. Хронический лейкоз имеет тенденцию трансформироваться в острый лейкоз за счет появления более патологических клонов клеток, обладающих свойствами «бластов». В то же время острый лейкоз никогда не переходит в какой-либо вариант хронического.
Материалом для изучения кроветворной функции при лейкозах служат мазки периферической крови, пунктаты костного мозга, лимфатических узлов, селезенки, а также препараты, полученные в результате трепанобиопсии подвздошной кости. Современная лабораторная диагностика лейкозов включает в себя микроскопическое исследование окрашенных препаратов, цитохимические исследования, иммунофенотипирование клеток, составляющих субстрат опухоли, и их цитогенетическое исследование.
Развитие лейкозов обычно сопровождается изменением качественного и количественного состава лейкоцитов периферической крови. На начальных стадиях заболевания опухолевые клетки в крови могут отсутствовать (алейкемическая стадия), однако по мере прогрессирования опухолевого процесса они появляются сначала в небольшом количестве (сублейкемическая стадия), а затем, в разгар болезни – в большом и очень большом количестве, часто при увеличении общего количества лейкоцитов (лейкемическая стадия).
6.2. ОСТРЫЕ ЛЕЙКОЗЫ
Острый лейкоз (ОЛ) – это опухолевое клоновое заболевание кроветворной системы с первичным поражением костного мозга, при котором субстрат опухоли составляют бластные клетки.